Konformation und Konstitution
Den Begriff der Konformation kennen Sie vielleicht schon aus dem Biologie-Unterricht. Ein Enzym kann seine Konformation ändern und dadurch von einem inaktiven in einen aktiven Zustand übergehen. Bei der allosterischen Enzymregulation wird die Konformation des Enzyms durch kleine Moleküle verändert, die als Aktivatoren oder Inhibitoren an das Enzym andocken.
Eine Konformationsänderung ist nichts anderes als die Veränderung der räumlichen Anordnung der Atome, ohne dass irgendwelche Bindungen aufgebrochen werden müssen.
Beim Ethan-Molekül beispielsweise kann sich die vordere Methylgruppe gegenüber der hinteren Methylgruppe frei drehen - und schon haben wir eine andere Konformation. Die Konstitution des Ethan-Moleküls dagegen ist durch dieses Drehen absolut gleich geblieben. Immer noch besteht das Molekül aus zwei Methylgruppen, die durch eine C-C-Einfachbindung miteinander verbunden sind.
Studienvorbereitung:
Konformations-Isomerie von Ethan und ButanDie Konformationen des Ethans, Propans und Butans werden auf dieser Vertiefungsseite beschrieben. Stichwort: verdeckte und gestaffelte Konformation beim Ethan und Propan, zusätzlich eine gauche-Konformation beim Butan.
Fallbeispiele Butan und Pentan
Betrachten wir die beiden Formen des Butans, das n-Butan und das Methylpropan:
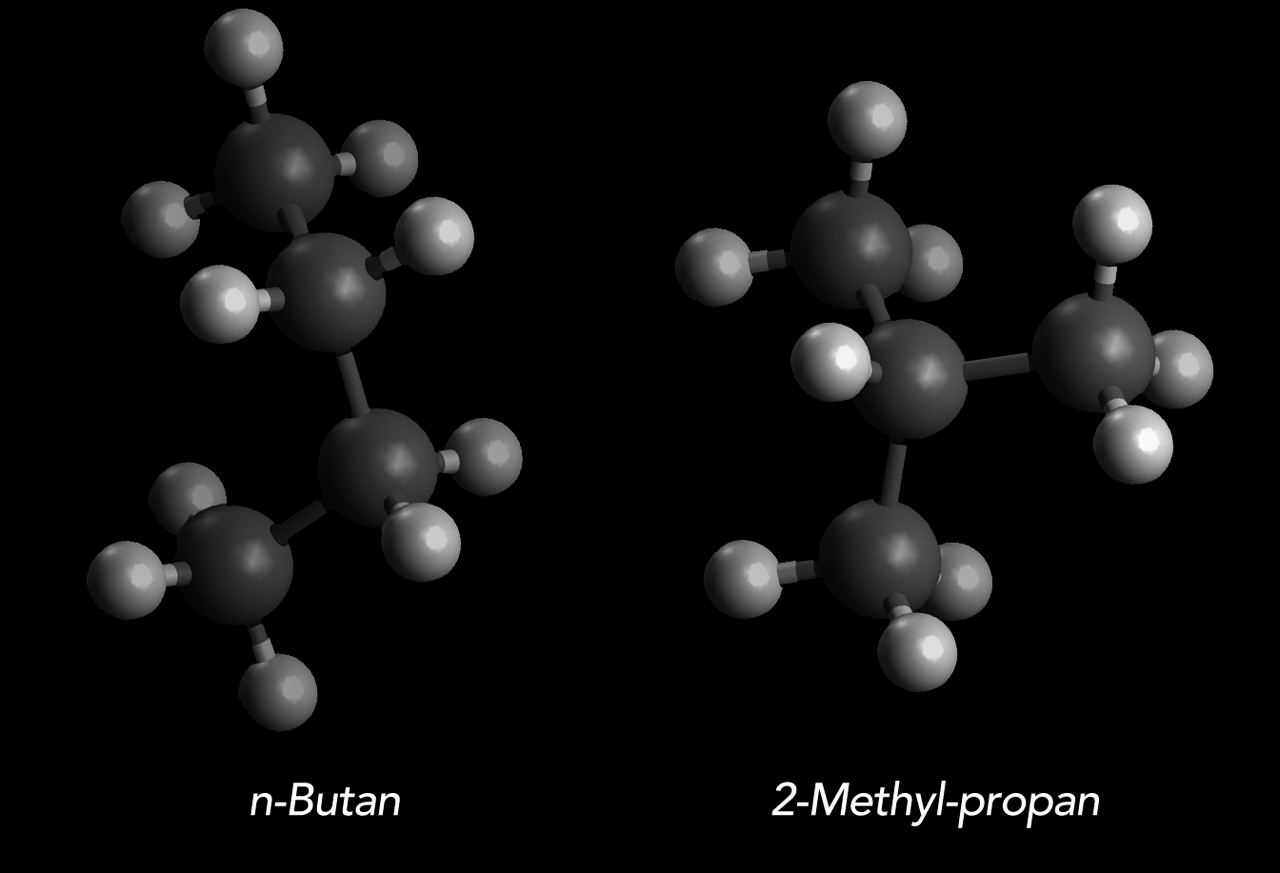
Das "normale" Butan oder n-Butan sowie das 2-Methyl-propan
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Beide Butane haben die gleiche Summenformel (C4H10), aber unterschiedliche Strukturformeln und damit auch unterschiedliche Konstitutionen. Was wir hier sehen, ist ein typisches Beispiel für Konstitutions-Isomerie.
Beim Pentan gibt es sogar drei Konstitutions-Isomere:

Die drei Pentan-Isomere
Autor: Ulrich Helmich 2024, Lizenz: siehe Seitenende
Können Sie diese drei Pentan-Isomere korrekt benennen?
Hier die Lösung, von links nach rechts: n-Pentan, Methylbutan, Dimethylpropan.
Siedepunkte der Isomere
Nach dem Struktur-Eigenschafts-Konzept hängen die Eigenschaften eines Stoffes stark von seiner Struktur ab. Ein wichtiges Lernziel im Chemieunterricht ist es, dass Sie die die Eigenschaften einer Verbindung mit Hilfe ihre molekulare Struktur erklären können. Die beiden Butan-Isomere und die drei Pentan-Isomere sind das Musterbeispiel für die Anwendung dieses wichtigen Konzepts.
Fallbeispiel Butan
Das 2-Methyl-propan hat nun eine eher "kugelförmige" Struktur, während das n-Butan eher langgestreckt ist.
n-Butan hat einen Siedepunkt von -1 ºC, Methylpropan einen Siedepunkt von -11,7 ºC. Wie erklärt sich dieser Unterschied?
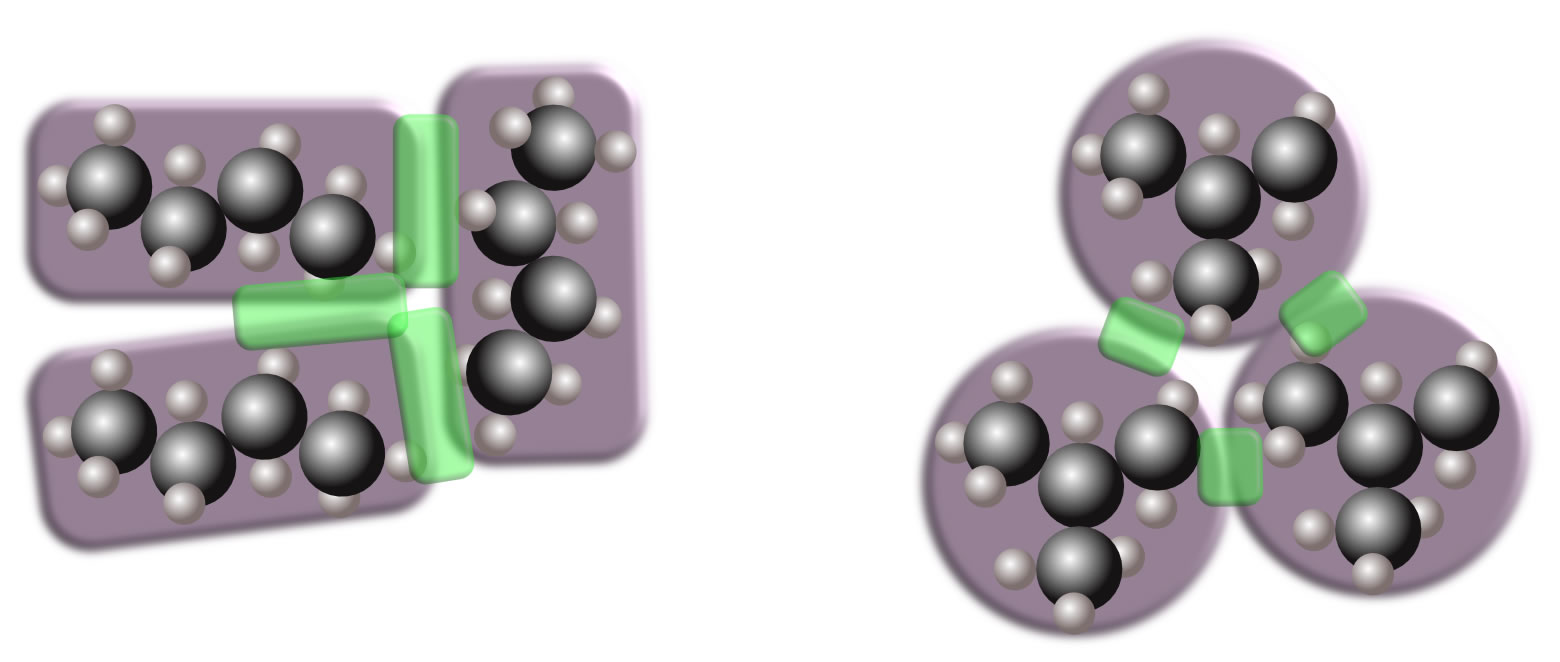
Kontaktflächen zwischen jeweils drei Molekülen n-Butan und Methylpropan
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Die langgestreckten n-Butan-Moleküle haben eine größere gemeinsame Kontaktfläche als die eher kugelförmigen Methylpropan-Moleküle. Die Kontaktflächen sind in der Abbildung grün hervorgehoben. An diesen Kontaktflächen finden nun die van-der-Waals-Wechselwirkungen zwischen den einzelnen Molekülen statt. Beim n-Butan sind diese Wechselwirkungen größer also beim Methylpropan, entsprechend höher sollte der Energiebetrag sein, der zum Auftrennen dieser Molekülverbände notwendig ist. Und das wiederum sollte sich in der höheren Siedetemperatur des n-Butans widerspiegeln.
Fallbeispiel Pentan
Bevor man jetzt eine allgemeine Regel aufstellt, sollte man die Hypothese noch an einem anderen Beispiel überprüfen. Hängt der Siedepunkt eines Alkan-Isomers tatsächlich von der räumlichen Gestalt der Moleküle ab? Schauen wir uns dazu die Siedepunkte der drei Pentan-Isomere an:
- n-Pentan: 36,1 ºC
- Methylbutan: 27,8 ºC
- Dimethylpropan: 9,5 ºC
Das am stärksten verzweigte Isomer, das Dimethylpropan, hat den niedrigsten Siedepunkt, das am wenigsten verzweigte Isomer (n-Pentan) den höchsten.
Fallbeispiel Hexan
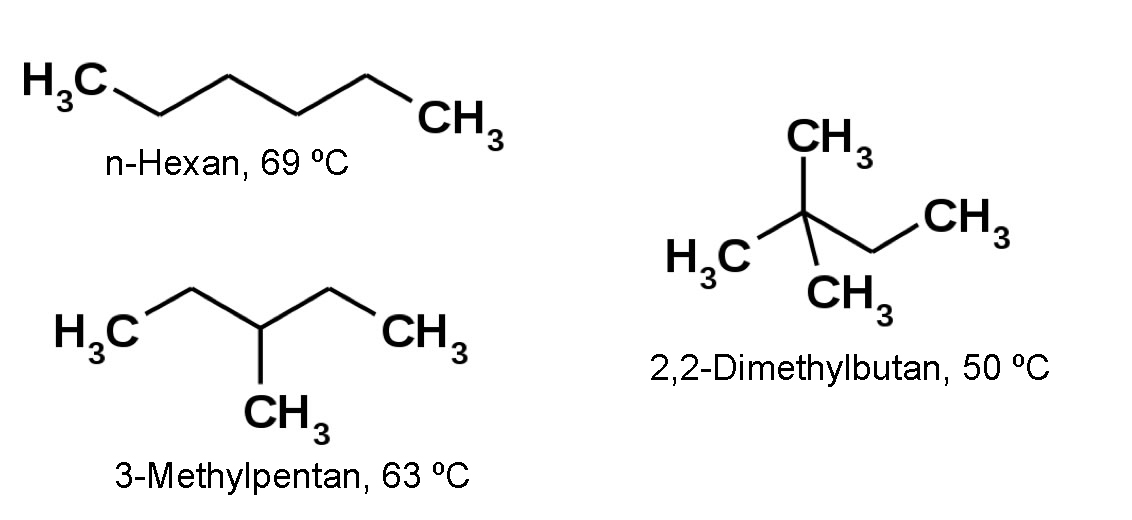
Siedepunkte von drei verschiedenen Hexanen
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende
Auch die drei gezeigten Hexan-Isomere bestätigen unsere Hypothese. Das 2,2-Dimethylbutan hat den niedrigsten Siedepunkt, das n-Hexan den höchsten.
Unsere Hypothese, dass die Siedepunkte der Alkane von der Kontaktfläche zwischen den Molekülen abhängen, hat sich also bestätigt. Ein mathematisch exakter Beweis ist das natürlich noch nicht, aber die Chemie ist ja auch keine Mathematik.
Seitenanfang -
Methan -
Ethan -
höhere Alkane -
Nomenklatur -
Isomerie -
physik. Eigensch. -
Gewinnung -
Reaktionen -
Abitur NRW