Diese Seite richtet sich an Schüler(innen) der Sekundarstufe II und enthält wesentlich mehr Informationen zum Ethan als die meisten Schulbücher.
Auf dieser Seite im Chemie-Lexikon erfahren Sie alles über die Konformationen des Ethan-Moleküls, über verschiedene Synthesewege, über weitere Reaktionen des Ethans und mehr.
Zielgruppe dieser Lexikon-Seite sind wissbegierige Schüler(innen) eines Chemie-Leistungskurses sowie Studierende der Chemie, Biologie, Medizin oder Pharmazie in den Anfangssemestern des Grundstudiums / Bachelor-Studiengangs.
Struktur
Konstitution
Das zweiteinfachste Alkan nach dem Methan ist das Ethan C2H6, seine Konstitution kann beschrieben werden als "ein C-Atom, das über eine kovalente Einfachbindung mit einem zweiten C-Atom verbunden ist. Jedes der beiden C-Atome ist außerdem mit drei H-Atomen verbunden".
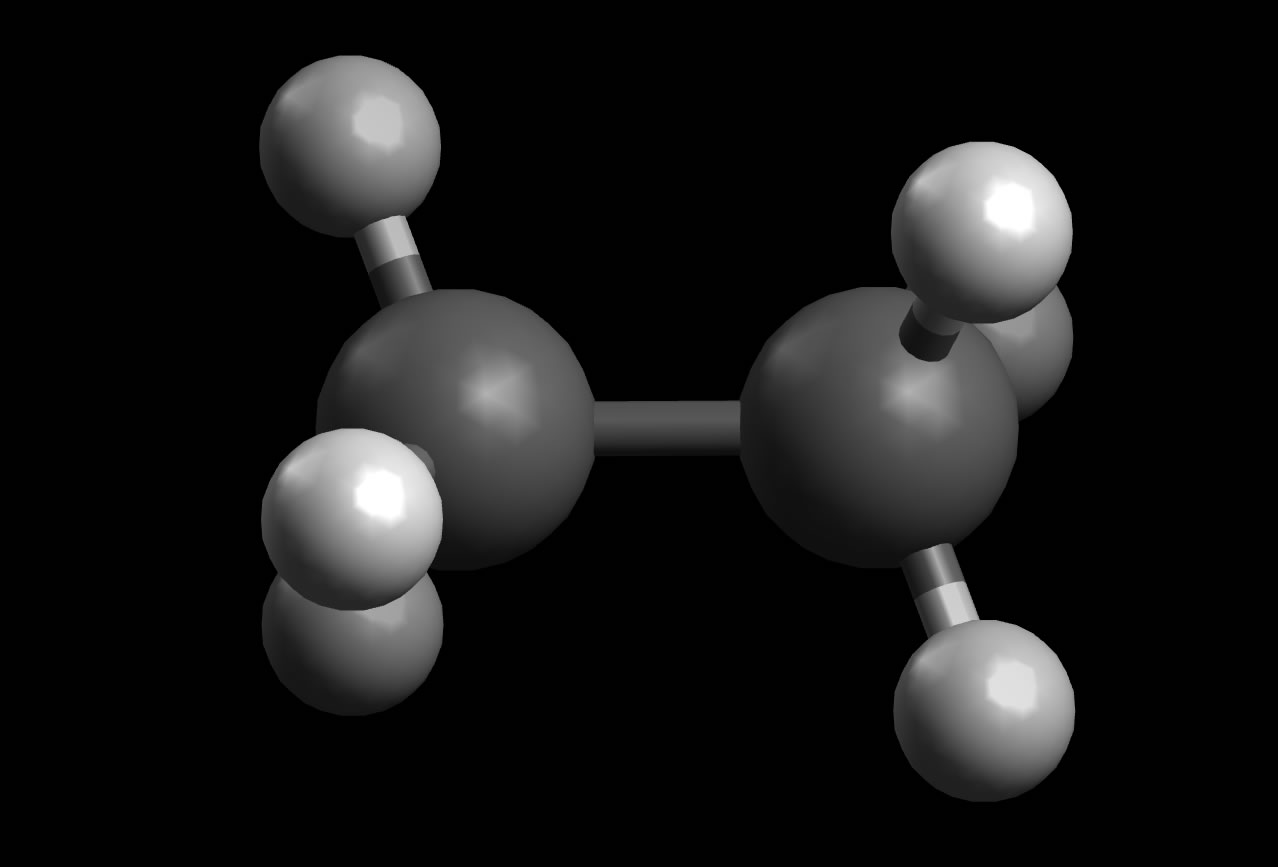
Das Ethan-Molekül (Kugel-Stab-Modell)
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Strukturdaten
Alle Bindungswinkel im Ethan-Molekül betragen 109,5º. Dies entspricht genau dem Tetraederwinkel, der für das vierbindige C-Atom charakteristisch ist . Die sechs C-H-Bindungen sind relativ unpolar, da der EN-Unterschied zwischen Kohlenstoff (2,55) und Wasserstoff (2,20) recht klein ist. Die C-C-Einfachbindung ist natürlich völlig unpolar!
Die Bindungslänge der C-H-Bindungen beträgt 109 pm, während die C-C-Bindung 154 pm lang ist.
Physikalische Eigenschaften
Der Schmelzpunkt von Ethan liegt mit -172 ºC sehr niedrig, der Siedepunkt beträgt -88,6 ºC, das ist deutlich höher als der von Methan.
Ansonsten ist Ethan farb- und geruchlos; seine Dichte beträgt 1,36 g/l bei 0 ºC, was etwas geringer ist als die Dichte von Sauerstoff (1,43 g/l) und Stickstoff (1,25 g/l). Somit ist Ethan etwas leichter als Luft, aber schwerer als Methan (0,656 g/l).
Auf dieser Seite wird näher auf die physikalischen Eigenschaften der Alkane eingegangen und vor allem auf die Frage, wieso die Alkane diese Eigenschaften haben (Struktur-Eigenschafts-Beziehungen).
Reaktionen
Als Alkan geht Ethan vornehmlich zwei Reaktionen ein: Einmal die Oxidation zu Kohlendioxid und Wasser, und dann die Reaktion mit Halogenen zu Halogenethan. In der Industrie wird Ethan außerdem zur Synthese von Ethen verwendet.
Informationen zu den Reaktionen der Alkane allgemein finden Sie auf dieser Seite.
Oxidation
Bei der Reaktion mit Sauerstoff nach der Gleichung
$C_2H_6 + 3,5 \ O_2 \to 2 \ CO_2 + 3 \ H_2O \ \ \ \Delta H = -1559,7 kJ/mol$
wird eine große Menge an Wärmeenergie freigesetzt, was vor allem bei der Verbrennung von Erdgas eine wichtige Rolle spielt.
Halogenierung
Durch Reaktion mit Chlor (oder Brom) kann man aus Ethan verschiedene Chlor- bzw. Brom-Ethane herstellen.
$C_2H_6 + Cl_2 \to C_2H_5Cl + HCl$
$_2H_5Cl + Cl_2 \to C_2H_4Cl_2 + HCl$
Bei einem hohen Chlor-Überschuss entstehen noch stärker substituierte Chlor-Ethane. Diese Verbindungen sind wichtige Lösemittel und Ausgangsstoffe für weitere Synthesen.
Seitenanfang -
Methan -
Ethan -
höhere Alkane -
Nomenklatur -
Isomerie -
physik. Eigensch. -
Gewinnung -
Reaktionen -
Abitur NRW