Die Aktivität eines Enzyms kann durch Außenfaktoren wie Temperatur und pH-Wert beeinflusst werden, wie auf den vorherigen Seite bereits ausgeführt wurde. Von einer Regulation kann hier jedoch nicht die Rede sein.
Bevor wir nun auf die verschiedenen Mechanismen der reversiblen und irreversiblen Enzymhemmung eingehen, wollen wir zwei auch für den Schulunterricht wichtige Konzepte kennen lernen, nämlich die Endprodukthemmung und die Substratinduktion.
A. Zwei wichtige Konzepte
1. Endprodukthemmung
Betrachten wir eine Stoffwechselkette, die aus einem Ausgangsstoff A, mehreren Zwischenprodukten B, C, D und einem Endprodukt E besteht:
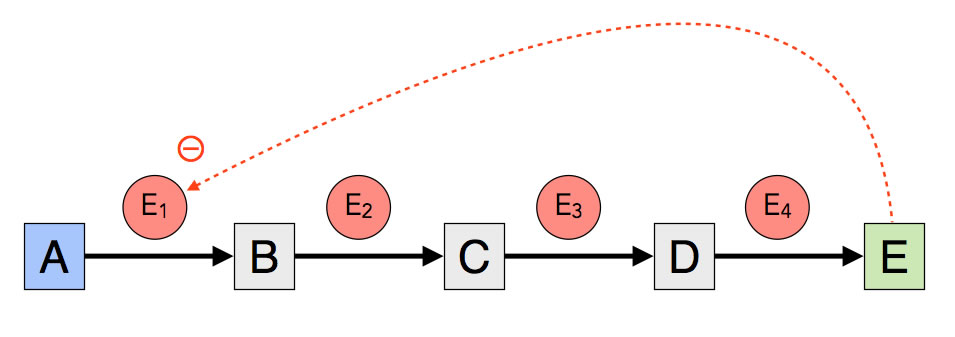
Endprodukthemmung
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Bei der Endprodukthemmung bewirkt das Endprodukt E der Stoffwechselkette eine Hemmung der gesamten Kette, meistens indem die Aktivität des ersten Enzyms der Stoffwechselkette reduziert wird.
Wieso wird gerade das erste Enzym gehemmt?
Das Endprodukt ist in unserem Beispiel in der Lage, das erste Enzym E1 der Stoffwechselkette zu hemmen. Das ist ja auch durchaus biologisch sinnvoll. Warum soll die Zelle weiteres Endprodukt herstellen, wenn schon genug davon vorhanden ist? Das wäre in höchstem Maße unwirtschaftlich. Die Tätigkeit der Enzyme verbraucht viel ATP und andere Ressourcen, und warum sollte der Stoff A unnötig verbraucht werden, wenn schon genug Endprodukt da ist?
Die Hemmung des ersten Enzyms der Stoffwechselkette ist strategisch optimal. So wird die ganze Stoffwechselkette unterbrochen. Würde beispielsweise nicht E1 gehemmt, sondern E4, dann würden die drei Enzyme E1, E2 und E3 völlig sinnfrei weiterarbeiten und Ressourcen verbrauchen. Außerdem würde sich der Stoff D in der Zelle akkumulieren (ansammeln, anhäufen) und könnte nicht abgebaut werden.
Wenn dagegen das erste Enzym E1 gehemmt wird, wird das Substrat A nicht mehr abgebaut, und die Zwischenprodukte B, C, D sowie das Endprodukt E werden nicht mehr gebildet. Es werden keine Rohstoffe und keine Energie mehr verschwendet, und die Zwischenprodukte können in der Zelle nicht mehr akkumuliert werden.
Bei der Endprodukthemmung einer Stoffwechselkette ist es am günstigsten, wenn das Endprodukt der Kette das erste Enzym der Kette hemmt.
2. Substratinduktion
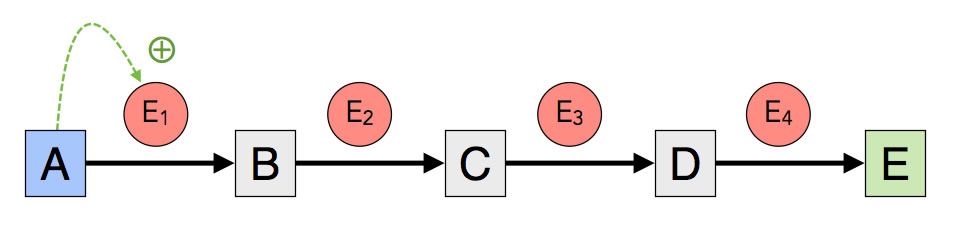
Substratinduktion
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei der Substratinduktion ist die Stoffwechselkette, die zum Abbau eines Substrates benötigt wird, zunächst inaktiv, weil das erste Enzym der Stoffwechselkette in einer inaktiven Konformation vorliegt. Erst durch die Anwesenheit des Substrats ändert sich die Konformation dieses Schlüsselenzyms, so dass es in aktiver Form vorliegt.
Substratinduktion findet häufig statt, wenn ein bestimmter Nährstoff abgebaut werden soll, der vorher nicht verfügbar war. Wenn Bakterien beispielsweise der Nährstoff Glucose ausgeht, sie dafür aber den Zucker Lactose im Medium vorfinden, werden Enzyme zum Lactose-Abbau aktiviert, die vorher eher passiv waren.
Allerdings verläuft die Substratinduktion meistens auf einer höheren Ebene, nämlich über die Aktivierung von Genen, die für die Herstellung benötigter Enzyme verantwortlich sind. Einen solchen Mechanismus werden Sie im Genetik-Kurs (Genregulation) kennenlernen.
Am Beispiel des bakteriellen lac-Operons wird hier eine genetische Methode der Enzymregulation beschrieben. Grundkenntnisse der molekularen Genetik wären hier allerdings vorteilhaft.
B. Mechanismus der Enzymhemmung
Die verschiedenen Mechanismen der Enzymhemmung werden oft eingeteilt in irreversible und reversible Mechanismen.
B1. Irreversible Mechanismen
Bei den irreversiblen Mechanismen, also den Mechanismen der Enzymhemmung, die nicht mehr rückgängig gemacht werden können, kann man eigentlich nicht von einer Enzymregulation sprechen. Das Enzym wird hier nicht reguliert, sondern außer Kraft gesetzt, und zwar auf Dauer. Vor allem Schwermetall-Ionen wie Cadmium, Blei, Quecksilber etc. setzen sich in die aktiven Zentren von Enzymen und blockieren diese, so dass keine Substrat-Moleküle mehr hineinpassen. Oft bilden diese Ionen oder Moleküle kovalente Bindungen zum aktiven Zentrum aus, die sehr stabil sind. Andere irreversible Hemmstoffe verändern funktionelle Gruppen innerhalb des aktiven Zentrums, dadurch kann das Enzym auch nicht mehr vernünftig arbeiten.
Beispiel Penicillin:
Penicillin ist eines der ältesten Antibiotika. Es wirkt durch irreversible kovalente Veränderung des bakteriellen Enzyms Transpeptidase. Dieses Enzym ist wichtig für die Bildung der bakteriellen Zellwände. Die durch Penicillin modifizierte Transpeptidase kann keine Zellwände mehr bilden, so können sich die Bakterien nicht mehr vermehren.
Beispiel Aspirin:
Aspirin ist eines der ältesten Schmerzmittel. Es wirkt durch irreversible kovalente Veränderung der menschlichen Enzyme Cyclooxygenase COX1und COX2. Diese Enzyme sind Schlüsselenzyme für die Bildung von Prostaglandinen aus der Arachidonsäure. Prostaglandine sind an Entzündungsreaktionen beteiligt, Aspirin mildert durch die irreversible Enzymhemmung schmerzhafte Entzündungen.
Die genaue Wirkweise von Aspirin ist inzwischen auch erforscht. Aspirin acetyliert einen Serin-Rest des Enzyms an Position 530 (COX1) bzw. 516 (COX2), hängt also eine Essigsäure-Gruppe an die Seitenkette der Aminosäure Serin. Dadurch werden die Enzyme irreversibel außer Kraft gesetzt.
B2. Reversible Mechanismen
Viel interessanter sind die reversiblen Mechanismen der Enzymhemmung. Hier setzt sich ein Inhibitor (Hemmstoff) entweder in das aktive Zentrum des Enzyms oder an eine andere Stelle und beeinflusst von dort die Enzymaktivität negativ.
Es gibt zwei wichtige Mechanismen der reversiblen Hemmung bereits gebildeter Enzyme, nämlich die kompetitive Hemmung und die allosterische Hemmung. Darüber hinaus gibt es den übergeordneten Mechanismus der Genregulation, bei dem bereits die Herstellung der Enzyme gehemmt wird, indem zum Beispiel die entsprechenden Gene blockiert werden.
B2.1 Kompetitive Hemmung
Wenn eine Verbindung X so ähnlich aufgebaut ist wie das eigentliche Substrat S des Enzyms, dann kann eine kompetitive Hemmung stattfinden: Der Stoff X setzt sich in das aktive Zentrum des Enzyms, kann aber nicht weiter abgebaut oder verändert werden. Je höher die Konzentration c(X), desto größer ist die Wahrscheinlichkeit, dass die Enzyme mit X besetzt sind und daher für das eigentliche Substrat S nicht zugänglich sind.
Dieser einfache Mechanismus ist allerdings an eine wichtige Voraussetzung gebunden: Der Hemmstoff X muss dem eigentlichen Substrat sehr ähnlich sehen.
Kompetitive Hemmung: Ein Stoff, der dem Substrat des Enzyms sehr ähnlich sieht, aber vom Enzym nicht weiterverarbeitet werden kann, setzt sich in das aktive Zentrum des Enzyms und blockiert das Enzym dadurch reversibel.
Die kompetitive Hemmung ist reversibel. Wenn die Konzentration des eigentlichen Substrats sehr hoch ist und die Konzentration des Hemmstoffs sehr niedrig, arbeiten die Enzyme fast ungehindert weiter. Ist jedoch die Konzentration des Hemmstoffs X hoch und die des eigentlichen Substrats S niedrig, wird das Enzym zunehmend gehemmt. Erhöht man danach die Substratkonzentration wieder, so steigt die Enzymaktivität an. Substrat und Hemmstoff konkurrieren um das aktive Zentrum, das Ausmaß der Hemmung hängt von dem Verhältnis der Substrat- und Hemmstoffkonzentrationen ab.
Kompetitive Hemmung bei der Endprodukthemmung?
Aufgabe:
Begründen Sie, wieso die Endprodukthemmung einer Stoffwechselkette höchstwahrscheinlich nicht über den Mechanismus der kompetitiven Hemmung realisiert wird.
Lösungsvorschlag:
Bei unserer Stoffwechselkette mit den vier Enzymen dürfte eine kompetitive Hemmung sehr unwahrscheinlich sein. Das Substrat A wird viermal umgebaut. Das Endprodukt dürfte dem Ausgangsstoff überhaupt nicht ähneln, sondern müsste eine ganz andere Struktur haben.
Eine kompetitive Hemmung durch einen substratähnlichen Stoff kommt also als Mechanismus für die Endprodukthemmung nicht ein Frage, weil das Endprodukt E höchstwahrscheinlich eine völlig andere Struktur als das Substrat A hat.
Viele Drogen und Medikamente wirken allerdings genau nach diesem Mechanismus. Verbindungen, die so ähnlich aussehen wie ein "richtiger" Neurotransmitter setzen sich anstelle des Neurotransmitter in die entsprechenden Zentren der Nervenzellen, bewirken dann aber nichts. So hemmen sie die Wirkung der Neurotransmitter.
Ein sehr einprägsames Beispiel ist die kompetitive Hemmung von Methanol durch Ethanol. Methanol (Methylalkohol) ein sehr starkes Gift, es entsteht manchmal bei der illegalen Herstellung von Branntwein. Trinkt man solchen Branntwein, hat man eine schwere Vergiftung, die bis zum Tod führen kann. Im Krankenhaus bekommt man dann normalen Alkohol (Ethanol) injiziert. Die Moleküle des Ethanols konkurrieren dann mit den Methanol-Molekülen um die aktiven Zentren der entsprechenden Enzyme, und so wird die schädliche Wirkung des Methanols durch die nicht ganz so schädliche Wirkung des Ethanols abgemildert.
B2.2 Unkompetitive Hemmung
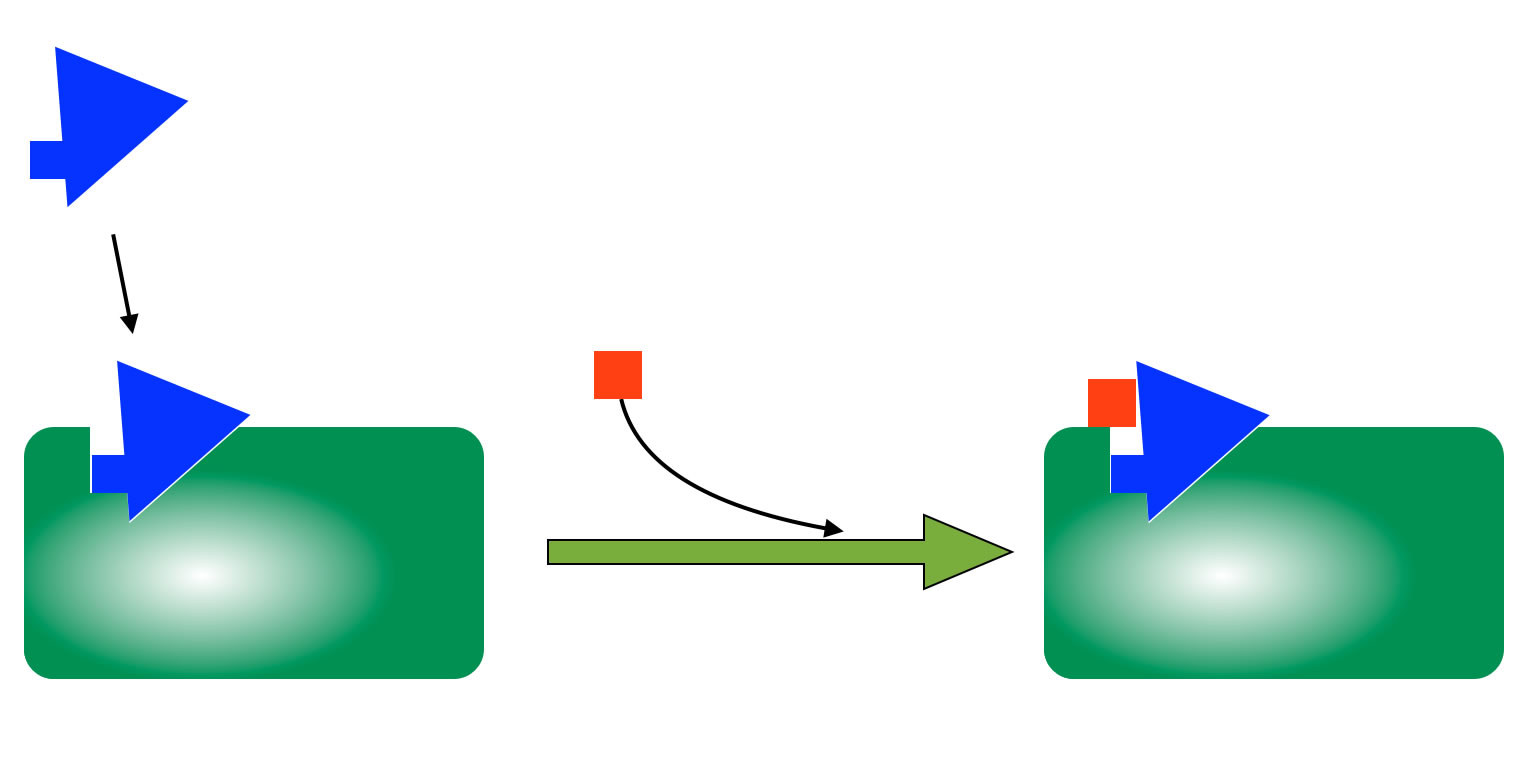
Unkompetitive Hemmung
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Bei der unkompetitiven Hemmung setzt sich ein Inhibitor, der keine Ähnlichkeit mit dem Substrat hat, an das aktive Zentrum oder auch an eine andere Stelle des Enzyms, nachdem das Enzym das Substrat gebunden hat. Es wird also der Enzym-Substrat-Komplex gehemmt. Das Substrat kann nicht zum Produkt umgesetzt werden, und es kann sich auch nicht mehr aus dem aktiven Zentrum herausbewegen.
Im Gegensatz zur kompetitiven Hemmung hilft es bei der unkompetitiven Hemmung gar nichts, wenn man die Substratkonzentration erhöht. Das Enzym-Molekül ist solange außer Kraft gesetzt, wie der Inhibitor das Substrat blockiert. Das wirkt dann so, als hätte man die Konzentration des Enzyms verringert.
B2.3 Allosterische Hemmung
Enzyme sind bekanntlich globuläre Proteine, die aus recht vielen Aminosäuren bestehen. Die Primärstruktur des Enzyms wird von der Sekundärstruktur und der Tertiärstruktur überlagert. Gerade die Tertiärstruktur, also die räumliche Anordnung der Aminosäuren, ist für die Enzymaktivität von entscheidender Bedeutung. Das Substrat setzt sich nach dem Schlüssel-Schloss-Prinzip in das aktive Zentrum des Enzyms, und das Enzym ist meistens substratspezifisch, arbeitet also nur mit einem bestimmten Substrat optimal. Andere Stoffe mit ähnlicher Struktur passen zwar auch in das aktive Zentrum hinein, werden aber nicht mit optimaler Geschwindigkeit verarbeitet (kompetitive Hemmung).
Wenn sich die Struktur des aktiven Zentrums auch nur ein wenig verändert, hat das sofort Auswirkungen auf die Enzymaktivität, wie wir bereits gesehen haben, als wir das Thema "Beeinflussung der Enzymaktivität durch Temperatur und pH-Wert" besprochen haben.
Bei der Endprodukthemmung kann nun das Endprodukt E der Stoffwechselkette die Struktur des aktiven Zentrums des Schlüsselenzyms E1 verändern, so dass die Enzymaktivität von E1 verringert wird.
Dazu setzt sich das Endprodukt in ein spezielles allosterisches Zentrum von E1. Dieses Zentrum befindet sich meistens an einer anderen Stelle des Enzyms als das aktive Zentrum.

Ein Enzym mit einem allosterischen Zentrum
Autor: Ulrich Helmich 2000, Lizenz: Public domain
Wenn sich das Endprodukt nach dem Schlüssel-Schloss-Prinzip in das allosterische Zentrum von E1 setzt, so verändert das Enzym E1 seine Tertiärstruktur. Diese Konformationsänderung wirkt sich auch auf das aktive Zentrum des Moleküls aus; das aktive Zentrum verändert seine Struktur. Das Substrat A passt jetzt nicht mehr so gut in das aktive Zentrum hinein, und das Enzym kann A nicht mehr so gut umsetzen wie zuvor: Die Enzymaktivität sinkt.
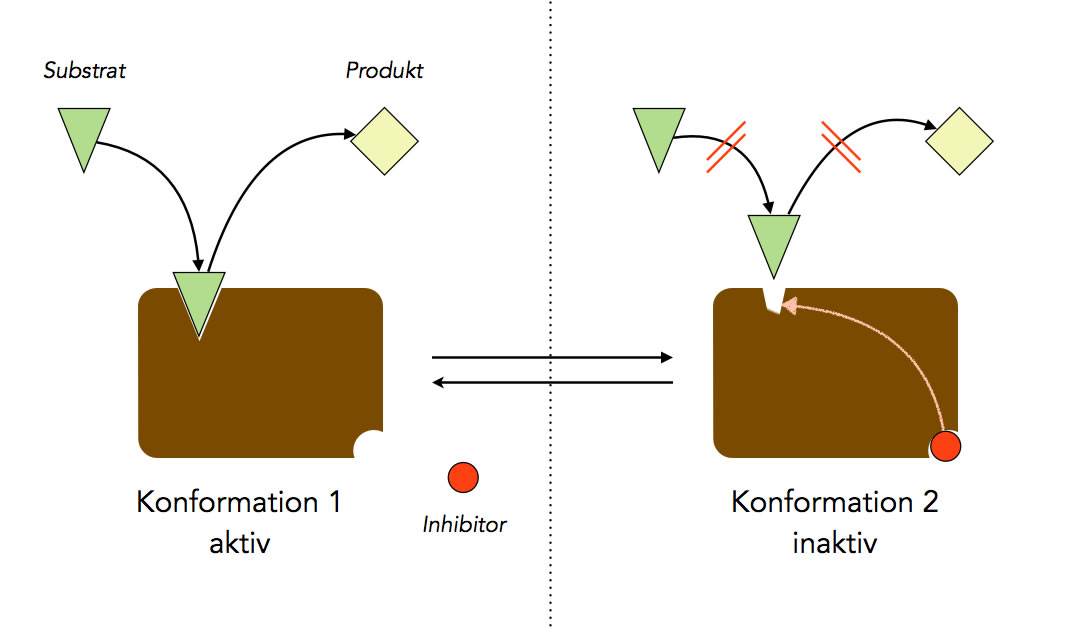
Arbeitsweise eines allosterischen Inhibitors
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Allosterische Hemmung: Ein Inhibitor (Hemmstoff) setzt sich in das allosterische Zentrum eines Enzyms. Dadurch ändert sich die Struktur des aktiven Zentrums, und das Substrat kann nicht mehr umgesetzt werden.
Bei der Endprodukthemmung wirkt das Endprodukt der Stoffwechselkette als allosterischer Inhibitor des ersten Enzyms der Stoffwechselkette.
Je höher die Konzentration des Endproduktes bzw. Inhibitors ist, desto größer ist auch der Anteil der inaktiven Enzymmoleküle, und desto niedriger wird die Enzymaktivität.
Wenn aus irgendwelchen Gründen die Endproduktkonzentration wieder zu sinken beginnt (z.B. weil das Endprodukt von einer anderen Stoffwechselkette aufgebraucht wird), so erhöht sich wieder der Anteil der aktiven, nicht gehemmten Enzym-Moleküle, und es wird wieder Endprodukt hergestellt. Solange, bis die Endproduktkonzentration wieder zu hoch ist, dann setzt nämlich die Endprodukthemmung wieder ein.
Auf dieser Seite erfahren Sie mehr über das Phänomen der Allosterie bzw. allosterischen Hemmung und Aktivierung.
C. Mechanismen der Enzymaktivierung
Die Hemmung eines Enzyms ist grundsätzlich einfacher als die Aktivierung. Ein kompetitiver Mechanismus wie bei der Hemmung ist schon mal ausgeschlossen, es kommt also nur eine allosterische Aktivierung in Frage.
C1. Allosterische Enzymaktivierung
Im "Ruhezustand" ist das aktive Zentrum des Enzyms "geschlossen", das Substrat passt nicht in das aktive Zentrum hinein.
Wenn sich dann ein Aktivator-Molekül in das allosterische Zentrum setzt, ändert sich die Konformation des Enzyms, und das aktive Zentrum nimmt eine Form an, in der das Substrat umgesetzt werden kann. Das Enzym befindet sich jetzt im "Aktivzustand".
C2. Enzymaktivierung durch Phosphatgruppen
Ein sehr weit verbreiteter anderer Mechanismus zur Aktivierung von Enzymen ist die Übertragung einer Phosphatgruppe durch ATP auf das Enzym.
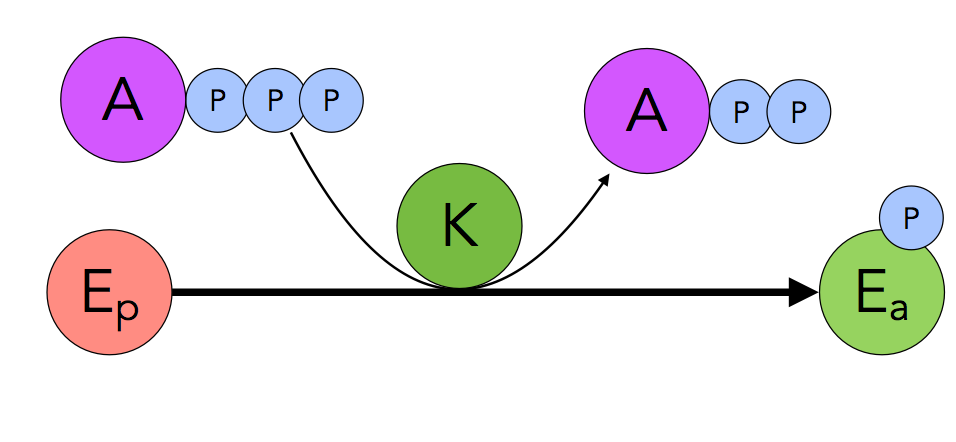
Phosphorylierung eines Enzyms
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Eine solche Phosphorylierung wird durch eine spezielle Klasse von Enzymen durchgeführt, den Kinasen. Die Kinase überträgt eine Phosphatgruppe von einem ATP-Molekül auf das Enzym. Das Enzym wird aktiviert, und ADP bleibt übrig.
Oft gibt es in der Zelle sogar sogenannte Enzymkaskaden oder Aktivierungskaskaden. Das heißt, auch die Kinase liegt zunächst in einer inaktiven Form vor und wird erst durch andere Enzyme oder niedermolekulare Stoffe wie cAMP, Calcium-Ionen etc. aktiviert. Es gibt beispielsweise Kaskaden der folgenden Art:
- Calcium-Ionen Ca2+ aktivieren Kinase 1
- Kinase 1 aktiviert Kinase 2
- Kinase 2 aktiviert Enzym X
- Enzym X diffundiert in den Zellkern und stellt Verbindung Y her
- Verbindung Y aktiviert ein bestimmtes Gen.
Auf solche komplexen Reaktionskaskaden werden wir im Rahmen der Neurobiologie und der Genetik noch zu sprechen kommen.