Siedetemperaturen
Im Vergleich zu anderen organischen Verbindungen haben Alkane sehr niedrige Siedetemperaturen. Dies ist auf die extrem geringe Polarität der C-H-Bindungen zurückzuführen. Alkan-Moleküle werden untereinander nur durch London-Kräfte zusammengehalten, die schwächste Form der van-der-Waals-Kräfte.
Für LK-Schüler(innen):
➥van-der-Waals-KräfteHier wird Ihnen auf Oberstufen-Niveau genau erklärt, wie die van-der-Waals-Kräfte zwischen zwei Molekülen entstehen.
Für Studienanfänger(innen) der Fächer Chemie, Biologie, Medizin etc.:
➥van-der-Waals-KräfteDiese Seite geht über die oben genannte Vertiefungsseite hinaus. Hier erfahren Sie alles über die drei (!) verschiedenen Typen der van der Waals-Wechselwirkung: London-, Debye- und Keesom-Wechselwirkungen.
In fast jedem Chemiebuch findet man eine Auflistung oder graphische Darstellung der Siedepunkte der n-Alkane, so wie zum Beispiel diese:
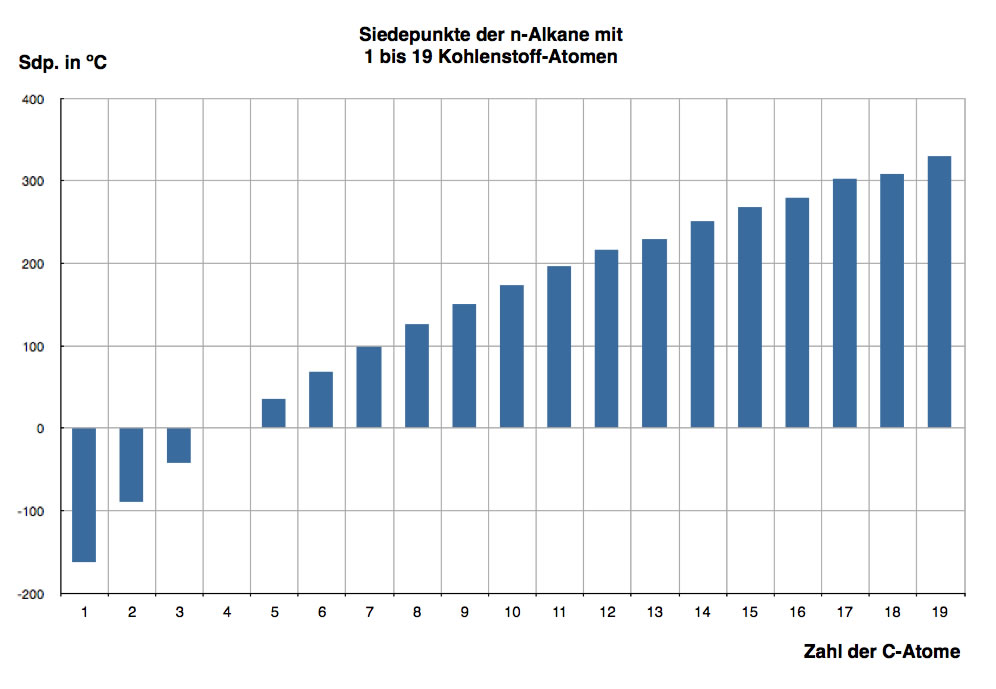
Siedepunkte der n-Alkane mit 1 bis 19 Kohlenstoff-Atomen
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Interessant an dieser Graphik ist das kontinuierliche Ansteigen der Siedetemperatur innerhalb der homologen Reihe der Alkane. Das n-Butan hat einen Siedepunkt von -0,5 ºC, deshalb ist der entsprechende Balken in der Abbildung nicht zu sehen. Ab Pentan sind die Alkane bei Zimmertemperatur flüssig (Siedetemperatur von Pentan = 36,1 ºC).
Siedepunkte isomerer Alkane
Auf der vorherigen Seite hatten wir bereits über die Siedepunkte der beiden Butan-Isomere und der drei Pentan-Isomere gesprochen, auch drei der Hexan-Isomere haben wir betrachtet. Wir sind dann zu dem Ergebnis gekommen, dass der Siedepunkt eines Alkans nicht nur von der Anzahl der C-Atome und damit von der molaren Masse abhängt, sondern auch von der Form des Moleküls. Je langgestreckter das Molekül ist, desto größer sind die Kontaktflächen zwischen den Molekülen, desto stärker die van-der-Waals-Kräfte, und um so höher der Siedepunkt.
Schmelztemperaturen
Die Schmelztemperaturen der Alkane verändern sich nicht so regelmäßig wie die Siedetemperaturen, wie die folgende Graphik zeigt:
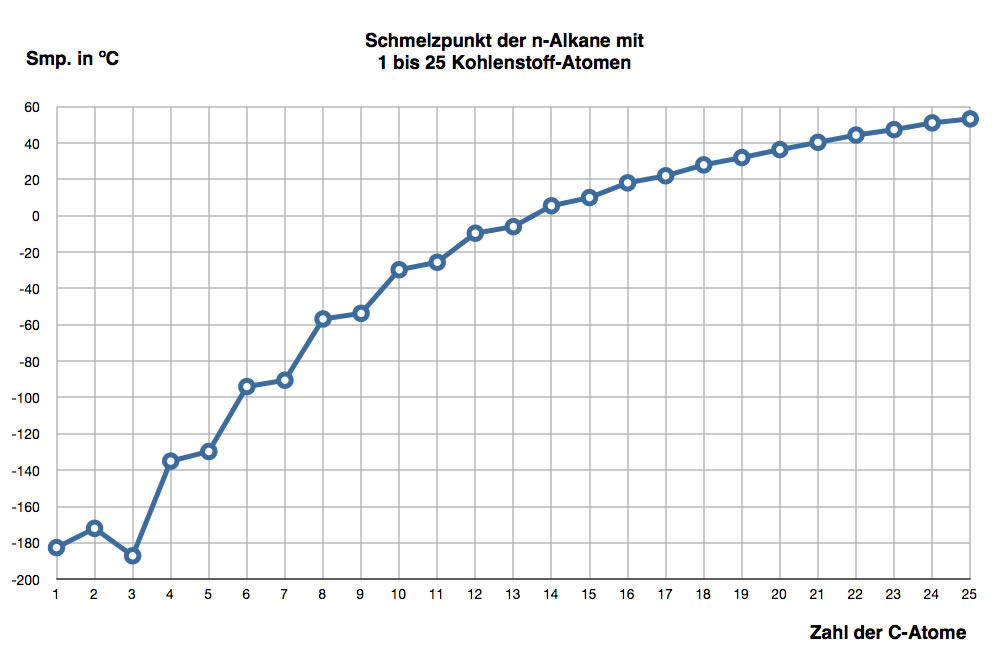
Schmelzpunkte der n-Alkane mit 1 bis 19 Kohlenstoff-Atomen
Autor: Ulrich Helmich, Lizenz: siehe Seitenende
Zwar nehmen die Schmelzpunkte mit der Kettenlänge zu, aber nicht regelmäßig. Propan hat sogar einen niedrigeren Schmelzpunkt als Ethan, was schon mal bemerkenswert ist. Weiterhin ist auffällig, dass die Differenz zwischen den Schmelzpunkten besonders groß ist, wenn ein Alkan mit einer geradzahligen Anzahl von C-Atomen auf ein ungeradzahliges Alkan folgt.
Der Schmelzpunkt der Alkane hängt nämlich von drei Faktoren ab:
- Je größer die molare Masse, desto höher der Schmelzpunkt.
- Je größer die Kontaktfläche zwischen den Molekülen, desto höher der Schmelzpunkt.
- Je kugelförmiger die Moleküle, desto höher der Schmelzpunkt.
Die Punkte 2 und 3 scheinen sich auf den ersten Blick zu widersprechen. Tatsächlich aber ist es so, dass sich kugelförmige Moleküle wie Dimethylpropan im Kristall enger zusammenpacken lassen als langgestreckte Moleküle wie n-Pentan.
Eine solche Behauptung wollen wir natürlich überprüfen. Wie sehen denn die Schmelzpunkte von n-Pentan und Dimethylpropan aus?
- n-Pentan: -129,8 ºC
- Dimethylpropan: -16,4 ºC
Das eher kugelförmige Dimethylpropan hat einen viel höheren Schmelzpunkt als das langgestreckte n-Pentan. Dies scheint die Vermutung zu bestätigen, dass sich kugelförmige Moleküle dichter zusammenpacken lassen als langgestreckte Moleküle.
Nun haben wir die Schmelztemperaturen von zwei Pentan-Isomeren untersucht. Damit ist aber noch nicht erklärt, wieso Propan einen niedrigeren Schmelzpunkt hat als Ethan. Es scheinen also noch weitere Faktoren eine Rolle zu spielen, auf die wir hier aber nicht mehr eingehen wollen.
Je länger die C-Ketten der Alkane werden, desto unerheblicher werden die Unterschiede in den Schmelztemperaturen allerdings.
Viskosität
Unter der Viskosität versteht man so etwas wie "Zähflüssigkeit". Honig hat zum Beispiel eine sehr hohe Viskosität, die Viskosität von Wasser empfindet man als "normal", und Stoffe wie Benzin, Ether etc. haben eine geringe Viskosität.
Man kann die Viskosität eines Stoffes quantitativ ermitteln, indem man beispielsweise 50 ml der Flüssigkeit in eine Bürette gibt, die Bürette unten mit einem engen Glasrohr verschließt und dann die Zeit misst, die erforderlich ist, bis der Inhalt der Bürette ausgelaufen ist. Bei dünnflüssigem Honig würde das vielleicht 50 Sekunden dauern, bei Wasser vielleicht 10 Sekunden, und bei Pentan dann vielleicht 6 oder 7 Sekunden.
Alkane haben allgemein eine geringe Viskosität, zumindest wenn man die Zahl der C-Atome berücksichtigt. Klar, ein Alkan mit 30 C-Atomen hat natürlich eine recht hohe Viskosität, aber andere organische Verbindungen mit der gleichen Anzahl von C-Atomen haben eine noch viel höhere Viskosität. Die geringe Viskosität der Alkane hängt natürlich ebenfalls mit den geringen Anziehungskräften zwischen den Alkan-Molekülen zusammen.
Zu diesem Thema gibt es ein tolles YouTube-Video, dass Sie sich auf jeden Fall ansehen sollten!
Dichte
Das spezifische Gewicht der flüssigen Alkane wie Pentan, Hexan und Heptan liegt unter dem Wert 1,0 g/cm3, wie er ja für Wasser gültig ist. Die Abstände zwischen den Alkan-Molekülen sind größer, so dass nicht so viele Alkan-Moleküle in ein bestimmtes Volumen hineinpassen. Die Ursache hierfür - Sie haben es sich bestimmt schon gedacht - sind wieder die geringen Anziehungskräfte zwischen den Alkan-Molekülen.
Wasserlöslichkeit
Was passiert, wenn sich ein Stoff wie Kochsalz, Alkohol oder Zucker in Wasser löst? Im Falle von Kochsalz gruppieren sich die Wasser-Dipole um die positiven und negativen Ionen des Salzes, es bilden sich Hydrathüllen, die die Ionen umgeben. Im Falle von Zucker oder Alkohol bilden die Wasser-Moleküle sogar Wasserstoffbrücken-Bindungen (H-Brücken) mit den OH-Gruppen der Alkohol- oder Zucker-Moleküle aus. Beide Phänomene, Hydrathüllen und H-Brücken, erklären die gute Wasserlöslichkeit vieler anorganischer und organischer Verbindungen.
Der Grund für die Wasserunlöslichkeit der Alkane ist der sogenannte hydrophobe Effekt. Dank der H-Brücken, die die H2O-Moleküle untereinander bilden, bestehen zwischen den H2O-Molekülen starke intermolekulare Anziehungskräfte. Alkan-Moleküle können jedoch keine H-Brücken ausbilden und bleiben daher - gezwungenermaßen - unter sich.
Auf dieser Lexikonseite wird Ihnen genauer erklärt, was es mit dem hydrophoben Effekt auf sich hat.
Beziehungen zwischen Struktur und Eigenschaften
Das Struktur-Eigenschafts-Konzept ist eines der fünf Basiskonzepte der Chemie. Auch an den physikalischen Eigenschaften der Alkane lässt sich dieses wichtige Konzept aufzeigen. Dazu betrachten wir einmal das folgende Schema:
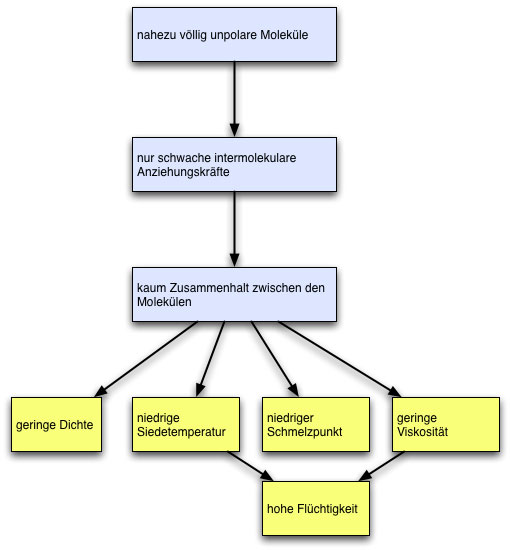
Beziehungen zwischen Struktur und Eigenschaften bei den Alkanen
Autor: Ulrich Helmich. Lizenz: siehe Seitenende
Alkane sind nahezu völlig unpolare Moleküle, daraus resultieren nur sehr schwache intermolekulare Anziehungskräfte, so dass kaum ein Zusammenhalt zwischen den Molekülen besteht. Daraus folgen dann die bekannten Eigenschaften der Alkane, die bereits weiter oben auf dieser Seite erörtert worden sind: geringe Dichte, niedrige Siedetemperatur, niedrige Schmelztemperatur, geringe Viskosität und - noch nicht erwähnt - eine hohe Flüchtigkeit; flüssige Alkane wie Pentan oder Hexan verdampfen sehr schnell.
Seitenanfang -
Methan -
Ethan -
höhere Alkane -
Nomenklatur -
Isomerie -
physik. Eigensch. -
Gewinnung -
Reaktionen -
Abitur NRW