Enzyme sind substratspezifisch
Enzyme sind globuläre Proteine mit einer ganz bestimmten Tertiärstruktur: Sie haben ein oder zwei taschenförmige Ausbuchtungen, in die Substrate, Cosubstrate oder Coenzyme hineinpassen, die aktiven Zentren.
Aktives Zentrum
Ein aktives Zentrum ist ein Reaktionszentrum des Enzyms. Hier passt das Substrat wie ein Schlüssel in das Schloss hinein, hochspezifisch und komplementär. Oder das Substrat passt ungefähr hinein, und das aktive Zentrum passt sich an das Substrat an (Induced-Fit-Modell).
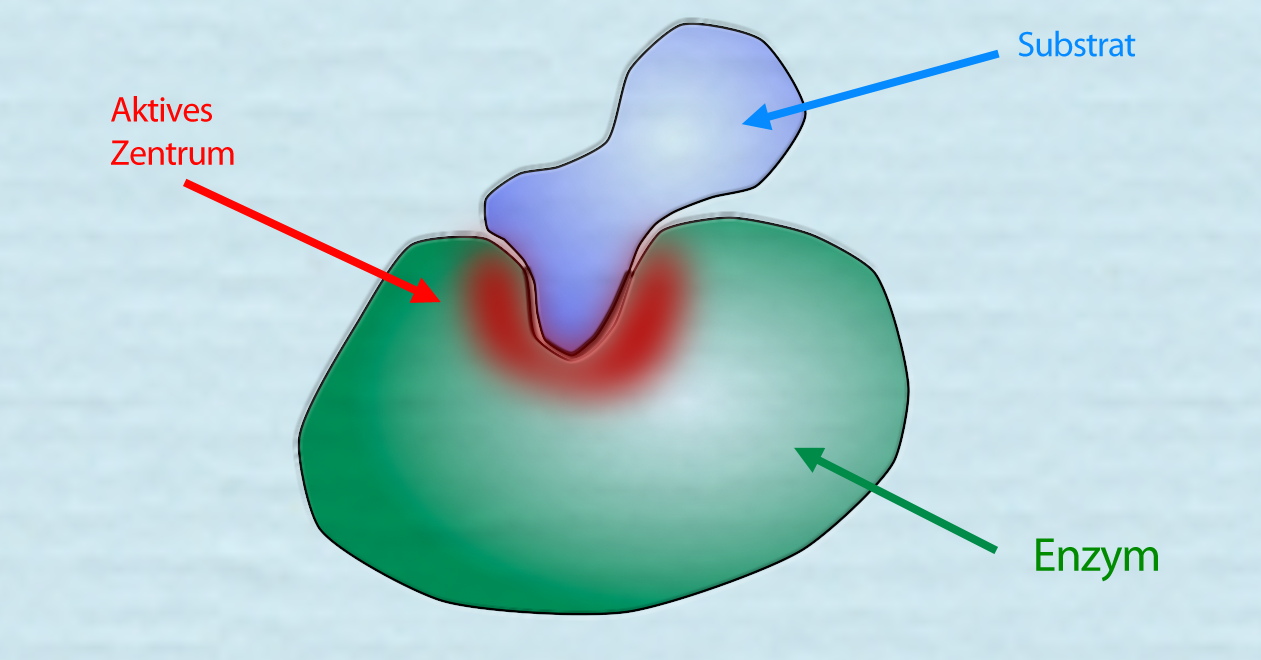
Ein Enzym-Substrat-Komplex
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
Hier sehen wir ein Enzym, das ein passendes Substrat gebunden hat. Das aktive Zentrum ist rot hervorgehoben.
Den Komplex aus Substrat(en) und Enzym nennt man Enzym-Substrat-Komplex.
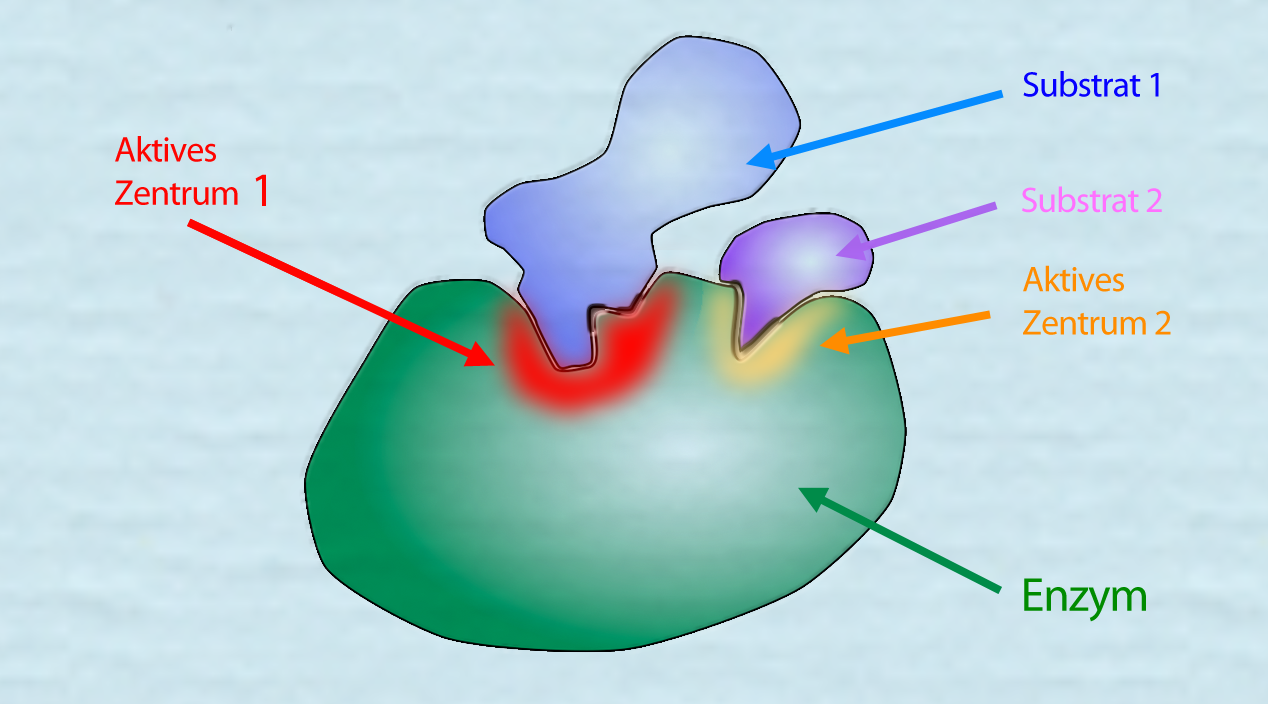
Ein Enzym, das zwei Substrate binden kann
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
In diesem Bild sehen wir ein Enzym, das zwei Substrate gleichzeitig binden kann. Beispielsweise könnte es sich um ein Enzym sein, das aus den Monosacchariden Glucose und Fructose das Disaccharid Saccharose herstellt.
Dieses Enzym wird übrigens als Saccharose-Phosphat-Synthase bezeichnet. Die Synthese von Saccharose ist allerdings etwas komplizierter als hier im Text beschrieben.
Im Fall der Saccharose-Synthese ist das Substrat 2 ein "richtiges" Substrat, das weitgehend komplett mit dem ersten Substrat verbunden wird. Oft spendet das zweite Substrat aber auch nur einen kleinen Teil seines Moleküls, zum Beispiel eine Phosphatgruppe, zwei H-Atome oder einen Essigsäure-Rest. Solche Substrate bezeichnet man dann als Cosubstrate, oft auch als Coenzyme.
Die bekanntesten Cosubstrate/Coenzyme sind sicherlich ATP, das Phosphatgruppen überträgt, NADPH/H+, NADH/H+ und FADH2, die zwei H-Atome übertragen, und Acetyl-Coenzym A, das einen Essigsäuregärung auf das eigentliche Substrat überträgt.
Damit es zur Reaktion zwischen den beiden Substrat-Molekülen bzw. dem Substrat- und dem Cosubstrat-Molekül kommt, muss sich das aktive Zentrum irgendwie verändern; es muss schließlich die beiden Moleküle miteinander reagieren lassen. Meistens wird die Reaktion durch eine Konformationsänderung des aktiven Zentrums eingeleitet. Bestimmte Aminosäuren des Enzyms verbinden sich mit Atomgruppen des Substrats, andere Aminosäuren bilden H-Brücken mit OH-Gruppen oder NH2-Gruppen des Substrats aus und so weiter.
Wenn die Reaktion beendet ist, hat sich der Enzym-Substrat-Komplex in den Enzym-Produkt-Komplex umgewandelt.
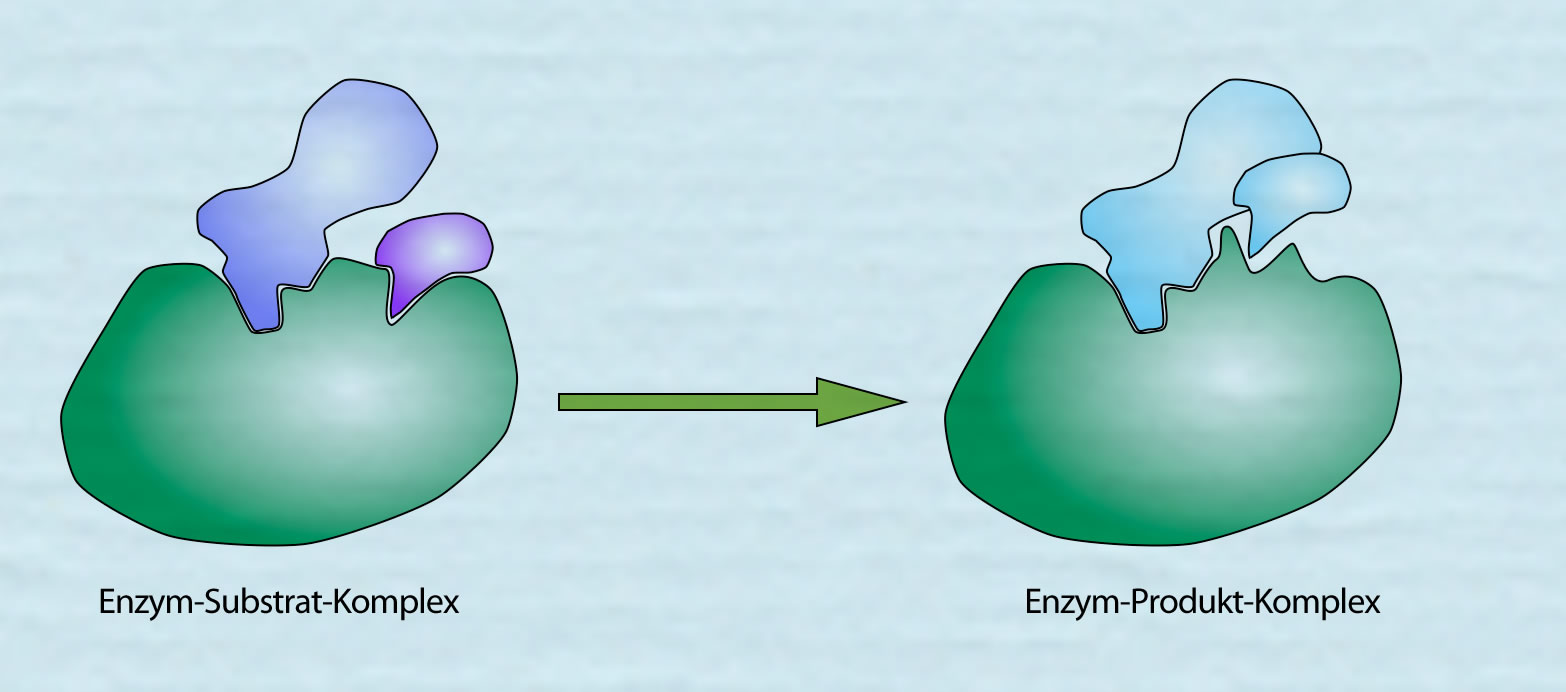
Aus dem Enzym-Substrat-Komplex wird der Enzym-Produkt-Komplex
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das Produkt der Reaktion hat keine hohe Affinität mehr zu dem Enzym, weil die schwachen chemischen Bindungen (H-Brücken, Dipol-Dipol-Bindungen), mit denen die Substrate in dem aktiven Zentrum festgehalten wurden, durch die Konformationsänderung des aktiven Zentrums nicht mehr vorhanden oder zumindest stark geschwächt sind. Daher kann das Produkt das Enzym ohne weiteres verlassen. So ist das Enzym für eine neue "Runde" bereit.
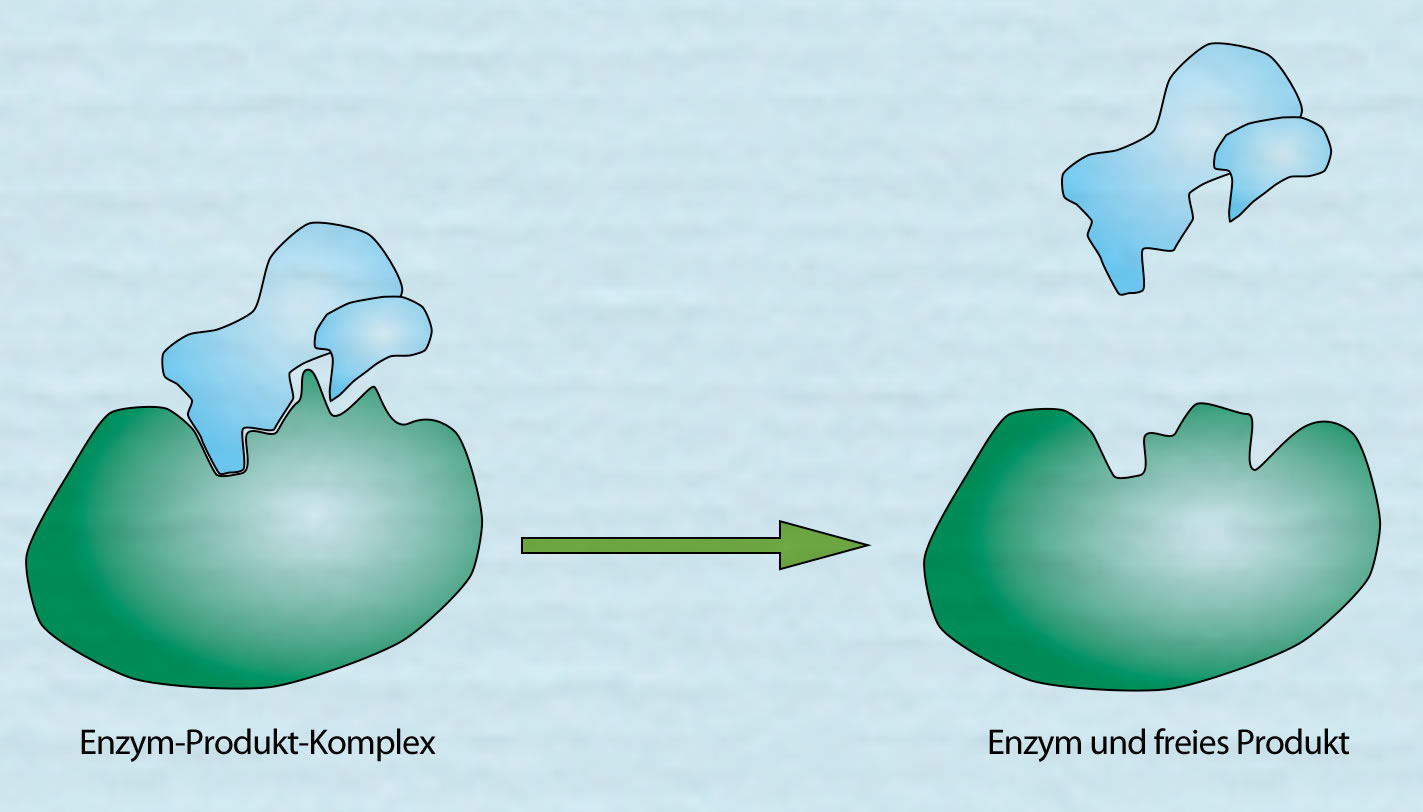
Das Produkt wird freigesetzt
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Hier sieht man, wie das Produkt freigesetzt wird. Anschließend liegt das Enzym wieder im ursprünglichen und erneut arbeitsfähigem Zustand vor. Es kann jetzt ein neues Substrat bzw. in diesem Fall zwei neue Substrate A und B binden.
Innerhalb einer Sekunde kann ein Enzym viele Hundert solcher Reaktionsschritte katalysieren. Diese Häufigkeit oder Frequenz wird übrigens als Wechselzahl bezeichnet.
Das Ganze jetzt noch einmal im Zusammenhang:
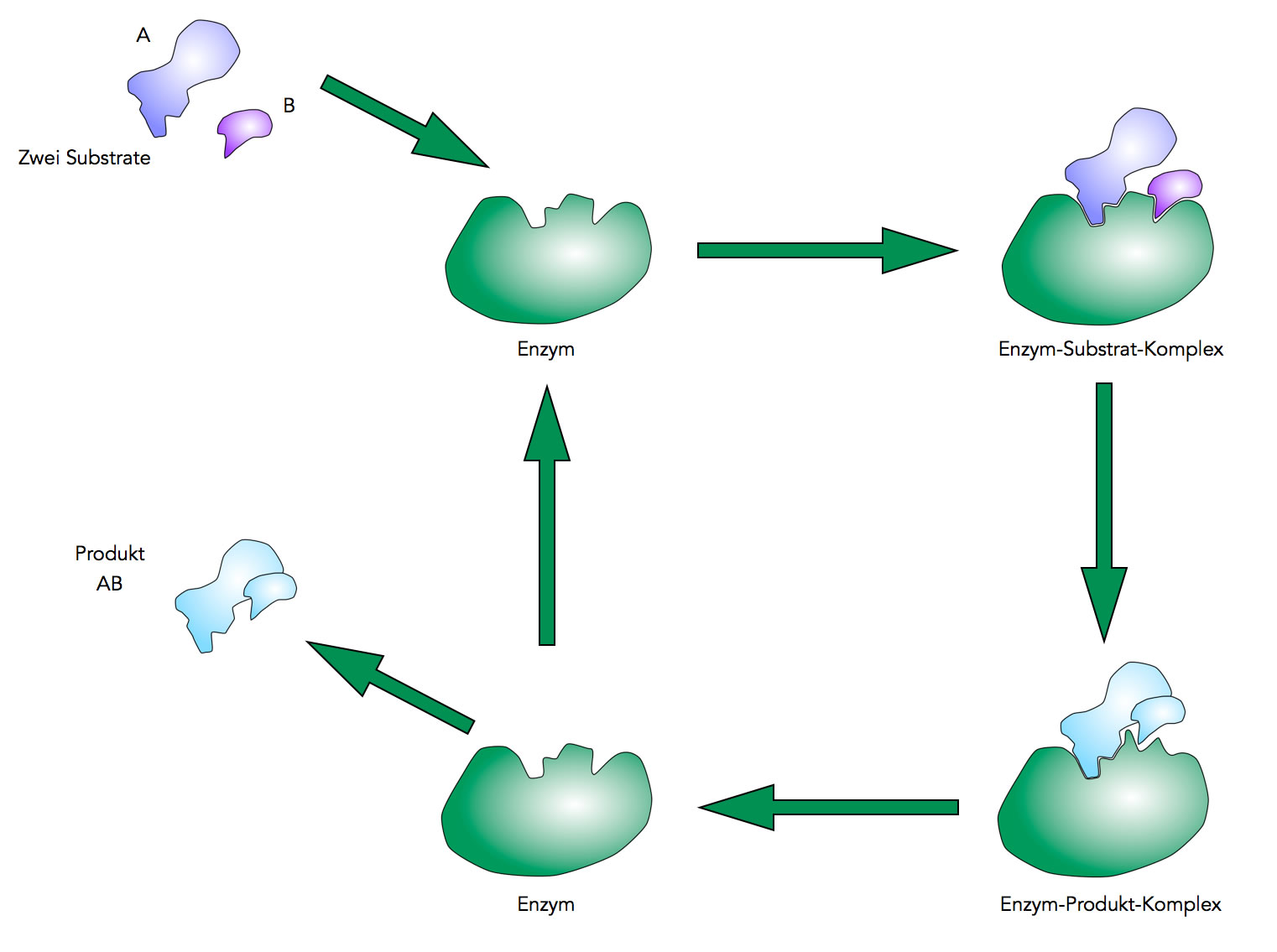
Die enzymatisch katalysierte Reaktion A + B ⇒ AB
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Substratspezifität und Gruppenspezifität
Die meisten Enzyme sind allerdings nicht 100%ig substratspezifisch. Sehr ähnlich aussehende chemische Verbindungen passen ebenfalls in das aktive Zentrum hinein. Allerdings ist die Enzymaktivität, also die Geschwindigkeit, mit der das Enzym arbeitet, dann nicht so hoch.
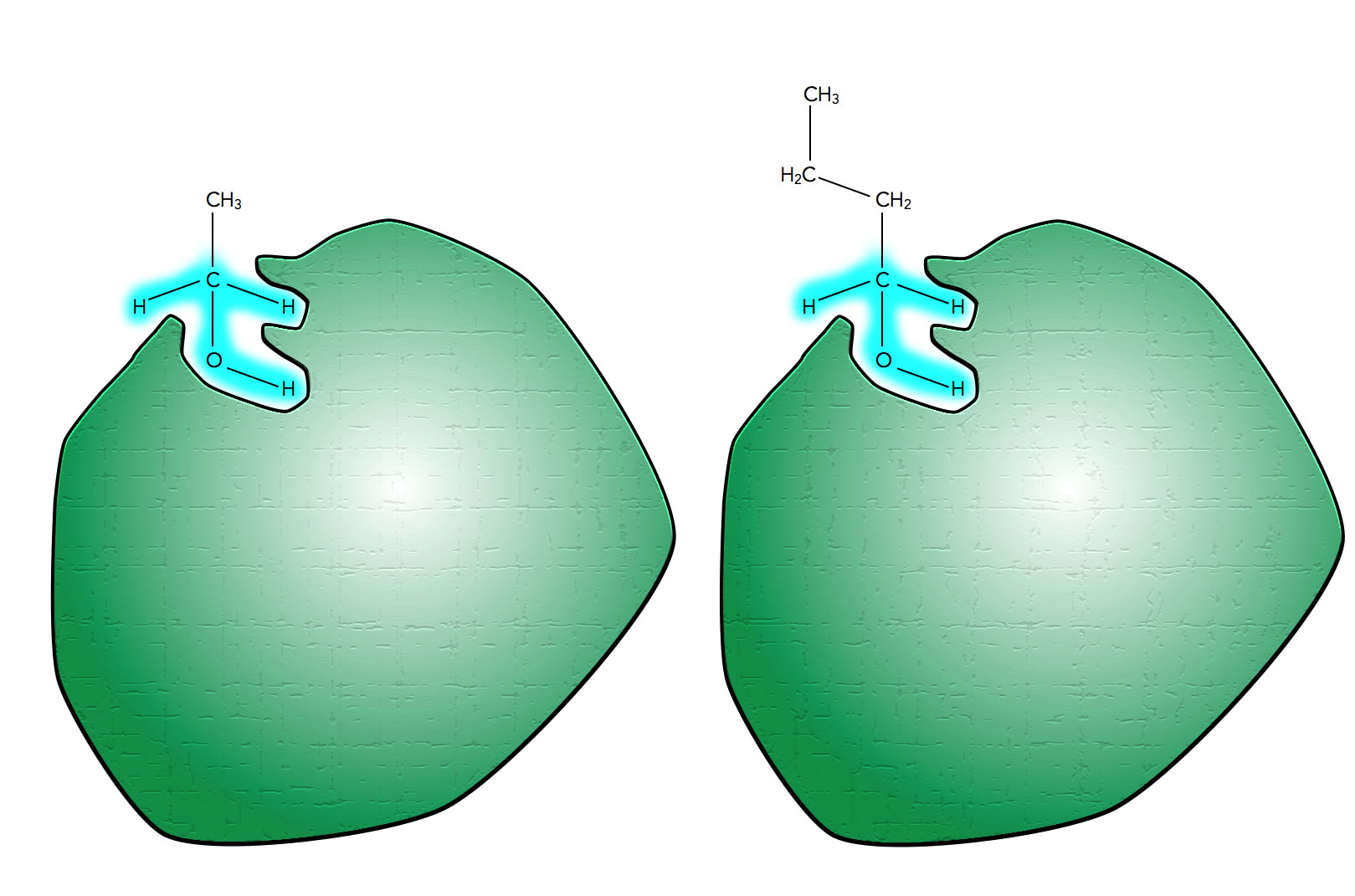
Das Ethanol-verarbeitende Enzym kann auch Butanol verarbeiten
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Hier sehen wir ein Enzym, das den Alkohol Ethanol als Substrat hat. Man kann sich nun aber leicht vorstellen, dass auch andere Alkohole mit einer ähnlichen Struktur wie Ethanol von dem Enzym verarbeitet werden. In der Abbildung ist beispielsweise ein Butanol-Molekül zu sehen, das ebenfalls gut in das aktive Zentrum des Enzyms passt, weil die entscheidenden Molekülbereiche (blau markiert) ja vollkommen mit denen des Ethanols übereinstimmen.
In der Tat sind viele Enzyme gruppenspezifisch, es gibt aber auch einige wenige Enzyme, die streng substratspezifisch sind, also tatsächlich nur ein spezielles Substrat verarbeiten können.
Enzyme sind wirkungsspezifisch
Ein Alkohol wie Ethanol kann auf mehrere Weisen chemisch verändert werden. Dazu sind dann aber verschiedene Enzyme notwendig. Ein Enzym X ist beispielsweise für die Oxidation von Ethanol um eine Stufe zuständig, also für die Bildung von Ethanal aus Ethanol. Ein anderes Enzym Y kann Ethanol vielleicht direkt zu Essigsäure oxidieren, und wieder ein anderes Enzym Z reduziert Ethanol zu Ethan.
Jedes Enzym katalysiert genau eine einzige dieser Reaktionen. Daher sagt man, dass solche Enzyme wirkungsspezifisch sind. Jedes Enzym kann nur eine bestimmte chemische Reaktion katalysieren.
Enzyme katalysieren die Hin- und die Rückreaktion
Ein Enzym wie die Hexokinase, das eine Phosphat-Gruppe an ein Glucose-Molekül hängt, kann auch die Rückreaktion beschleunigen, also das Abspalten der Phosphat-Gruppe vom Glucose-Phosphat.
In den Zellen existieren die Enzyme aber nicht allein, sondern es gibt viele Tausend verschiedene Enzyme in einer Zelle. Das Glucose-Phosphat kann von einem anderen Enzym in eine neue Verbindung umgesetzt werden, zum Beispiel in Fructose-Phosphat. Dadurch wird aber die Konzentration an Glucose-Phosphat verringert, und die Wahrscheinlichkeit, das Glucose-Phosphat zu Glucose zurück reagiert, ist dann sehr gering.
Ein paar Aufgaben
Ich habe mal aus Spaß ein paar ältere Schulbücher zum Thema Enzymatik durchgeblättert und dabei auf ein paar schöne Aufgaben-Ideen gestoßen, die ich Ihnen hier nicht vorenthalten möchte. Die ersten beiden Aufgaben sind - finde ich - sehr einfach.
Aufgabe 1

Zu Aufgabe 1
Autor: Ulrich Helmich 11/2024, Lizenz: Public domain
Erläutern Sie das in dieser Abbildung dargestellte Phänomen!
Aufgabe 2

Zu Aufgabe 2
Autor: Ulrich Helmich 11/2024, Lizenz: Public domain
Erläutern Sie das in dieser Abbildung dargestellte Phänomen!
Das waren doch ganz einfache Aufgaben. Traut man den heutigen Schüler(innen) wirklich nicht mehr zu?
Zur Auflösung der beiden Aufgaben
Das erste Bild soll die Substratspezifität veranschaulichen. Nur ein von den drei gezeichneten Verbindungen ist das Substrat des Enzyms und passt in das aktive Zentrum (Schlüssel-Schloss-Prinzip).
Das zweite Bild veranschaulicht die Wirkungsspezifität. Das Substrat kann zwar mehrere verschiedene Reaktionen eingehen, aber das Enzym katalysiert nur eine dieser Reaktionen, die anderen aber nicht.
Einfache Aufgaben aus dem aktuellen Natura Oberstufe - Band des Klett-Verlags:
Aufgaben
- Nennen Sie generelle Eigenschaften eines Enzyms.
- Erklären Sie, weshalb für die Umsetzung eines Substrats eine geringere Aktivierungsenergie benötigt wird, wenn ein passendes Enzym vorhanden ist.
- Stellen Sie dar, warum geringe Enzymmengen für die Biokatalyse ausreichen.
- Begründen Sie, warum der Austausch einer Aminosäure im aktiven Zentrum des Enzymmoleküls Auswirkungen auf dessen Funktion haben kann.
Lösungsvorschläge
- Gemeint sind hier sicherlich
a) die Fähigkeit zur Katalyse biochemischer Reaktionen,
b) der Aufbau aus Aminosäuren,
c) die Substratspezifität und
d) die Wirkungsspezifität. - Das wurde bereits im Text erklärt: Enzyme senken die Aktivierungsenergie einer chemischen Reaktion, und da die Reaktionsgeschwindigkeit von der Aktivierungsenergie abhängt, wird auch die Geschwindigkeit der Umsetzung gesteigert.
- Das liegt daran, dass ein Enzym, sobald es seine Aufgabe erledigt hat, für einen neuen Katalyse-Zyklus bereitsteht. So kann ein einziges Enzym-Molekül viele Tausend Reaktionszyklen hintereinander durchführen.
- Enzyme arbeiten oft nach dem Schlüssel-Schloss-Prinzip. Der Austausch einer einzigen Aminosäure kann die dreidimensionale Struktur des aktiven Zentrums verändern, so dass das Substrat nicht mehr perfekt in dieses Zentrum hineinpasst. Dadurch sinkt die Enzymaktivität, das Enzym kann also nicht mehr so viele Substrat-Moleküle pro Sekunde umsetzen wie bisher.
Und noch ein paar leichte Aufgaben aus diesem Buch
Aufgabe
- Erklären Sie, warum das Lactase-Molekül nur die Spaltung von Lactosemolekülen katalysiert.
- Erklären Sie, warum es im Körper mehrere Tausend verschiedene Enzyme gibt.
Lösungsvorschläge
- Enzyme sind substratspezifisch, jedes Enzym kann nur ein bestimmtes Substrat umsetzen. Das Enzym Lactase kann nur das Disaccharid Lactose (Milchzucker) umsetzen, es spaltet Lactose in Galactose und Glucose.
- Der Grund hierfür ist wieder die Tatsache, dass jedes einzelne Enzym nicht nur substratspezifisch ist, sondern auch wirkungsspezifisch. Es gibt Tausende verschiedene Stoffwechsel-Reaktionen in der Zelle, entsprechend werden auch Tausende verschiedener Enzyme benötigt, für jede Reaktion mindestens eines.
Eine sehr schöne Aufgabe zum Thema Enzymklassen habe ich in dem Bioskop SII aus dem Westermann-Verlag von 2019 gefunden. Ich habe die Abbildung und die Aufgabenstellung selbst erstellt, aber wurde von der Aufgabe in dem Buch dazu angeregt:
Aufgabe
Das folgende Bild zeigt die Funktionsweise verschiedener Enzyme aus sieben Enzymklassen:

Arbeitsweise der sieben Enzymklassen
Autor: Ulrich Helmich 11/2024, Lizenz: Public domain
Gehen Sie auf die Vertiefungsseite zum Thema, und lesen Sie den Abschnitt über die sieben Enzymklassen. Ordnen Sie dann den Reaktionen A bis G je eine dieser sieben Enzymklassen zu.
Lösungsvorschlag
A) Lyase. Eine Verbindung wird gespalten, ohne das dazu Wasser eingebaut werden muss.
B) Oxidoreduktase. Von der blau gezeichneten Verbindung werden Elektronen (und/oder) Wasserstoff auf die rot gezeichnete Verbindung übertragen. Die kugelförmig dargestellte Verbindung wird dadurch oxidiert, die eckig gezeichnete Verbindung dagegen reduziert.
C) Hydrolase. Eine Verbindung wird durch den Einbau von Wasser in zwei Bausteine gespalten.
D) Isomerase. Eine Verbindung wird durch das Enzym in ein Isomer umgewandelt, also eine Verbindung mit der gleichen Summenformel, aber einer anderen Strukturformel.
E) Translocase. Das Enzym transportiert eine Verbindung (oder ein Ion) quer über eine Membran, zum Beispiel aus der Zelle nach außen oder aus dem Cytoplasma in ein Mitochondrium hinein.
F) Ligase. Das Enzym verknüpft zwei Moleküle zu einem neuen Molekül. Dazu wird Energie in Form von ATP benötigt.
G) Transferase. Es wird ein Atom oder eine Atomgruppe von einer Verbindung X auf eine Verbindung Y übertragen.
Vertiefung dieses Themas
Für den Biologie-Unterricht in der Sekundarstufe II sollte das hier Gesagte eigentlich völlig ausreichend sein. Wenn Sie aber noch tiefer in dieses Thema einsteigen wollen, vielleicht weil Sie schon Biologie oder Chemie studieren, dann sollten Sie auf die Vertiefungsseite zum Thema gehen, die ich gerade geschrieben habe.
Diese Vertiefungsseite behandelt das Thema Substratspezifität am Beispiel der Hexokinase, geht auf den Begriff Gruppenspezifität ein, behandelt die Stereospezifität von Enzymen und gibt einen Überblick über die verschiedenen Enzymklassen und ihre Reaktionen.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
Seitenanfang -
Weiter mit Enzymkinetik...