Enzyme sind globuläre Proteine mit einer ganz bestimmten Struktur: Sie haben ein sogenanntes aktives Zentrum und meistens auch noch - an einer anderen Stelle des Proteins - ein allosterisches Zentrum.
Das aktive Zentrum ist das Reaktionszentrum oder auch Substraterkennungsbereich des Enzyms [1]. Hier passt das Substrat wie ein Schlüssel in das Schloss hinein, hochspezifisch und komplementär - man spricht daher auch von dem Schlüssel-Schloss-Prinzip, das hier zur Anwendung kommt.
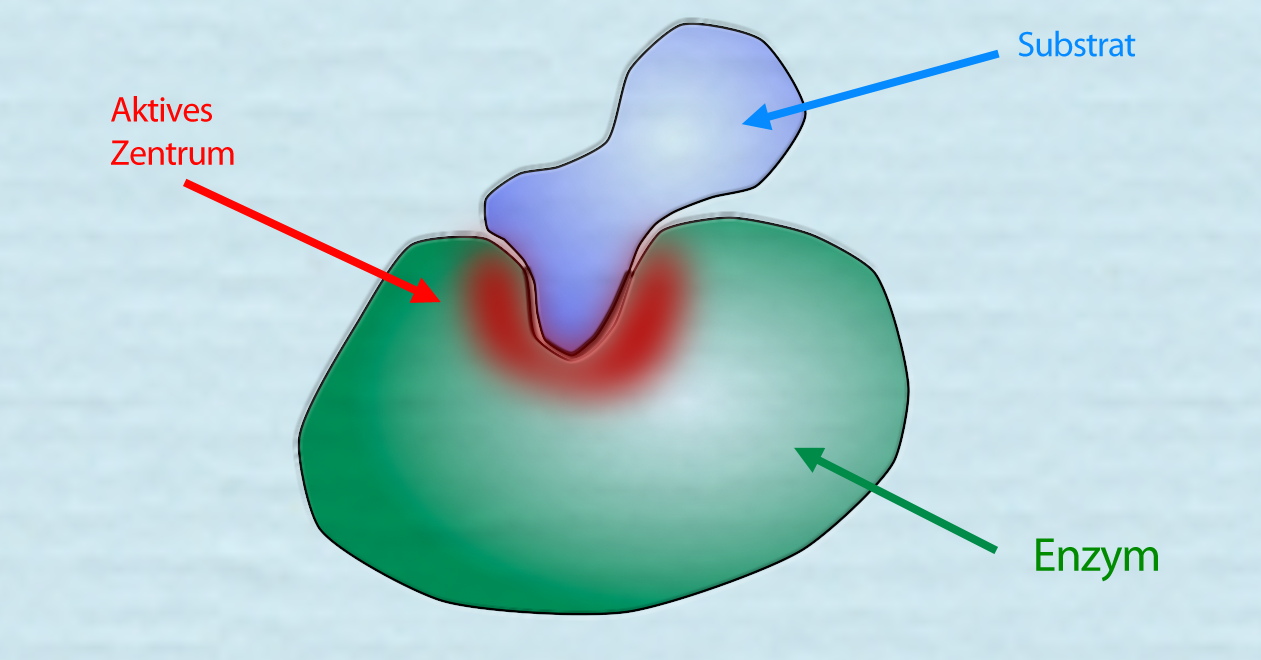
Ein Enzym-Substrat-Komplex
Autor: Ulrich Helmich. Lizenz: Public domain.
In dieser Abbildung sehen wir ein Enzym, das ein passendes Substrat gebunden hat. Das aktive Zentrum ist rot hervorgehoben. Hat eine organische Verbindung eine etwas andere Form als das oben gezeichnete Substrat, passt es nicht mehr in das aktive Zentrum des Enzyms. Das Enzym kann das nicht passende Substrat nicht (oder nicht so gut) verarbeiten.
Was aus der einfachen Zeichnung nicht hervorgeht, ist der Aufbau eines aktiven Zentrums. Ein typisches aktives Zentrum besteht nämlich aus mehreren Abschnitten, von denen zwei eine ganz besondere Rolle spielen: Der Substratbindungsbereich und das katalytische Zentrum.
Substratbindungsbereich
Wie der Name schon andeutet, ist der Substratbindungsbereich dafür verantwortlich, das Substrat zu binden. Dafür sind bestimmte Aminosäuren geeignet, vor allem die Aminosäuren mit positiv oder negativ geladener Seitenkette, also die basischen Aminosäuren (Lysin, Arginin) und bzw. die sauren Aminosäuren (Glutaminsäure, Asparaginsäure).
Der Substratbindungsbereich ist für die Substratspezifität eines Enzyms verantwortlich.
Katalytisches Zentrum
Das katalytische Zentrum eines Enzyms ist für die eigentliche chemische Reaktion verantwortlich, die das gebundene Substrat durchläuft. Oft kommt im katalytischen Zentrum eine sogenannte katalytische Triade vor.
Katalytische Triade
Eine solche katalytische Triade besteht aus drei Aminosäuren, die durchaus in verschiedenen Abschnitten der Primärstruktur lokalisiert sein können und dann im katalytischen Zentrum durch Faltung des Proteins zusammenkommen (siehe Abb. 2). Ein Beispiel für eine solche katalytische Triade sind die Serinproteasen. Hier wird die katalytische Triade durch die Aminosäuren Asparaginsäure, Histidin und Serin gebildet. Interessant hierbei ist, dass nur Asparaginsäure eine elektrisch geladene Seitenkette hat. Alle drei Aminosäuren können aber H-Brücken untereinander und mit dem Substrat ausbilden [2].
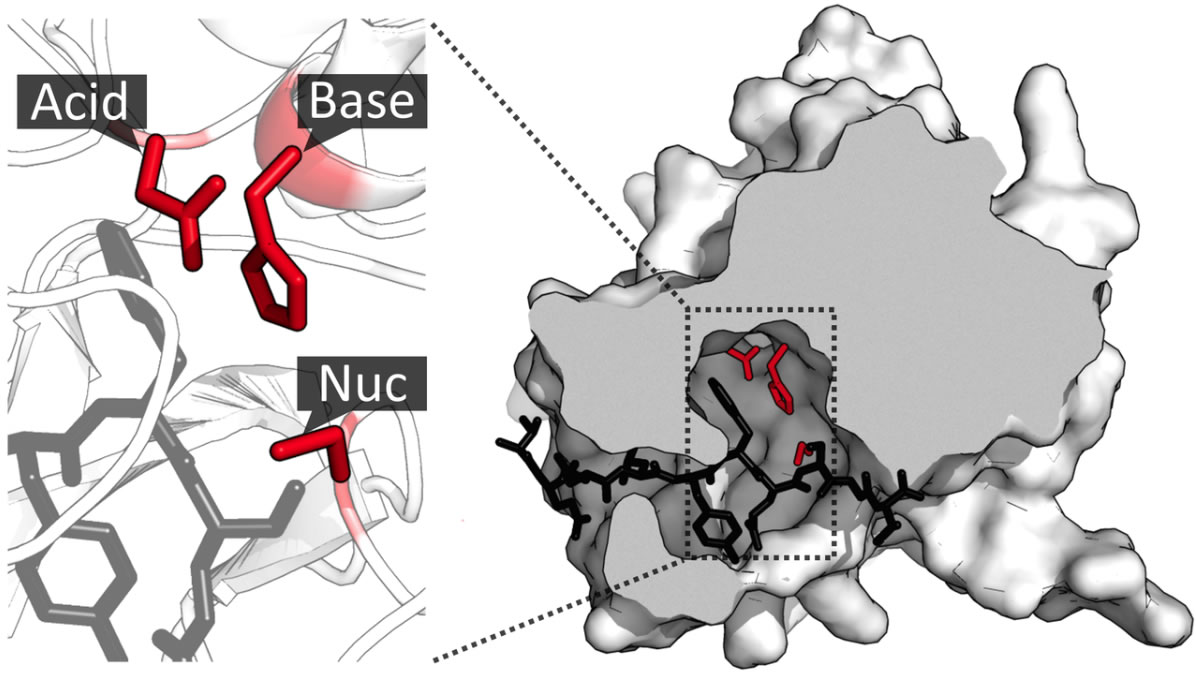
Die TEV-Protease (rechts) und ihr katalytisches Zentrum mit den drei Aminosäuren Asparaginsäure (Acid), Histidin (Base) und Cystein (Nuc).
Quelle: Wikipdeia, Artikel "Katalytische Triade", Autor: Thomas Shafee, Lizenz: Creative Commons Attribution 4.0 International license.
In diesem Bild aus [2] sehen wir die katalytische Triade des Enzyms TEV-Protease, die aus der sauren Aminosäure Asparaginsäure (negative Seitenkette), der basischen Aminosäuren Histidin (positive Seitenkette) und der Seitenkette der Aminosäure Cystein besteht, die nucleophile Eigenschaften hat, also "gern" Kontakt mit positiven Ladungszentren aufnimmt (wegen des elektronegativen S-Atoms).
Das katalytische Zentrum eines Enzyms ist für die Wirkungsspezifität des Enzyms verantwortlich.
Auf der Seite "Spezifität der Enzyme" in der Stoffwechselbiologie-Abteilung meiner Homepage erkläre ich die Substratspezifität und die Wirkungsspezifität von Enzymen eingehend.
Wie wird das Substrat von dem aktiven Zentrum gebunden?
Mit dieser Frage wollen wir uns auf dieser Lexikon-Seite näher beschäftigen. Das aktive Zentrum eines Enzyms besteht aus vielen Aminosäuren, die teils in unterschiedlichen Regionen der Primärstruktur liegen.
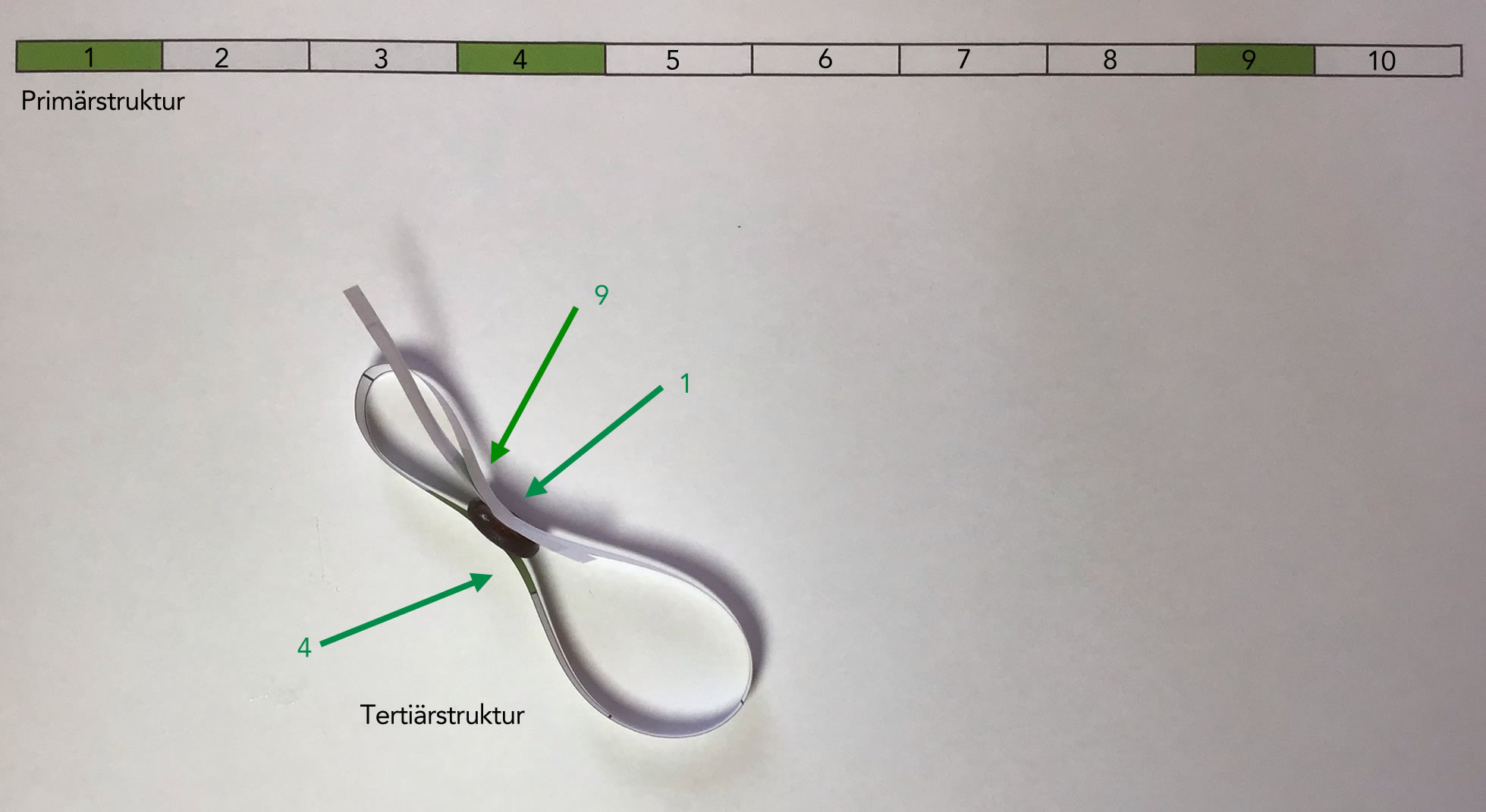
Papiermodell eines kleinen Enzyms
Autor: Ulrich Helmich, Lizenz: Public domain
Um zu veranschaulichen, wie sich ein aktives Zentrum aus mehreren Bereichen der Primärstruktur zusammensetzen kann, habe ich mir ein kleines Papiermodell gebastelt. Oben in der Abbildung 2 sieht man die Primärstruktur eines kurzen Enzyms. Ich habe die Primärstruktur willkürlich in zehn Abschnitte unterteilt. Die Abschnitte 1, 4 und 9 sollen dann das aktive Zentrum bilden.
Diese Primärstruktur habe ich zweimal ausgedruckt. Eine Primärstruktur wurde dann ausgeschnitten und um das Substrat herum gefaltet, etwas Klebstoff war dafür allerdings notwendig. Das aktive Zentrum dieses "Enzyms" wird aus drei Abschnitten gebildet, die in unterschiedlichen Bereichen der Primärstruktur angesiedelt sind.
Weiter oben in dem Abschnitt "Katalytisches Zentrum" haben wir ja bereits die katalytische Triade kennengelernt, die aus drei Aminosäuren besteht, die durchaus in verschiedenen Abschnitten der Primärstruktur verankert sein können. Unter diesem Apsekt kann man das Papiermodell ebenfalls sehen.
Aminosäuren binden das Substrat
Ein Enzym besteht immer aus einer Reihe von Aminosäuren. Also müssen es bestimmte Aminosäuren sein, die das Substrat reversibel binden. Reversibel deswegen, weil das Substrat ja nicht ewig im aktiven Zentrum verbleibt, sondern im Gegenteil, nach Bruchteilen einer Sekunde aus dem aktiven Zentrum wieder entlassen wird - allerdings chemisch verändert.
Typische Aminosäuren, die für diese Substatbindung bewirken, sind in erster Linie die sauren und basischen Aminosäuren mit ihren negativ bzw. positiv geladenen Seitenketten.
Das Enzym Cytochrom-P450-Oxidase beispielsweise bindet sein Substrat mit Hilfe von sechs Aminosäuren, nämlich Valin an Position 295, Asparaginsäure an Position 297, Phenylalanin an Position 87, Tyrosin an Position 96, Valin an Position 247 und Leucin an Position 244 [3]. Diese sechs Aminosäuren befinden sich also in drei verschiedenen Abschnitten der Primärstruktur (87/96, 244/247 und 295/297). Außerdem ist ein Cofaktor notwendig, um das Substrat zu binden.

Das aktive Zentrum von Lysozym
Autor: Ulrich Helmich, Lizenz: Public domain
Das Lysozym ist ein Enzym, das die Zellwände bestimmter Bakterien zerstört. In diesem Enzym besteht das aktive Zentrum aus den Seitenketten der sechs Aminosäuren an Position 35, 52, 62, 63, 101 und 108 des Proteins, das aus insgesamt 129 Aminosäuren besteht [3].
Was man auf den verschiedenen Abbildungen hier auch gut erkennen kann, ist die Tatsache, dass das aktive Zentrum nur einen sehr kleinen Teil des gesamten Enzyms ausmacht. Beim Lysozym wird das aktive Zentrum von sechs Aminosäuren gebildet bzw. von deren Seitenketten.
Man hat Experimente gemacht, in denen man versucht hat, die Zahl der Aminosäuren eines Enzyms so weit wie möglich zu reduzieren, ohne die enzymatische Aktivität zu verlieren. Auf weniger als 100 Aminosäuren ist man da nie gekommen. Ein Enzym muss also aus mindestens 100 Aminosäuren bestehen, damit es katalytisch wirksam ist [3].
Quellen:
- Lexikon der Biologie, Spektrum-Verlag, Artikel "aktives Zentrum"
- Wikipedia, Artikel "Katalytische Triade"
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.