Fallbeispiel: H2-Molekül
Schauen wir uns mal ein Wasserstoff-Molekül an:
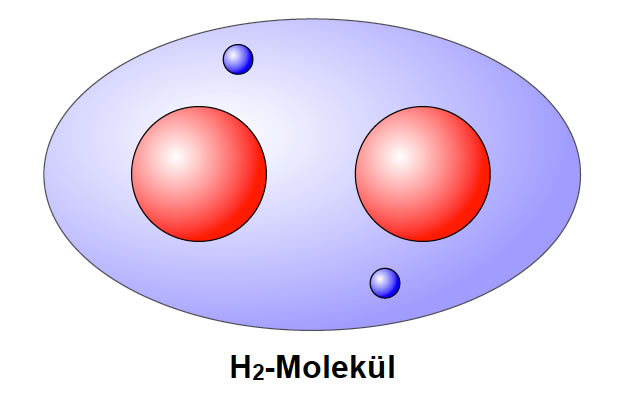
Ein Wasserstoff-Molekül, gezeichnet nach dem Kugelwolkenmodell
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
An sich flitzen die beiden Bindungselektronen mit unvorstellbarer Geschwindigkeit wild in der Kugelwolke herum. Könnte man das Geschehen mit einem normalen Photoapparat mit einer Belichtungszeit von 1/4000 Sekunde festhalten, so würde man die Elektronen allerdings nicht sehen, sondern nur eine unscharfe Wolke. Stellen wir uns nun aber vor, wir hätten eine Kamera mit extrem kurzen Belichtungszeiten von vielleicht 10-9 Sekunden oder noch kürzer. Wenn wir dann eine Aufnahme eines Wasserstoff-Moleküls machten, könnten wir vielleicht so etwas sehen wie in der obigen Abbildung. Die beiden Elektronen halten sich im Augenblick der Aufnahme gerade zufällig in der Mitte der Kugelwolke auf. Die beiden negativen Ladungen sind mehr oder weniger gleichmäßig verteilt, die Bindung ist unpolar.
Machen wir eine neue "Aufnahme", ein paar millionstel Sekunden nach der ersten "Aufnahme":
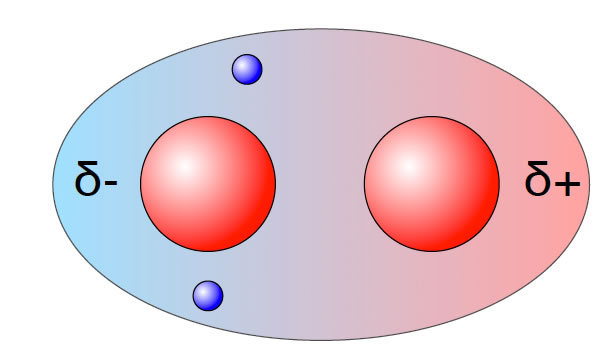
Beide Elektronen befinden sich in der linken Hälfte der gemeinsamen Kugelwolke
Autor: Ulrich Helmich 2017, Lizenz: siehe Seitenende.
Zufällig befinden sich beide Elektronen jetzt in der "linken" Hälfte der Kugelwolke. Die rechte Hälfte ist leer. Durch diese Anordnung der beiden Elektronen bildet sich für extrem kurze Zeit ein Dipol, ein temporärer Dipol. Die linke Seite des H2-Moleküls ist jetzt negativ geladen, die rechte positiv.
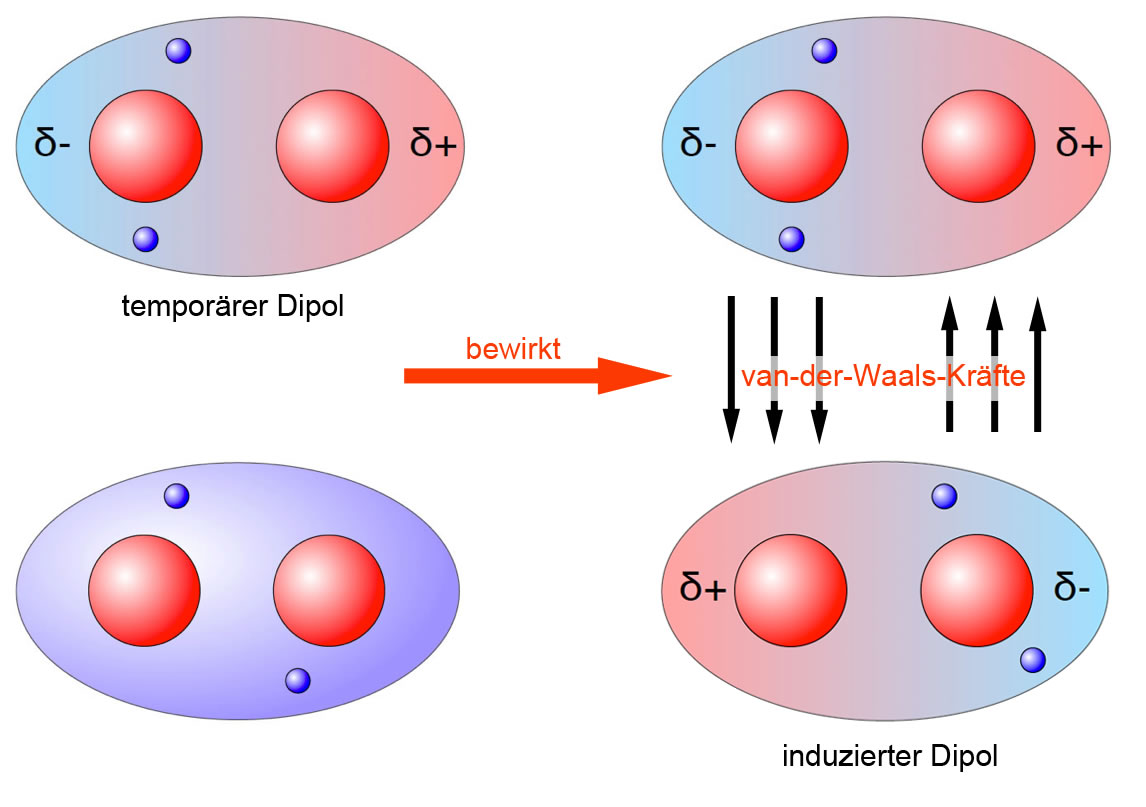
Zwei H2-Moleküle ziehen sich gegenseitig an. Der temporäre Dipol (oben gezeichnet) bewirkt einen induzierten Dipol (unten dargestellt)
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende.
Wie das obere Bild zeigt, bewirkt ein solcher temporärer Dipol, dass die Elektronen eines benachbarten Wasserstoff-Moleküls abgestoßen und dadurch in eine "Ecke" des H2-Moleküls gedrängt werden. Es entsteht ein induzierter Dipol, der genau umgekehrt gepolt ist wie der temporäre Verursacher-Dipol.
Die beiden Dipole ziehen sich jetzt für extrem kurze Zeit gegenseitig an.
Ein paar millionstel Sekunden später sieht die Sache schon wieder ganz anders aus, weil sich die Elektronen in den Kugelwolken mit extrem hoher Geschwindigkeit bewegen.
Diese temporären Dipolkräfte sind aber dafür verantwortlich, dass unpolare Verbindungen wie Wasserstoff, Methan, Hexan und so weiter bei tiefen Temperaturen flüssig oder sogar fest werden können. Gäbe es diese Kräfte nicht, so wären diese Verbindungen selbst bei den tiefsten Temperaturen gasförmig und nicht wie beispielsweise Hexan bei Zimmertemperatur flüssig. Oder denken Sie an das Element Iod, das ebenfalls aus völlig unpolaren I2-Molekülen besteht. Es ist bei Zimmertemperatur sogar fest - dank der van-der-Waals-Wechselwirkungen zwischen den Iod-Molekülen.