Ein kleiner Versuch
In dem aktuellen Schroedel-Buch "Chemie heute, Qualifikationsphase NRW" von 2014 steht auf Seite 144 ein schöner kleiner Versuch, der sich hervorragend für eine Einführungsstunde in das Thema "elektrophile Substitution" eignet. Vor einiger Zeit habe ich diesen Versuch mit meinem Chemie GK als Schülerversuch im Abzug durchgeführt. Allerdings hatten meine Schüler(innen) Schwierigkeiten, eine Reaktion zu beobachten, vor allem die Sache mit dem Indikatorpapier hat nicht funktioniert. Daher habe ich anschließend den Versuch als Demonstrationsversuch mit deutlich größeren Mengen an Edukten durchgeführt.
Demonstrations-Versuch
Bromierung von Benzolderivaten
Durchführung:
- Der untere Teil von zwei großen Reagenzgläsern wird mit Aluminiumfolie umwickelt. Dann gibt man ca. 10 ml Toluol und anschließend 2 ml Bromwasser in jedes Reagenzglas.
- Beide Reagenzgläser werden nun mit Stopfen verschlossen und kräftig geschüttelt. Dann lässt man beide Reagenzgläser für ein paar Minuten stehen, so dass sich die Gemische wieder entmischen können.
- Die Aluminiumhülle wird nun von beiden Reagenzgläser vorübergehend entfernt. Man sieht, dass sich die Stoffgemische wieder entmischt haben. Oben in den Reagenzgläsern befindet sich eine gelb-braun gefärbte organische Phase, unten eine leicht gelbe anorganische Phase (siehe auch Abbildung 1, Reagenzglas ganz links).
- Mit Pipetten werden nun die organischen Phasen abgesaugt und in zwei weitere Reagenzgläser pipettiert.
- Die beiden neuen Reagenzgläser werden wieder mit Aluminiumfolie umwickelt. Dann werden in das eine Reagenzglas zwei bis drei Spatelspitzen Eisenpulver gegeben. Das zweite Reagenzglas dient als Kontrolle, hier wird also kein Eisenpulver dazugegeben.
- Beide Reagenzgläser werden nun leicht geschüttelt. Dann lässt man sie wieder für ein paar Minuten stehen.
- Jetzt wird die Aluminiumfolie entfernt, und das Versuchsergebnis wird photographisch festgehalten.
Beobachtungen:

Die Versuchsergebnisse.
Links: Ein Reagenzglas mit den beiden Phasen vor der Zugabe von Eisenpulver. Die organische Phase befindet sich oben.
Mitte: Die abgesaugte organische Phase ohne Eisenpulver.
Rechts: Die abgesaugte organische Phase mit Eisenpulver
Auswertung:
Nach Schritt 3 der Durchführung hat sich das Stoffgemisch wieder entmischt, wie man in der Abbildung 1 ganz links gut sehen kann. Oben befindet sich die organische Phase, unten die anorganische. Die intensive Orangefärbung der organischen Phase ist auf das gelöst Brom zurückzuführen. Die leichte Gelbfärbung der anorganischen Phase zeigt, dass in der wässrigen Phase ebenfalls noch etwas Brom gelöst ist.
Im Vergleich zum Bromwasser enthält die anorganische Phase deutlich weniger gelöstes Brom. Die Erklärung für diese Beobachtung ist recht einfach: Brom besteht aus völlig unpolaren Br2-Molekülen, die sich in einem unpolaren Lösemittel wie Toluol viel besser lösen als in einem polaren Lösemittel wie Wasser.
Das mittlere Reagenzglas zeigt, dass sich die Farbe des Toluol-Brom-Gemischs auch nach längerer Zeit im Dunklen nicht verändert hat. Hätte das Benzol-Molekül drei richtige C=C-Doppelbindungen, wäre sofort eine Entfärbung eingetreten.
Dieser Versuch zeigt uns daher, dass die drei C=C-Doppelbindungen des Toluol-Moleküls keine richtigen Doppelbindungen sind. Toluol kann keine elektrophile Addition eingehen.
Warum wurden die Reagenzgläser nun mit Alufolie umwickelt?
Bei starker Belichtung entfärbt sich der Reagenzglasinhalt langsam, weil Toluol nicht nur ein Aromat ist, sondern auch eine Methylgruppe enthält. Diese kann eine radikalische Substitution eingehen, dabei wird ein H-Atom der Methylgruppe durch ein Br-Atom ersetzt.
Das rechte Reagenzglas in Abbildung 1 zeigt uns die Wirkung des Eisenpulvers. Setzt man dem Toluol-Brom-Gemisch ein paar Spatelspitzen Eisenpulver zu, so wird das Gemisch in kurzer Zeit entfärbt. Das Brom reagiert jetzt mit dem Toluol.
Den genauen Reaktionsmechanismus dieser Umsetzung werden wir jetzt kennenlernen.
Die elektrophile Substitution:
Bildung des π-Komplexes
Wir haben den Versuch zwar mit Toluol durchgeführt, aber im Folgenden soll er am Beispiel des einfacheren Benzols erklärt werden. An sich hätten wir bei dem Versuch ja Benzol verwendet, aber leider ist das für den Schulunterricht verboten; Toluol ist der offizielle Ersatzstoff für Benzol.
Das aromatische System des Benzols ist wegen der sechs delokalisierten π-Elektronen ein Angriffsziel für elektrophile Teilchen. Br2-Moleküle sind allerdings nicht elektrophil, da es sich um unpolare Teilchen handelt. Damit Br2-Moleküle mit Benzol reagieren können, müssen sie erst polarisiert werden.
Rückblick: Die elektrophile Addition von Brom an ein Alken
Bei der Bromierung von Alkenen nach dem Mechanismus der elektrophilen Addition ist es die C=C-Doppelbindung selbst, die das Brom-Molekül polarisiert. Zunächst bildet sich ein lockerer pi-Komplex aus der Doppelbindung und dem polarisierten Brom-Molekül, der dann in einen etwas festeren Sigma-Komplex übergeht, nachdem das Brom-Molekül heterolytisch in ein Brom-Kation und ein Bromid-Anion gespalten wurde.
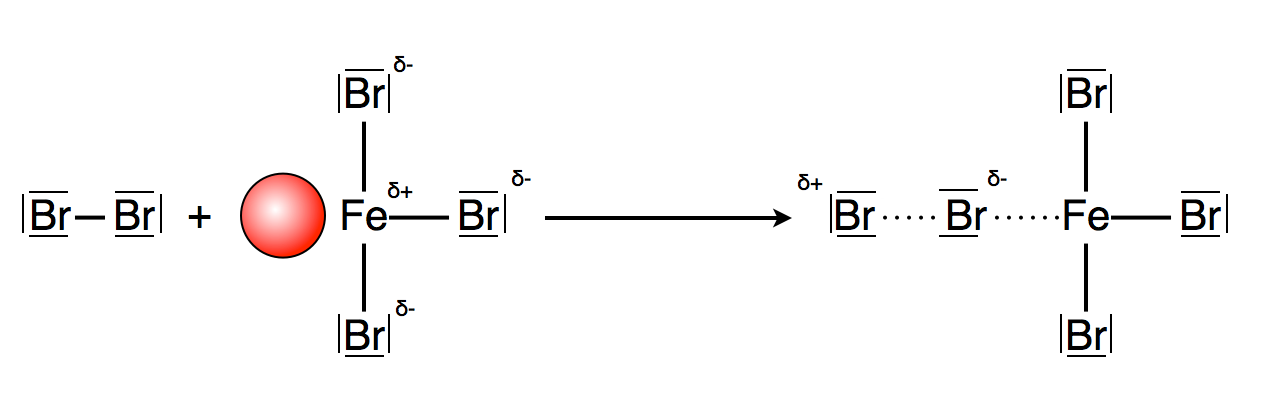
Polarisierung des Brom-Moleküls bei der elektrophilen Substitution
Die sechs π-Elektronen des Benzols sind nicht in der Lage, das Brom-Molekül ausreichend zu polarisieren. Erst mit Hilfe eines Katalysators gelingt die Polarisierung des Brom-Moleküls. Theoretisch sollte sich Aluminiumbromid AlBr3 oder Aluminiumchlorid AlCl3 gut dafür eignen. Aluminiumchlorid ist eine Lewis-Säure, das Al-Atom besitzt eine leere Kugelwolke bzw. ein leeres Orbital und kann daher mit einer Lewis-Base reagieren. Allerdings hat der Schulversuch mit Aluminium nicht funktioniert, mit Eisen dagegen sehr gut.
Gibt man in die organische, bromhaltige Phase etwas Eisenpulver, so reagiert dieses mit dem vorhandenen Brom zu Eisenbromid FeBr3. Auch das Eisen-Atom hat eine leere Kugelwolke bzw. ein leeres Orbital. Eisenbromid ist daher eine Lewis-Säure.
Das Brom-Moleküle besitzt sechs freie Elektronenpaare bzw. doppelt besetzte Orbitale und ist daher eine Lewis-Base. Es kann also folgende Reaktion stattfinden:
Die Abbildung 2 zeigt den Vorgang der Polarisierung des Brom-Moleküls durch das Eisenbromid. Nun ist das Brom-Molekül elektrophil genug, um mit seinem positiv polarisierten Ende die pi-Elektronen des Benzolrings angreifen zu können:
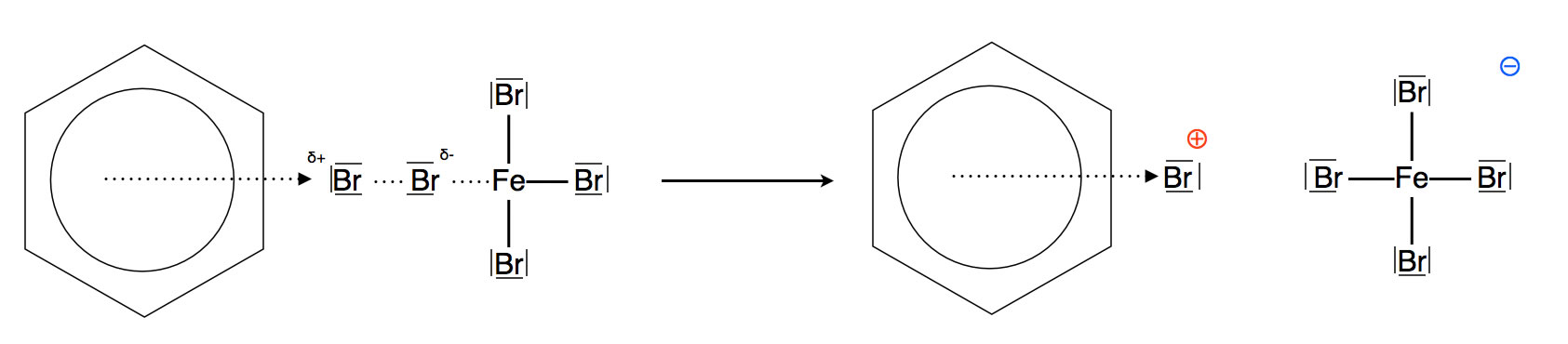
In der Abbildung 3 sehen wir die Bildung des π-Komplexes (sprich: pi-Komplex). Das bereits polarisierte Brom-Molekül wird dabei heterolytisch gespalten. Dabei spielen sowohl der Katalysator Eisenbromid wie auch die pi-Elektronen des Benzols eine wichtige Rolle. Das gebildete Brom-Kation setzt sich dann als Elektrophil in die pi-Elektronenwolke des Benzols. In der Graphik wird diese lockere Bindung durch einen gestrichelten Pfeil angedeutet. Das entstandene Brom-Anion verbindet sich kovalent mit dem Eisenbromid, dabei bildet sich der FeBr4- - Komplex.
Wichtig ist hier, dass der aromatische Charakter des Benzol-Rings noch besteht. Alle sechs C-Atome des Benzolrings sind sp2-hybridisiert.
Der π-Komplex ist - zumindest bei der Benzolbromierung - ein instabiler Übergangszustand, der nicht isoliert werden kann. Es gibt allerdings sehr starke Elektrophile wie beispielsweise das Nitrosyl-Kation, die einen relativ stabilen π-Komplex bilden können.
Bildung des σ-Komplexes
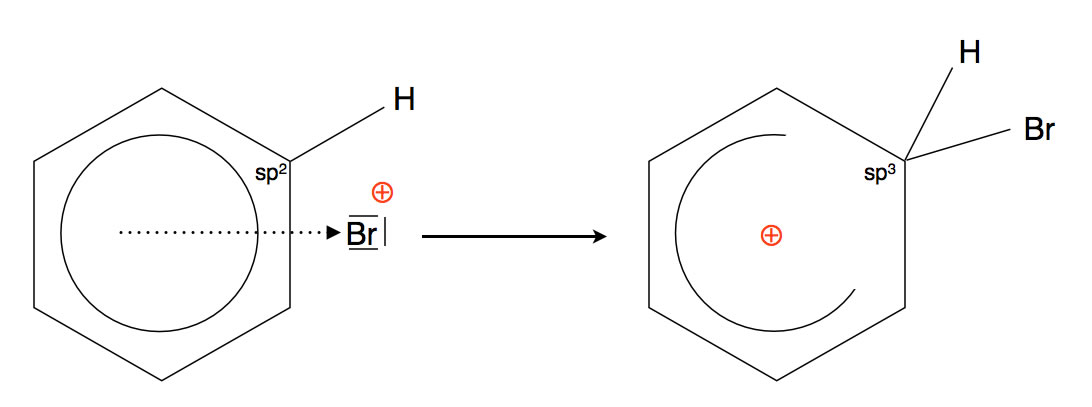
Im nächsten Schritt verbindet sich das Brom-Kation mit einem der sechs C-Atome des Benzols. Dabei entsteht eine kovalente Bindung zwischen dem C-Atom und dem Br-Atom, während die positive Ladung des Brom-Kations über den ganzen Benzolring "verteilt" wird.
Wenn das C-Atom (in der Abbildung rechts oben) eine Verbindung mit dem Brom-Atom eingeht, ändert es seinen Hybridisierungszustand: Aus dem sp2-Atom wird ein sp3-Atom.
Durch diesen Hybridisierungswechsel verliert das C-Atom sein pz-Orbital, und der Ring aus sechs pz-Orbitalen, der ja für den aromatischen Zustand des Benzols verantwortlich war, ist unterbrochen. Damit wird der aromatische Zustand des Benzolringes komplett aufgehoben.
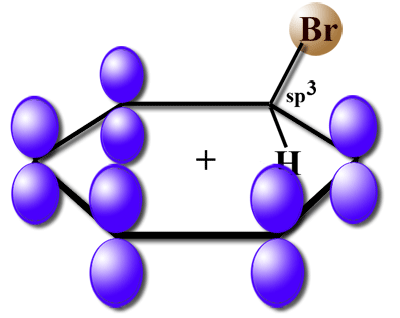
Hier eine etwas ältere Abbildung des sigma-Komplexes, in der man die p-Orbitale des Benzolrings gut sehen kann:
Auf dem Weg zum Produkt
Wie läuft die Reaktion nun weiter? Der jetzt herrschende Zustand ist energetisch ungünstig, da
a) der aromatische Charakter des
Benzols nicht mehr besteht und
b) die delokalisierte positiven Ladung das Ringsystem stört.
Es gibt nun zwei Möglichkeiten, wie wieder ein energetisch günstiger Zustand hergestellt werden könnte. Betrachten wir dazu das folgende Energiediagramm:
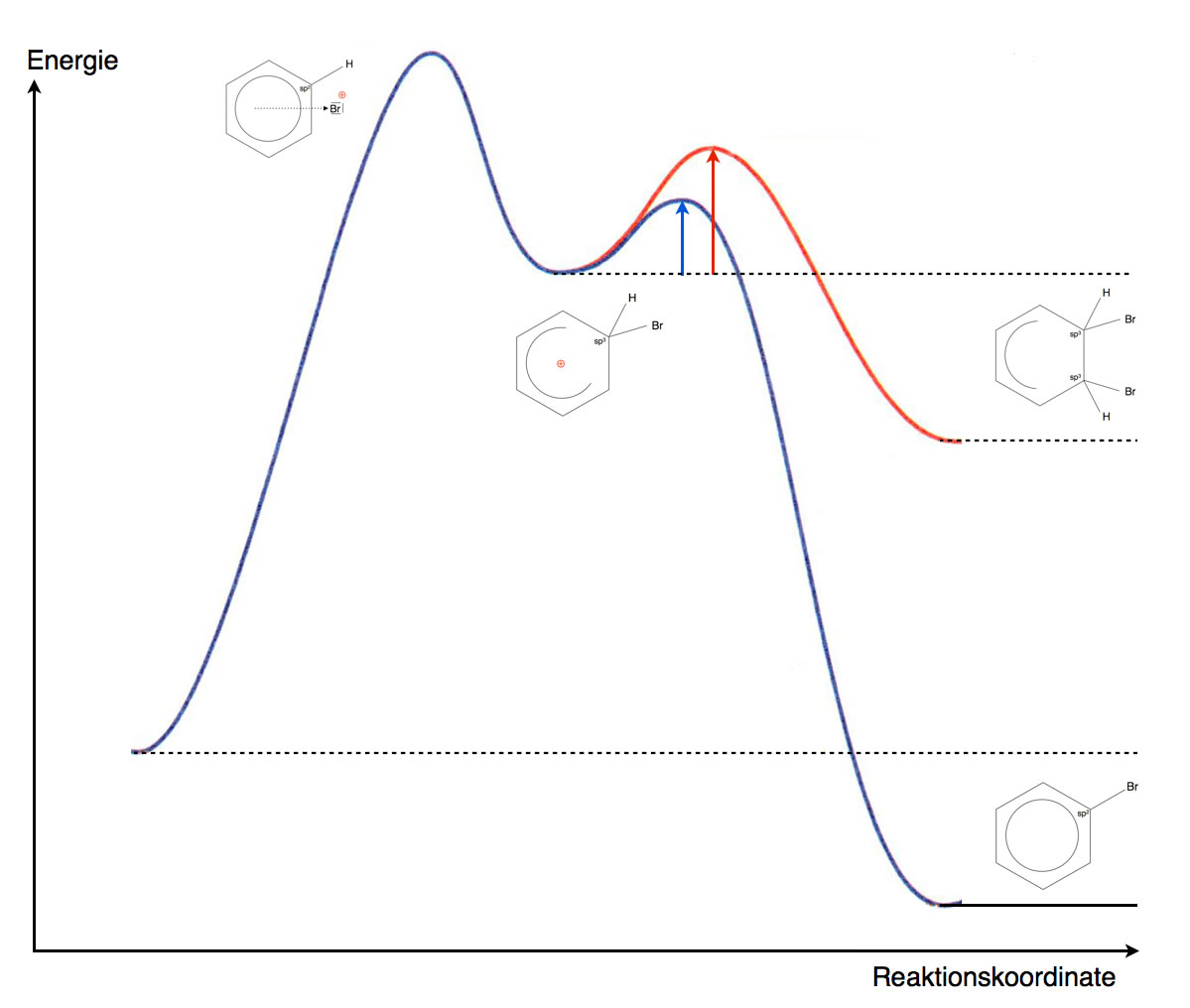
Energiediagramm der Substitution (dunkelblau) und der Addition (rot)
Reaktionsweg 1: Addition eines Nucleophils
Die delokalisierte positive Ladung im Benzolring zieht nucleophile Teilchen an, zum Beispiel Bromid-Ionen, Hydroxid-Ionen etc. Ein solches Nucleophil könnte sich nun an ein anderes C-Atom des Benzolrings anlagern und dabei die positive Ladung übernehmen. Im Falle der Addition eines Bromid-Ions würde ein Dibrom-Cyclohexadien entstehen.
Vorteil: Die energetisch ungünstige positive Ladung wird neutralisiert.
Nachteil 1: Das sp3-hybridisierte C-Atom des sigma-Komplexes bleibt sp3-hybridisiert.
Nachteil 2: Das sp2-hybridisierte C-Atom, an das sich das Nucleophil anlagert, wird ebenfalls sp3-hybridisiert.
Der aromatische Zustand des Benzols würde bei diesem Reaktionsweg, der nichts anderes ist als eine elektrophile Addition, endgültig verloren gehen. Eine elektrophile Addition an den Benzolring ist theoretisch möglich, aber energetisch sehr ungünstig.
Das Reaktionsprodukt hätte eine deutlich höhere Energie als die Ausgangsstoffe, und entsprechend hoch wäre die Aktivierungsenergie für diesen Teilschritt. Die Geschwindigkeit einer Reaktion hängt wiederum von der Aktivierungsenergie ab, so dass die Wahrscheinlichkeit für diesen Reaktionsschritt sehr gering wäre.
Reaktionsweg 2: Abgabe eines Protons
Spielen wir nun einen anderen Reaktionsweg durch. Dasjenige C-Atom des Benzolringes, das das Br-Atom aufgenommen hat, ist im Sigma-Komplex sp3-hybridisiert. Es ist immer noch mit dem Br-Atom und dem "alten" H-Atom verbunden.
Wenn dieses sp3-hybridisierte C-Atom nun sein H-Atom als Proton H+ abgibt und damit die beiden Bindungselektronen behält (heterolytische Spaltung), ändert es dabei seinen Zustand wieder zurück zu sp2. Damit sind alle sechs C-Atome des Benzolrings sp2-hybridisiert, und die sechs pz-Orbitale bilden wieder einen geschlossenen Ring, in dem sich sechs Elektronen aufhalten können. Mit anderen Worten: Der energetisch günstige aromatische Zustand hat sich zurück gebildet.
Der Energieverlauf dieses Reaktionsweges sieht sehr viel günstiger aus, vor allem ist hier die Reaktion exotherm, und die Aktivierungsenergie für den zweiten Reaktionsschritt ist recht gering. Also ist diese Reaktion sowohl thermodynamisch (exotherme Reaktion) wie auch kinetisch (geringere Aktivierungsenergie) gegenüber der Addition bevorzugt.
Betrachten wir beide Reaktionswege noch einmal in einer Skizze:
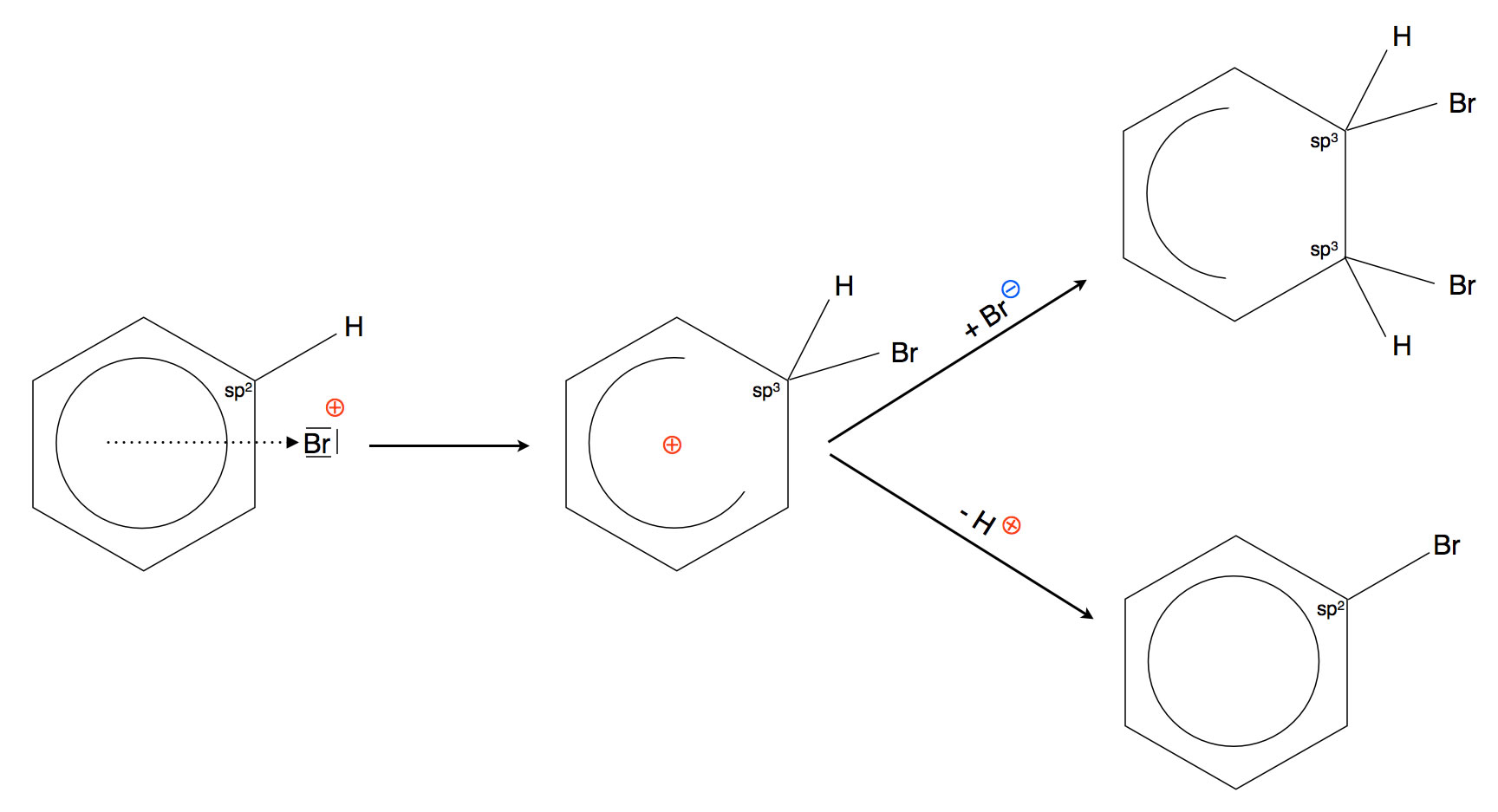
Die beiden Konkurrenzreaktionen elektrophile Addition und elektrophile Substitution
Rückbildung des Katalysators
Noch sind wir nicht ganz am Ende angekommen. Das abgespaltene Proton "zieht" nun das vierte Br-Atom aus dem FeBr4- - Komplex heraus, dabei entstehen HBr und FeBr3. Das ganz am Anfang eingesetzte FeBr3 hat sich also zurückgebildet. Formal nimmt es gar nicht an der Reaktion teil, ermöglicht aber überhaupt erst die Reaktion. Also kann man FeBr3 zu Recht als Katalysator bezeichnen.
Man muss aber kein FeBr3 zu den Edukten dazugeben, es reicht aus, wenn man Eisenpulver dazugibt. Das katalytisch aktive FeBr3 bildet sich dann "von selbst", wenn das Eisen mit dem gelösten Brom reagiert.
Seitenanfang -
Bromierung -
Nitrierung -
Sulfonierung -
Alkylierung -
Acylierung -
Azokupplung -
Zweitsubstitution