Auf dieser Seite wird für Leistungskursschüler und Studenten des Grundstudiums Chemie die Bildung des sigma-Komplexes bei der Bromierung von Benzol näher beschrieben.
Delokalisierung der positiven Ladung
Das folgende Bild stellt das C-Atom des Benzolringes in den Vordergrund, das sich mit dem Brom-Atom verbindet:
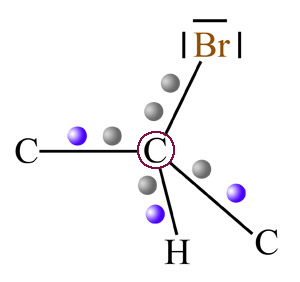
Ein Ausschnitt aus dem σ-Komplex aus Benzol und Brom
Dieses C-Atom (in der Abbildung rot umrandet) hat normalerweise vier Valenzelektronen, die sich im sp3-hybridisierten Zustand gleichmäßig auf die vier sp3-Hybridorbitale verteilen.
Für die Bildung der C-Br-Bindung werden zwei Elektronen benötigt, schließlich heißt es ja "Elektronen-paar-bindung". Dem Brom-Kation fehlt aber ein Elektron, also muss sich das C-Atom das für die Elektronenpaarbindung benötigte Elektron woanders "besorgen".
Wo könnte sich das C-Atom das fehlende Elektron "ausleihen"? Schauen wir uns den Benzolring näher an. Die C-Atome sind durch überlappende sp2-Hybridorbitale miteinander verbunden. Diese Bindungen sind recht stabil, hier kann man sich kein Elektron "leihen".
Die C-H-Bindungen sind ebenfalls recht stabil, es bleiben also nur die "locker sitzenden" pi-Elektronen der pz-Orbitale übrig. Allerdings existieren nur noch fünf dieser pz-Orbitale, denn das betrachtete C-Atom hat ja seinen Hybridisierungszustand von sp2 nach sp3 gewechselt, und damit ist das sechste pz-Orbital nicht mehr vorhanden.
In den übrig gebliebenen fünf pz-Orbitalen befinden sich jetzt fünf Elektronen. Eins dieser Elektronen wird jetzt für die C-Br-Bindung herangezogen, somit verbleiben nur noch vier Elektronen in dem System aus fünf pz-Orbitalen. Das fehlende Elektron ist mit einer positiven Ladung gleichzusetzen.
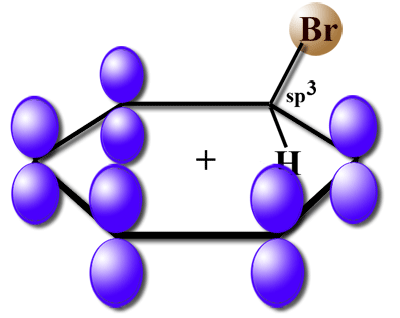
Delokalisierung der positiven Ladung des Sigma-Komplexes
Bei diesem Bild hatte ich erst überlegt, vier Elektronen in die fünf pz-Orbitale einzuzeichnen. Ein pz-Orbital wäre dann leer geblieben. Das würde aber nicht zu der Tatsache passen, dass die vier Elektronen delokalisiert sind. Wollte man es richtig machen, müsste man in jedes pz-Orbital genau ein 4/5 Elektron einzeichnen, was natürlich nicht möglich ist.
Fassen wir zusammen: Der σ-Komplex besteht aus einem Benzolring, der ein zusätzliches Br-Atom aufgenommen hat und der eine delokalisierte positive Ladung irgendwo im Ring trägt.
Mesomerie-Stabilisierung
Der σ-Komplex ist deutlich instabiler als der intakte Benzolring, weil der aromatische Zustand aufgehoben ist. Allerdings wird der Komplex durch seine drei Grenzstrukturen stabilisiert. Bereits Grundkurs-Schüler kennen die alte Bauernregel: "Je mehr Grenzstrukturen eine Verbindung besitzt, desto stabiler sie ist". Und von dem σ-Komplex gibt es drei Grenzstrukturen:
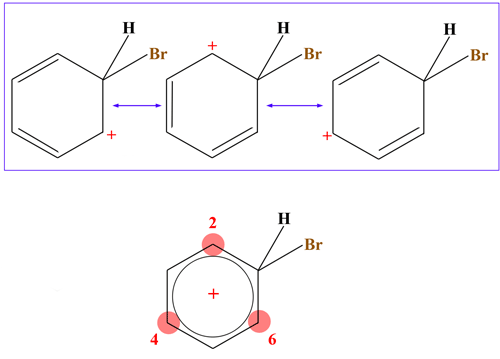
Die drei Grenzstrukturen des Sigma-Komplexes
Man sieht deutlich, dass bezüglich der Delokalisierung der positiven Ladung nicht alle fünf C-Atome gleich sind. Bei drei C-Atomen ist die Wahrscheinlichkeit, dass sich die positive Ladung hier befindet, besonders hoch.
