Wir haben nun schon einige wichtige Reaktionen kennengelernt, die nach dem Mechanismus der elektrophilen Substitution ablaufen: Die Halogenierung (Bromierung), die Nitrierung und die Sulfonierung. Allen drei Reaktionen gemein ist, dass ein positiv geladenes Elektrophil das pi-Elektronensystem des Benzolrings angreift und eines der H-Atome ersetzt.
Wenn man sich mal die Reaktionsmechanismen anschaut, die im Unterricht der Q1 bereits behandelt worden sind, dann sticht sofort die nucleophile Substitution ins Auge, und zwar die SN1-Reaktion. Warum?
Bei der SN1-Reaktion ist der erste (langsame und geschwindigkeitsbestimmende) Schritt die heterolytische Abspaltung einer negativ geladenen Abgangsgruppe, zum Beispiel eines Bromid-Ions oder einer Hydroxy-Gruppe. Zurück bleibt ein positiv geladenes Zwischenprodukt, ein Carbenium-Ion mit einer leeren Kugelwolke an einem C-Atom.
Diesem Carbenium-Ion stehen nun zwei verschiedene Wege offen, die energetisch ungünstige positive Ladung zu verlieren: Entweder lagert sich ein anderes Nucleophil an, oder es wird ein Proton abgegeben.
Nachdem wir nun aber den Mechanismus der elektrophilen Substitution kennen gelernt haben, gibt es eine dritte Möglichkeit. Das Carbenium-Ion lagert sich als Elektrophil an einen Benzolring an.
In der Tat ist diese Reaktion, die nach ihren beiden Entdeckern als Friedel-Crafts-Alkylierung bezeichnet wird, eine sehr wichtige Reaktion der organischen Chemie, mit ihr kann man nämlich Alkylgruppen in einen Aromaten einführen.
Allerdings haben die so eingeführten Alkylgruppen wegen ihres +I-Effektes eine aktivierende Wirkung auf den Benzolring, daher kann es bei der Alkylierung leicht passieren, dass unkontrolliert eine zweite oder dritte Alkylgruppe in den Ring eingebaut wird.
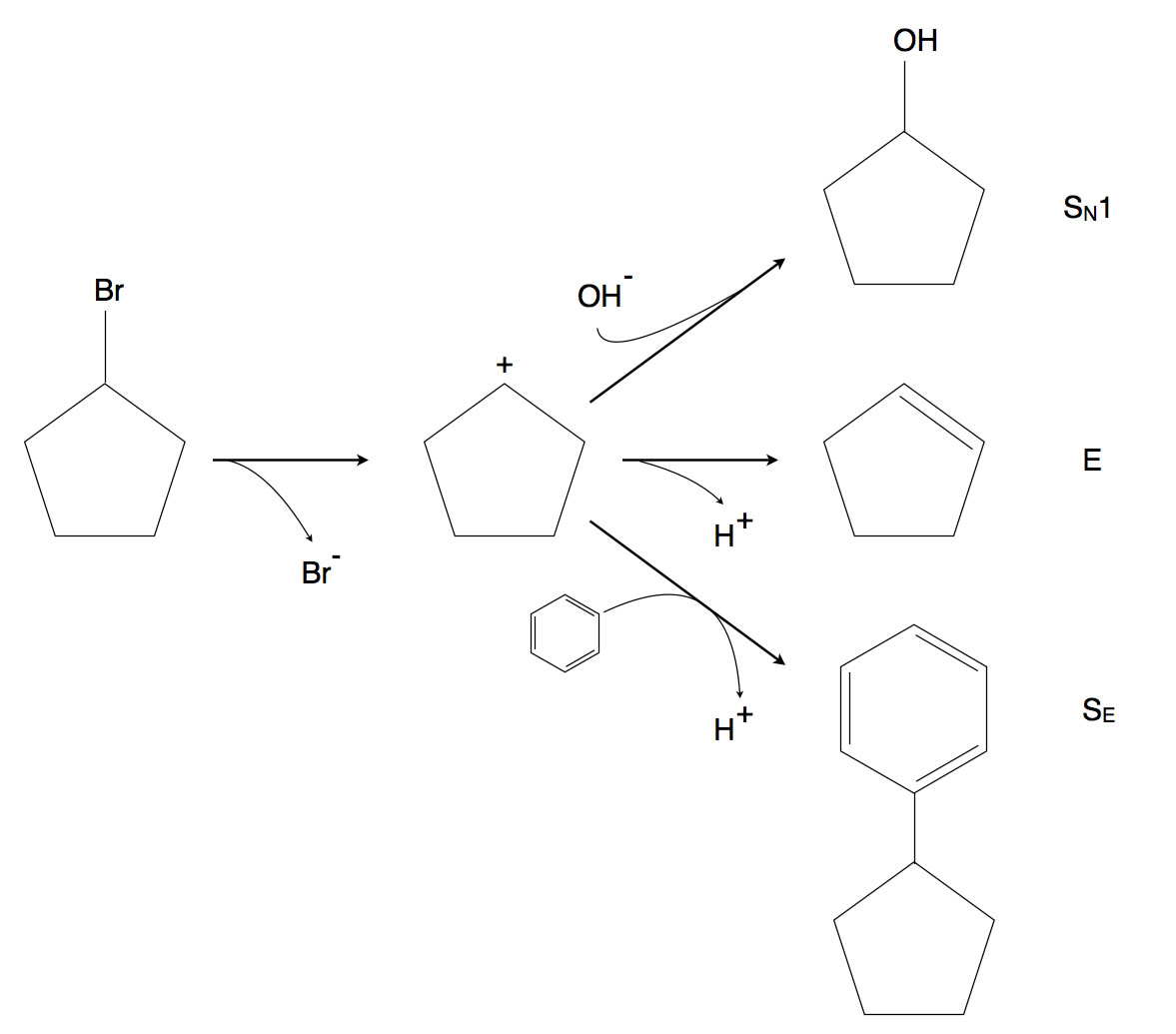
Die drei Reaktionsmöglichkeiten eines Carbenium-Ions
Die Abbildung zeigt die drei Reaktionsmöglichkeiten eines Carbenium-Ions am Beispiel des Cyclopentyl-Kations, das sich aus Brom-Cyclopentan gebildet hat. Für den Abschnitt "Elektrophile Substitution" ist der untere Reaktionsweg der interessanteste. Das Carbenium-Ion greift als Elektrophil den Benzolring an und dann läuft eine ganz gewöhnliche elektrophile Substitution ab.
Bildung des Carbenium-Ions
Der erste Schritt bei einer Alkylierung ist die Bildung eines Carbenium-Ions. Dazu gibt es mehrere Möglichkeiten, die ich auf der Lexikon-Seite "Carbenium-Ionen" ausführlich erläutert habe.
Bei der Herstellung von Carbenium-Ionen aus Halogenalkanen spielen Verbindungen wie Eisenbromid FeBr3 oder Aluminiumchlorid AlCl3 oder -bromid AlBr3 eine wichtige Rolle als Katalysator; auch Borfluorid BF3 wird dazu eingesetzt. All diesen Verbindungen gemeinsam ist, dass es sich um Lewis-Säuren handelt, die eine leere Kugelwolke bzw. ein leeres Valenzorbital besitzen, in das sich das freie Elektronenpaar einer Lewis-Base hineinsetzen kann.
Wie wir bereits von der Benzol-Bromierung her wissen, sind diese Verbindungen in der Lage, Chlor- oder Brom-Atome aus Verbindungen heterolytisch abzuspalten. Nehmen wir als Beispiel doch einfach wieder das Brom-Cyclopentan aus der obigen Abbildung.
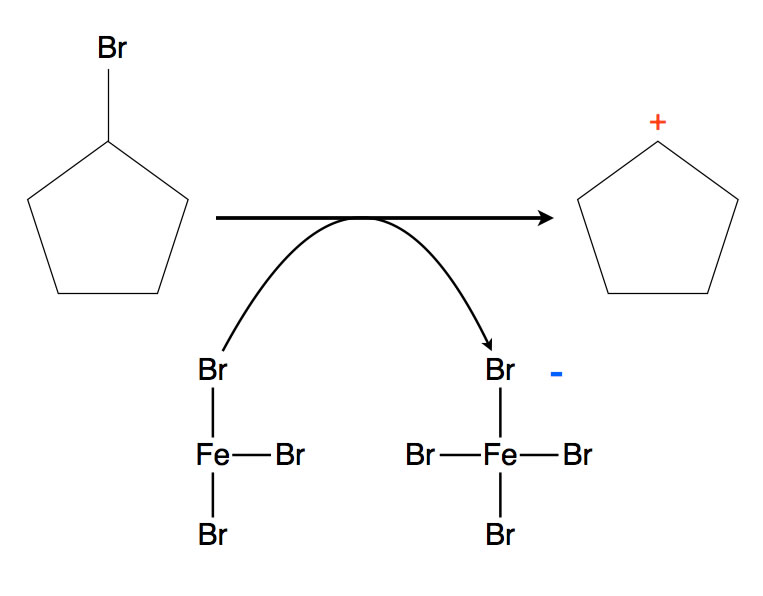
Bildung des Cyclopentyl-Kations durch Einwirken von Eisenbromid
Eine OH-Gruppe kann man leicht mit Hilfe von Schwefelsäure aus einem organischen Molekül entfernen, besonders leicht geht das bei sekundären oder tertiären Alkoholen:
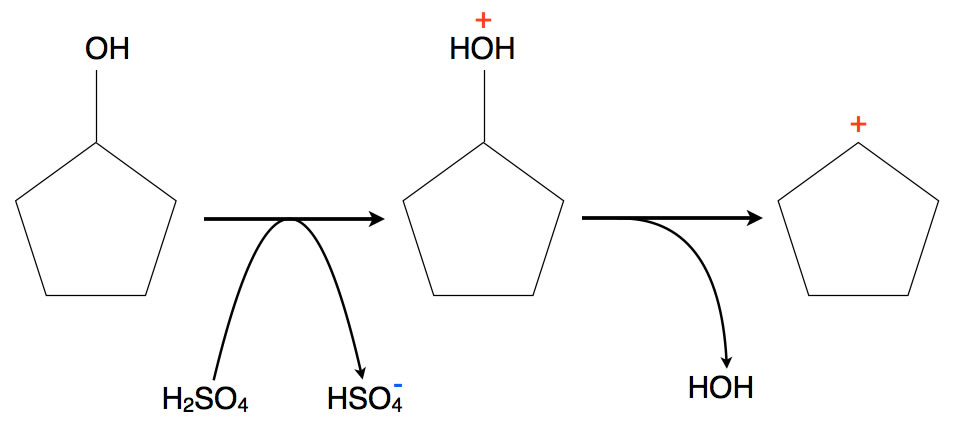
Entfernung einer OH-Gruppe
Auch durch direkte Protonierung eines Alkens kann man ein Carbenium-Ion für die Friedel-Crafts-Alkylierung gewinnen:
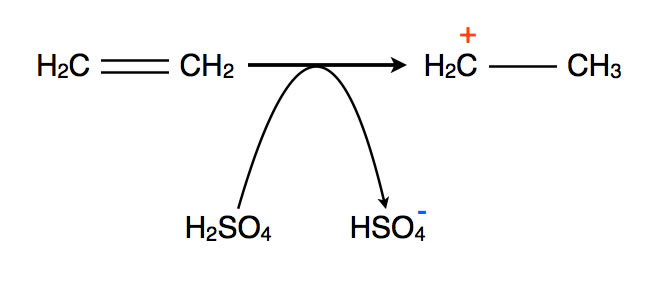
Direkte Protonierung eines Alkens
Nach der Bildung des Carbenium-Ions, auf welchem Weg auch immer, lagert sich dieses dann an einen Benzolring an. Es entsteht der "übliche" sigma-Komplex mit einer delokalisierten positiven Ladung im Ringsystem, und dann wird ein Proton abgespalten, um den aromatischen Zustand wieder herzustellen. Genügend Protonen-Akzeptoren stehen ja zur Verfügung, zum Beispiel das Säurerest-Anion der Schwefelsäure oder das gebildete [AlCl4]--Ion.
Aromaten, deren Elektronendichte durch elektronenziehende Gruppen verringert wird, sind nicht in der Lage, eine Friedel-Crafts-Alkylierung durchzuführen. Nitrobenzol gehört zum Beispiel zu dieser Gruppe "elektronenarmer" Aromaten. Ist erst mal eine Alkylgruppe in den Aromaten eingeführt, nimmt wegen des +I-Effekts der Alkylgruppe die Elektronendichte im Aromaten zu, und die Einführung einer zweiten Alkylgruppe wird dadurch erleichtert. Allerdings ist dies auch einer der Nachteile der Friedel-Crafts-Alkylierung, es können nämlich leicht ungewollt mehrere Alkylgruppen in den Aromaten eingeführt werden.
Anwendungsbeispiele
Auf der Vertiefungsseite, die leider noch nicht fertig gestellt ist (Zeitmangel), habe ich zwei oder drei Anwendungsbeispiele für die Friedel-Crafts-Alkylierung zusammengestellt. Bei nächster Gelegenheit werde ich diese Vertiefungsseite fertigstellen.
