Anilin
Anilin C6H5-NH2 ist ein sehr wichtiger Ausgangsstoff für die Farbstoffindustrie. Eine bekannte Chemie-Firma mit weltweit 112.000 Mitarbeitern ist nach dem Anilin benannt, die Badische Anilin- & Soda-Fabrik, heute besser bekannt als BASF.
Ursprünglich wurde Anilin 1826 aus dem Farbstoff Indigo hergestellt. 1897 entdeckt die BASF, dass man Indigo auch umgekehrt preiswert aus Anilin herstellen kann.
Heute stellt man das Anilin bei 270 ºC und leichtem Überdruck an einem Kupfer-Katalysator aus Nitrobenzol C6H5-NO2 und Wasserstoffgas H2 her.
Das Nitrobenzol (eine blassgelbe, nach bitteren Mandeln riechende, aber äußerst giftige ölige Flüssigkeit) kann man aus Benzol und rauchender Salpetersäure herstellen. Zum ersten Mal hat Eilhard Mitscherlich 1834 diese Reaktion durchgeführt, und bereits 1847 wurde Nitrobenzol industriell hergestellt. 1863 entdeckte Julius Wilbrand dann, dass ein Gemisch aus konz. Salpetersäure und konz. Schwefelsäureviel reaktiver ist als rauchende Salpetersäure. Dieses Gemisch wurde dann als Nitriersäure bezeichnet.
Salpetersäure ist eine ziemlich aggressive Säure, die sogar das Edelmetall Kupfer auflöst. Konzentrierte Salzsäure oder Schwefelsäure schaffen das nicht. Man sollte also denken, dass man Benzol nitrieren kann, wenn man konz. Salpetersäure in ein Becherglas mit Benzol gießt. Leider ist das nicht der Fall. Das Stickstoff-Atom in der Salpetersäure ist nämlich nicht elektrophil genug für eine solche Reaktion [1], obwohl es ja positiv geladen ist, wie man in Abbildung 1 sehen kann.
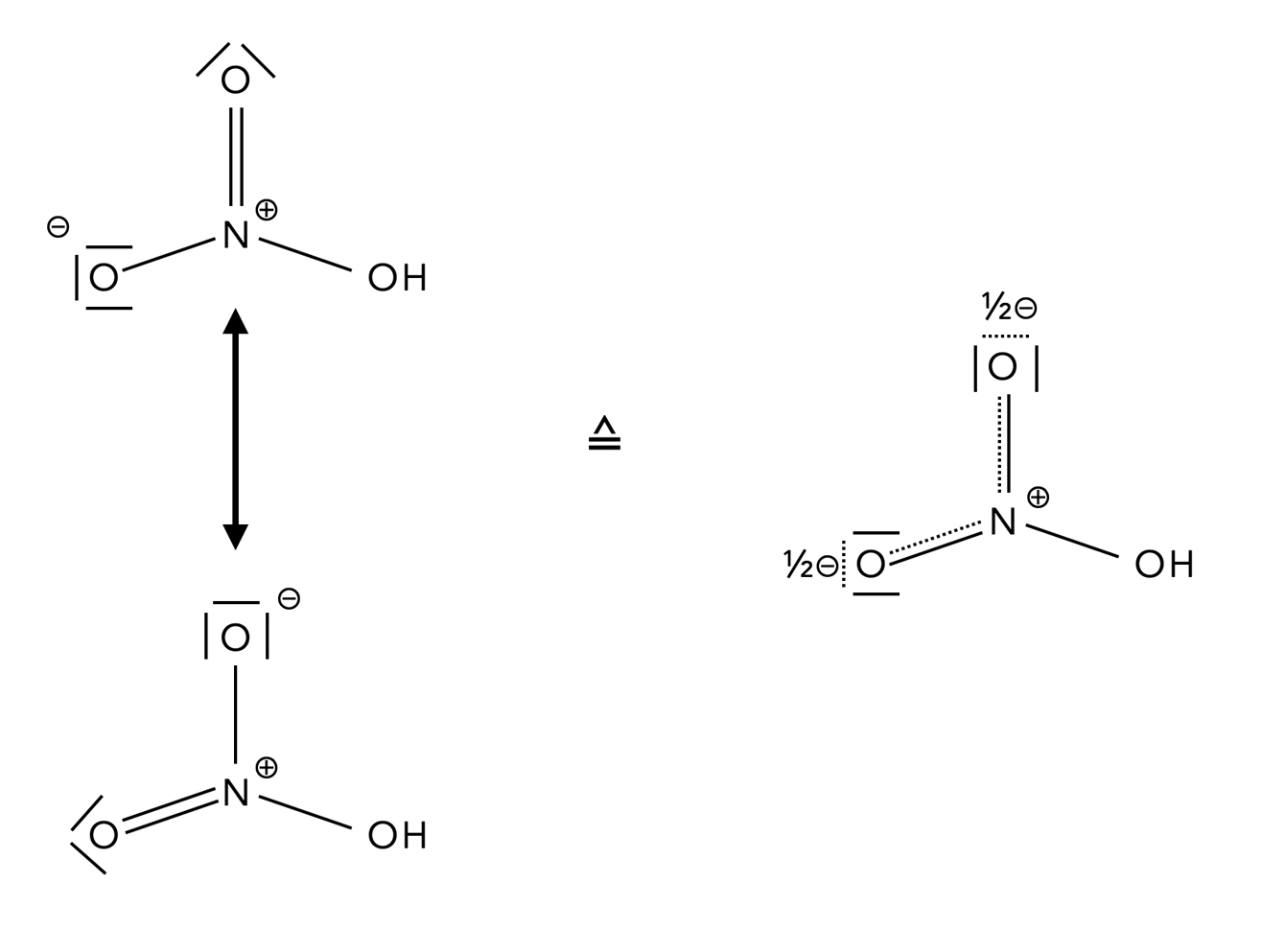
Das Salpetersäure-Molekül ist mesomerie-stabilisiert
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Für Experten
Manchmal sieht man das HNO3-Molekül mit zwei N=O-Doppelbindungen und ohne Ladungen. Das ist sachlich leider falsch, weil eine solche Darstellung die Oktettregel verletzt. Stickstoff ist ein Element der zweiten Periode und kann demnach maximal 8 Außenelektronen besitzen. Mit zwei N=O-Doppelbindung und der einen N-O-Einfachbindung hätte das N-Atom jedoch 10 Außenelektronen. Auch nach dem Orbitalmodell wäre ein solcher Zustand nicht denkbar, denn das N-Atom hat nur ein s- und drei p-Orbitale in der Außenschale. Der Phosphor, der im PSE unter dem Stickstoff steht, könnte mehr Außenelektronen besitzen, weil er zusätzlich noch fünf d-Orbitale besitzt. Nicht jedoch der Stickstoff.
Bei der Frage, warum konz. Salpetersäure nicht elektrophil genug ist für eine Benzol-Nitrierung, spielen eventuell sterische Effekte eine Rolle: Die drei Sauerstoff-Atome sind negativ polarisiert und der Benzolring hat eine hohe Elektronendichte, so dass das N-Atom es nicht leicht hat, an den Benzolring anzudocken.
Für die Benzol-Nitrierung benögt man eine spezielle Säure, die Nitriersäure. Das ist eine Mischung aus konz. Salpetersäure und konz. Schwefelsäure.
Schritt 1:
Bildung des Nitronium-Ions
Wenn man das Wort "Säure" hört und ein wenig Ahnung von Chemie hat, denkt man sofort: Protonen-Donator. Normalerweise geben Säuren ein oder mehrere Protonen an einen Protonen-Akzeptor (Base) ab.
Nun gibt es aber unterschiedlich starke Säuren. Salpetersäure beispielsweise ist eine recht starke Säure, Essigsäure dagegen eine eher schwache Säure. Starke Säuren geben ihre Protonen viel leichter ab als schwache Säuren.
Schwefelsäure ist eine noch stärkere Säure als Salpetersäure, gibt ihr Proton also noch leichter ab. Und daher passiert jetzt etwas ganz Ungewöhnliches: Die Schwefelsäure gibt ein Proton an die Salpetersäure ab:
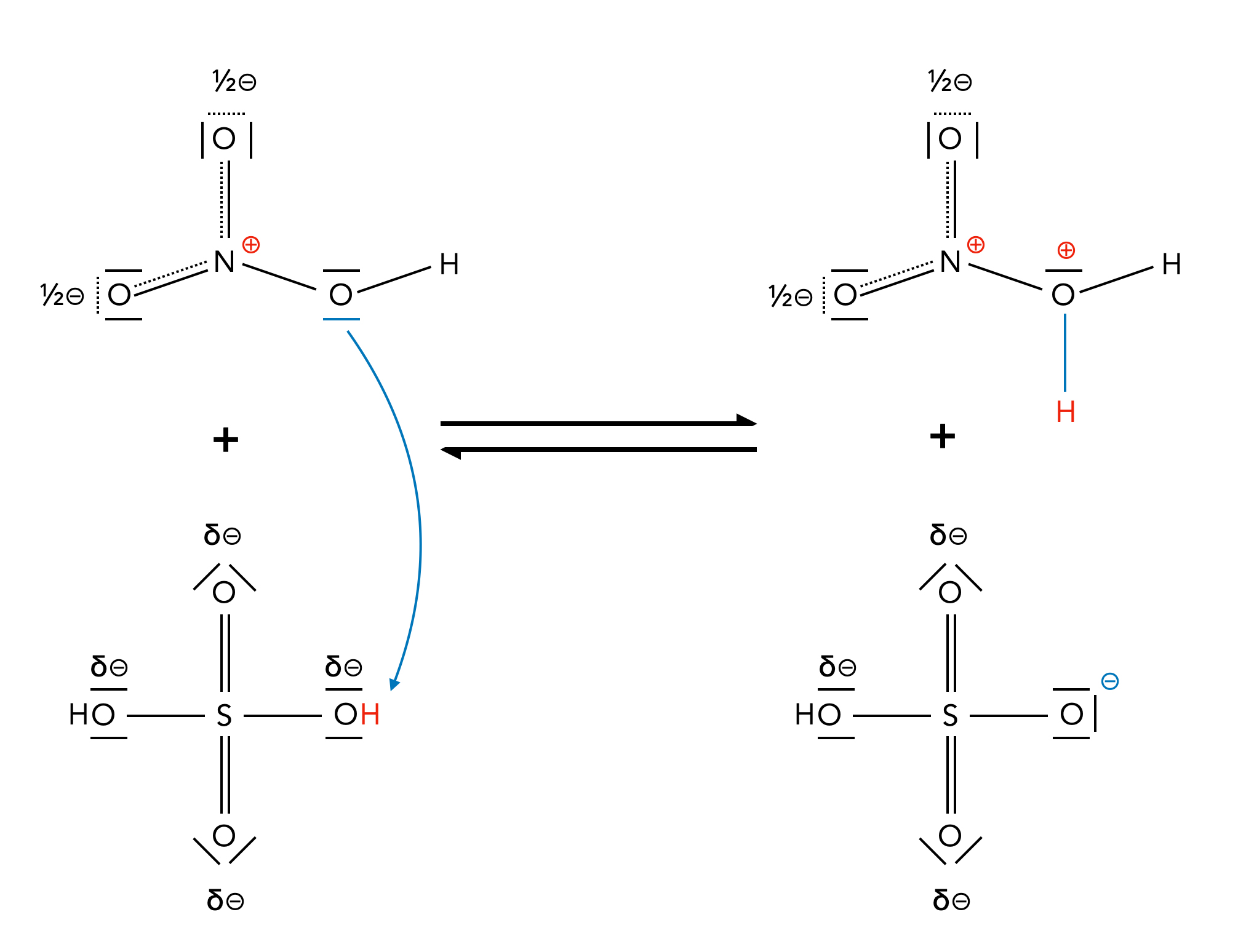
Salpetersäure als Base
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das Salpetersäure-Molekül HNO3 wirkt hier als Base! Allerdings ist das Reaktionsprodukt H2NO3+ recht instabil. Das N-Atom ist positiv geladen, und das benachbarte O-Atom ebenfalls. So eine Konstellation ist energetisch sehr ungünstig. Aber die Abhilfe kann man ja fast schon mit bloßem Auge erkennen: Abspaltung eines H2O-Moleküls:
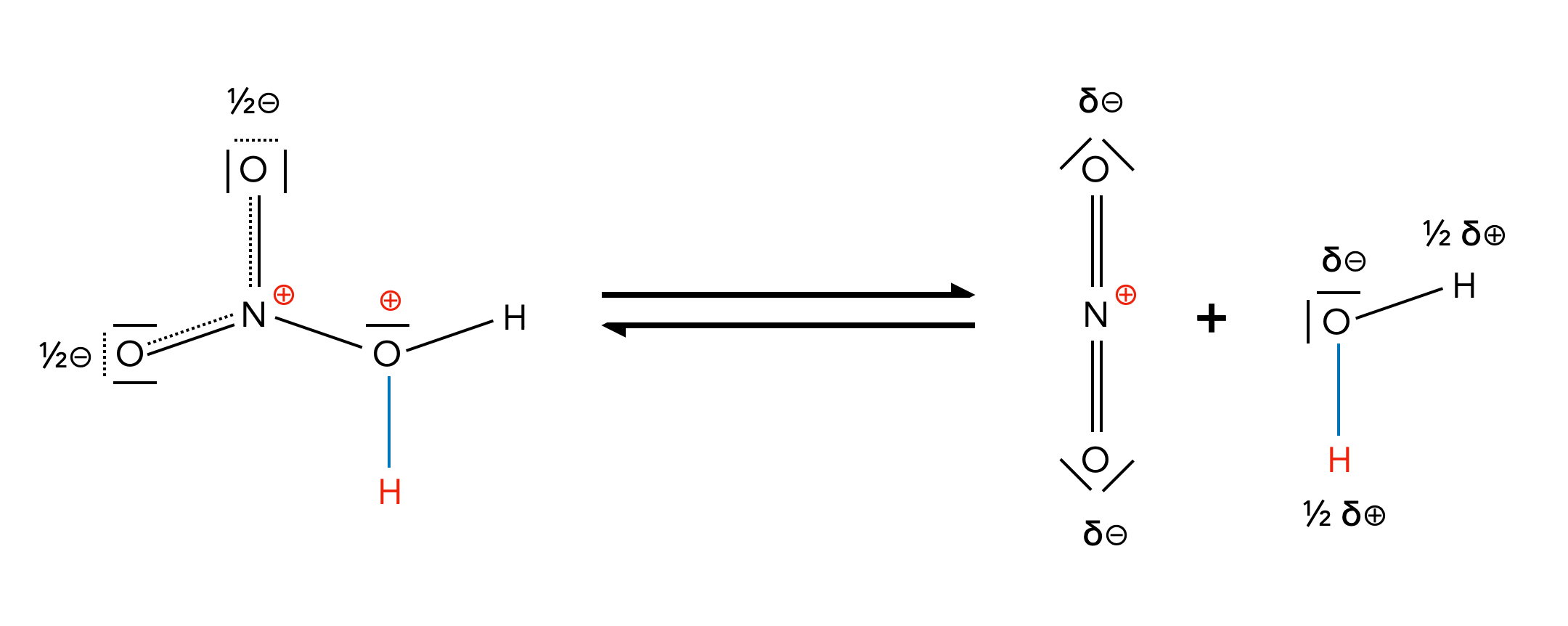
Bildung des Nitronium-Ions
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Für Experten:
Die Schreibweisen mit den halben negativen Ladungen bzw. Teilladungen mag zwar recht ungewöhnlich sein, trifft aber eigentlich den Kern der Sache ganz gut. Nach außen hin ist das HNO3-Molekül elektrisch neutral. In beiden Grenzstrukturen ist das N-Atom positiv geladen, und die beiden O-Atome der N=O-Doppelbindung sind gleichwertig. Also muss formal jedes dieser beiden O-Atome eine halbe negative Ladung tragen.
Das Gleiche gilt für das Wasser-Molekül. Nach außen hin elektrisch neutral, wird die negative Teilladung am O-Atom durch zwei positive Teilladungen an den beiden H-Atomen kompensiert. Jedes H-Atom trägt formal (und die Betonung liegt hier wirklich auf "formal") dann eine positive Teilladung, die nur halb so groß ist wie die negative Teilladung des O-Atoms.
Die konzentrierte Schwefelsäure ist stark hygroskopisch, d.h. Wasser anziehend. Durch die Entfernung des Wassers aus dem Medium wird das Gleichgewicht der obigen Reaktion stark nach rechts verschoben (Prinzip des kleinsten Zwangs).
Auf diese Weise entsteht das Nitronium-Ion NO2+, das man auch als O=N+=O schreiben kann, um deutlich zu machen, dass die positive Ladung am N-Atom sitzt und nicht am O-Atom.
Die Gesamtreaktion in der Nitriersäure kann also so formuliert werden:
$H_{2}SO_{4} + HNO_{3} \to HSO_{4}^{-} + NO_{2}^{+} + H_{2}O$
Schritt 2:
Bildung des pi- und sigma-Komplexes
Das Nitronium-Ion greift mit dem positiven N-Atom das Benzol-Molekül an. Es bildet sich ein π-Komplex als Übergangszustand, dann ein σ-Komplex als Zwischenprodukt.
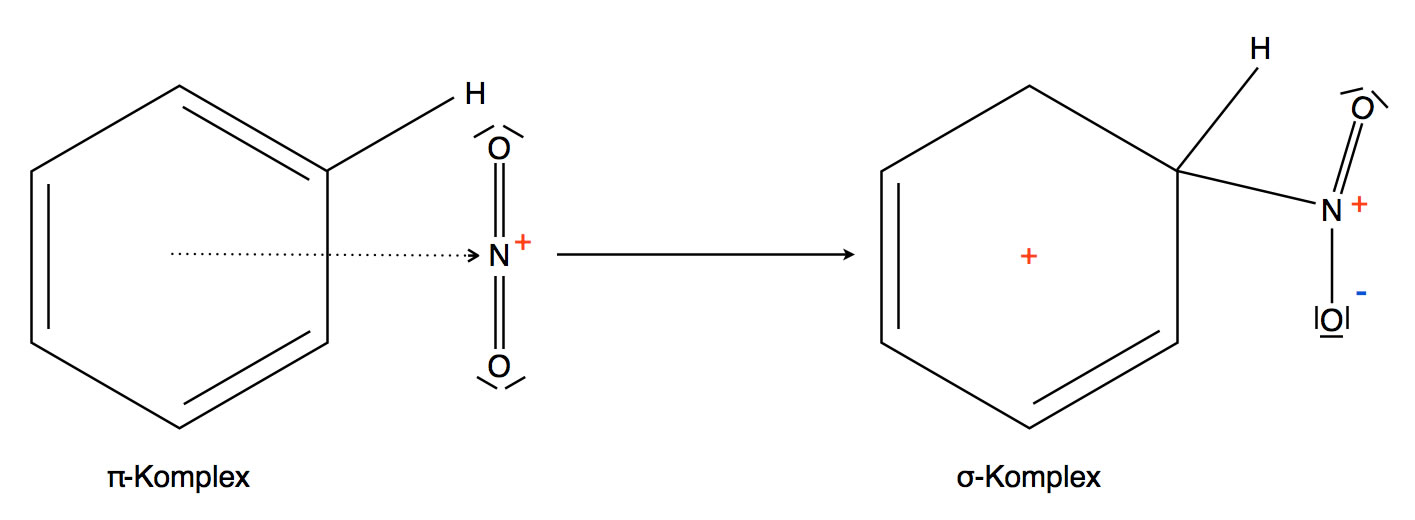
Aus dem π-Komplex wird der σ-Komplex
Was man jetzt auf der Abbildung nicht sieht, sind die Grenzstrukturen des σ-Komplexes. Es gibt insgesamt drei dieser Grenzstrukturen:
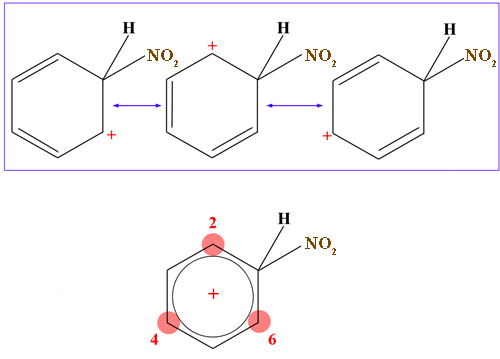
Die drei Grenzstrukturen des Sigma-Komplexes
An sich ist die positive Ladung des σ-Komplexes delokalisiert, das heißt aber nicht, dass jedes C-Atom die gleiche Elektronendichte besitzt. Bei den drei Grenzstrukturen des Sigma-Komplexes ist jeweils ein bestimmtes C-Atom positiv geladen. Das macht sich auch in der resultierenden Gesamtstruktur des Komplexes bemerkbar. Die drei im Bild rot gekennzeichneten C-Atome des Benzolrings sind positiv polarisiert, hier ist die Elektronendichte also geringer als an den drei anderen C-Atomen.
Und genau diese Tatsache macht diese drei C-Atome auch weniger gut angreifbar für elektrophile Teilchen. Im Augenblick ist das für Sie noch nicht so besonders wichtig, aber wenn wir später über die Zweitsubstitution reden, kommen wir darauf zurück.
Schritt 3:
Rückbildung des aromatischen Zustandes
Hier gibt es nicht mehr viel zu sagen. Wie bei der Bromierung von Benzol oder anderen Aromaten ist es energetisch günstiger, den aromatischen Zustand zurück zu bilden, indem ein Proton abgegeben wird. Für eine solche Re-Aromatisierung muss das H-Atom des sp3-hybridisierten C-Atoms mit der NO2-Gruppe abgegeben werden, dann kann aus dem sp3-hybridisierten C-Atom wieder ein sp2-hybridisiertes werden, und das entstandene pz-Orbital kann sich mit den anderen fünf pz-Orbitalen zu einem geschlossenen Ringsystem mit sechs delokalisierten Elektronen vereinigen, das die Hückel-Regel erfüllt.
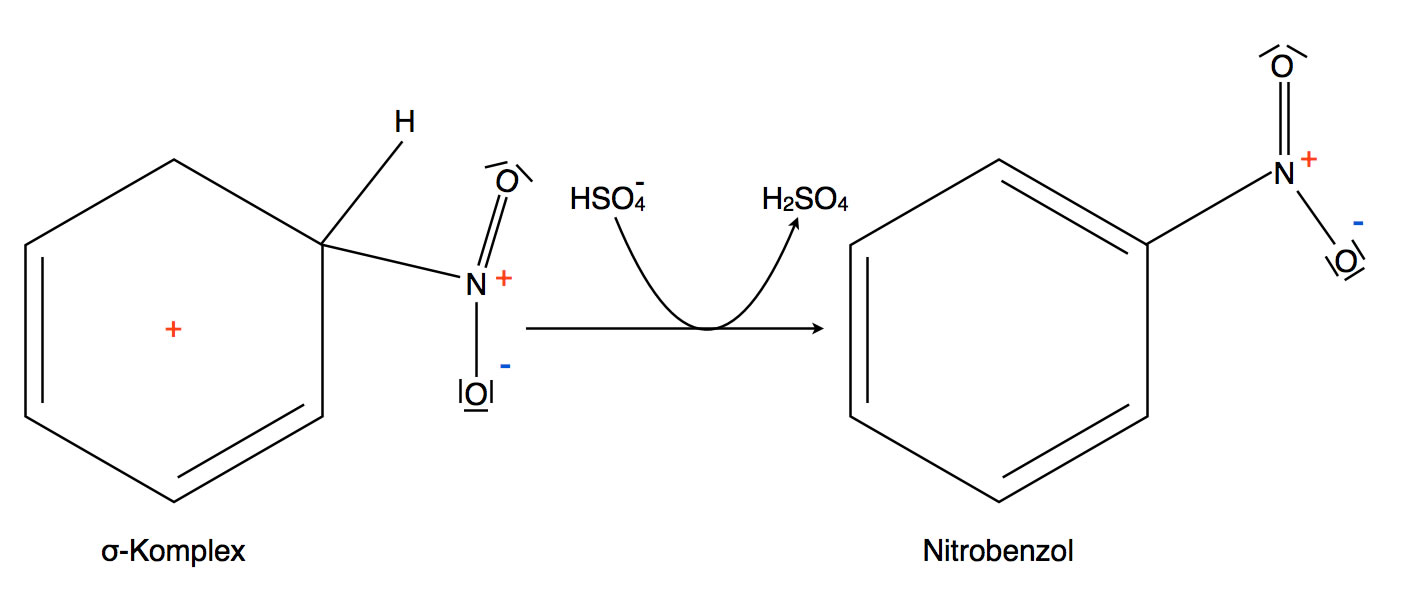
Rückbildung des aromatischen Zustandes
Das abgespaltene Proton muss an einen Protonen-Akzeptor - eine Base - abgegeben werden, und dafür steht das HSO4--Ion zur Verfügung, das ja von der konz. Schwefelsäure noch übrig ist. Wir stellen also fest, dass die konz. Schwefelsäure hier formal als Katalysator wirkt, in der Netto-Reaktionsgleichung taucht sie nämlich nicht auf.
Bedeutung der Nitrierung
Nitrobenzol ist eine wichtige Grundchemikalie der organischen Chemie, aus Nitrobenzol kann beispielsweise Anilin hergestellt werden.
Aus Toluol und Nitriersäure kann man TNT oder Trinitrotoluol herstellen, einen militärischen Sprengstoff, der auch heute noch verwendet wird (Granaten, Bomben, Minen). Aus Phenol und Nitriersäure kann man auf ähnliche Weise Pikrinsäure herstellen, in trockenem Zustand ebenfalls ein Sprengstoff, mit 30-50% Wasser angefeuchtet jedoch in der Regel harmlos. Interessanterweise wird Pikrinsäure nicht direkt durch Nitrierung von Phenol hergestellt, sondern das Phenol wird zunächst zweifach sulfoniert. Die beiden SO3-H-Gruppen werden erst in einem zweiten Schritt durch NO2-Gruppen ersetzt, und das so entstandene 2,4-Dinitrophenol kann dann zu 2,4,6-Trinitrophenol (TNP) bzw. Pikrinsäure nitriert werden.
Ein weiterer Sprengstoff kann durch Nitrierung von Glycerin hergestellt werden, das Nitroglycerin. Glycerin ist allerdings kein Aromat, daher findet auch keine elektrophile Substitution statt, und somit ist das Verfahren für diese Abteilung der Chemie-Seiten uninteressant.
Die Xanthoprotein-Reaktion
In der Abituraufgabe von 2015 kam diese spezielle Form der Nitrierung vor. Bei der sogenannten Xanthoprotein-Reaktion werden bestimmte aromatische Aminosäuren in einem Peptid oder Protein mit Salpetersäure behandelt und dadurch nitriert.

Nitrierung der Aminosäure Tyrosin
Yikrazuul, Public domain, via Wikimedia Commons
Bei den Aminosäuren, die dadurch nitriert werden, handelt es sich um Tyrosin und Phenylalanin. Das Reaktionsprodukt dieser Nitrierung ist gelb gefärbt, und darum eignet sich die Behandlung von Lebensmitteln mit Salpetersäure zum Nachweis von Proteinen. Wenn konz. Salpetersäure aus Versehen auf die menschliche Haut gelangt, verfärbt diese sich ebenfalls gelblich, wegen der vielen Proteine in den Zellen der Haut.
Quellen, die über allgemeines Schulbuchwissen hinausgehen:
- Vollhard, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Römpp Chemie-Lexikon, 9. Auflage 1992
