Vergleich Benzol - Cyclohexatrien
Aus dem Chemieunterricht der Stufe EF kennen Sie die Alkane und auch die Cycloalkane. Cyclohexan ist ein bekannter Vertreter der Cycloalkane: Sechs C-Atome haben sich zu einem Ring zusammengeschlossen, und jedes C-Atom trägt zwei H-Atome. Entfernen wir zwei H-Atome von zwei benachbarten C-Atomen, erhalten wir das Cyclohexen. Auch diese Verbindung ist aus der Stufe EF bekannt. Meistens benutzt sie der Chemielehrer, um zu demonstrieren, dass Alkene Bromwasser entfärben. Oder als Einführungsexperiment in die elektrophile Addition in der Stufe Q1.
Entfernen wir noch einmal zwei weitere H-Atome, erhalten wir einen Sechserring mit zwei C=C-Doppelbindungen, das Cyclohexadien. Diese Verbindung ist in Schulen schon nicht mehr so verbreitet.
Jetzt könnte man denken: Okay, entfernen wir noch zwei H-Atome, dann erhalten wir die Verbindung Cyclohexatrien mit drei C=C-Doppelbindungen. Moment mal, ist das nicht das Gleiche wie die Verbindung Benzol?
Tatsächlich hat es bisher noch kein Chemiker und auch keine Chemikerin geschafft, Cyclohexatrien herzustellen!
Jetzt sagen Sie bestimmt: Was soll das denn auch? Cyclohexatrien ist doch das selbe wie Benzol!
Ganz so stimmt diese Aussage leider nicht.
Chemische Eigenschaften
Vergleichen wir nun die chemischen Eigenschaften von Benzol und dem Cyclohexatrien, das noch keiner herstellen konnte.
Cyclohexen, ein Cycloalken aus sechs C-Atomen und einer C=C-Doppelbindung, entfärbt Bromwasser, geht also eine elektrophile Addition mit Br2 ein. Die elektrophile Addition ist typisch für die C=C-Doppelbindung. Cyclohexadien, also das Cycloalken mit sechs C-Aton und zwei C=C-Doppelbindungen, geht ebenfalls die elektrophile Addition ein.
Nun sollte man doch meinen, dass Cyclohexatrien mit einer dritten Doppelbindung sogar noch besser mit Brom reagiert als Cyclohexen oder Cyclohexadien.
Versetzt man Benzolmit Bromwasser, passiert zunächst überhaupt nichts. Keine Spur von Entfärbung, absolut keine Neigung zur elektrophilen Addition!
Hätte Benzol "richtige" C=C-Doppelbindungen, müsste es sofort mit Bromwasser reagieren. Die zwingende Schlussfolgerung: Die C=C-Doppelbindungen im Benzol-Molekül sind gar keine richtigen C=C-Doppelbindungen. Bereits auf der Benzol-Seite hatten wir ja schon eine Eigenart festgestellt: Die sechs Bindungen im Benzol-Molekül sind alle gleich lang. Offensichtlich gibt es im Benzol-Molekül weder "richtige" C-C-Einfachbindungen noch "richtige" C=C-Doppelbindungen.
Hydrierungsenthalpie
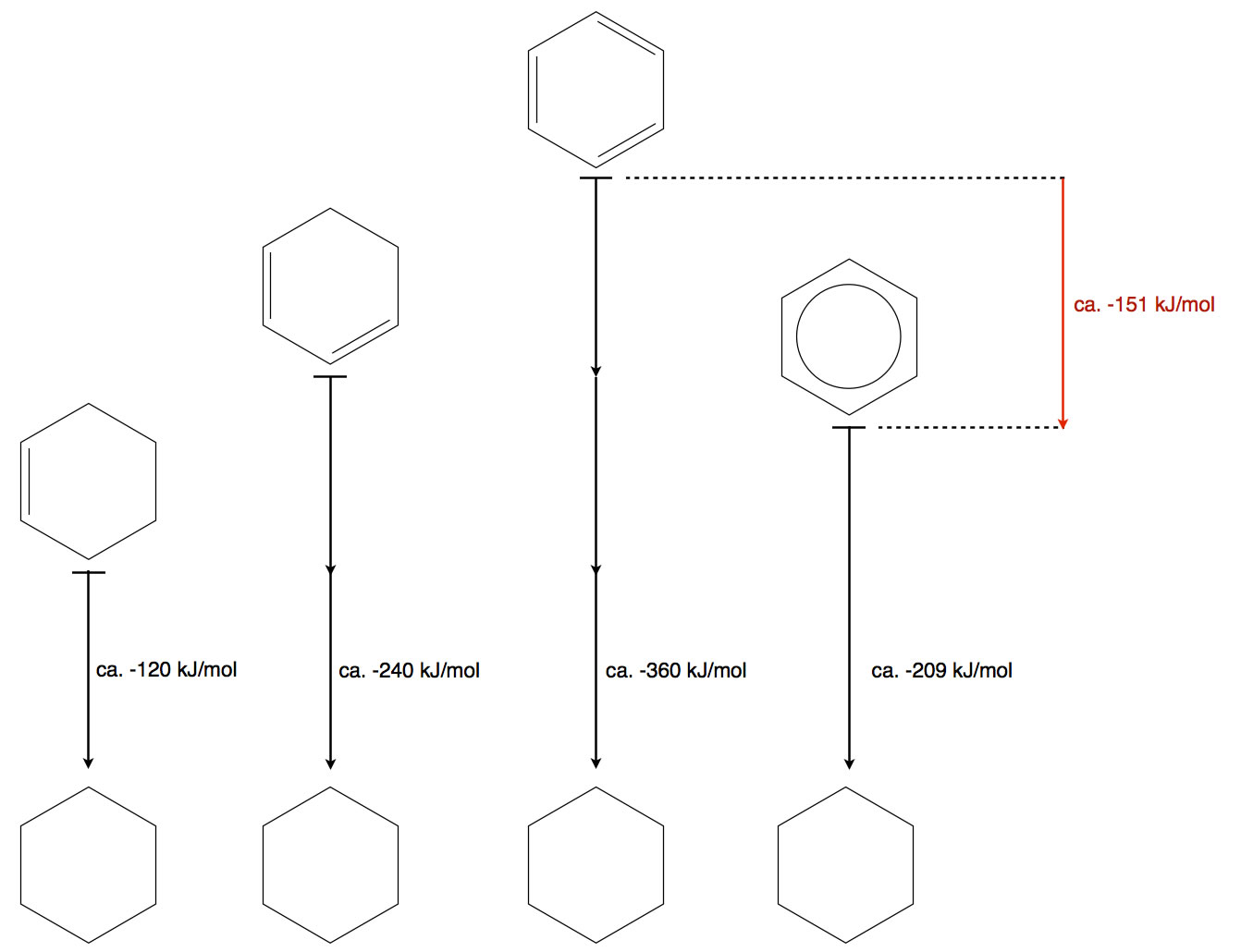
Wenn man Cyclohexen mit Wasserstoff reagieren lässt, entsteht Cyclohexan, das Additionsprodukt. Bei dieser exothermen Reaktion werden 119,7 kJ/mol an Energie freigesetzt, die Hydrierungsenthalpie. Führt man die gleiche Reaktion mit Cyclohexadien durch, erhält man 232,0 kJ/mol an Hydrierungsenthalpie, das ist ungefähr das Doppelte des Wertes von Cyclohexen.
Nun liegt die Vermutung nahe, dass man bei der Hydrierung von Cyclohexatrien das Dreifache von 120 kJ/mol erhalten würde, also ca. 340 bis 360 kJ/mol.
Wenn man Benzol hydriert, erhält man allerdings nur eine Hydrierungsenthalpie von 208,5 kJ/mol.[2] Das ist erheblich weniger als man für das Cyclohexatrien erwartet hätte, ca. 151 kJ/mol weniger sogar.
Hier eine der üblichen graphischen Darstellungen, wie man sie in fast jedem guten Schulbuch findet; das Bild habe ich natürlich selbst gezeichnet:
Offensichtlich ist Benzol "energetisch günstiger" als Cyclohexatrien und damit stabiler. Dies ist dann auch die Erklärung dafür, dass Benzol nicht so reaktiv ist wie Cyclohexatrien.
Für die Energiedifferenz von -151 kJ/mol, die in der Graphik rot eingezeichnet ist, gibt es sogar einen eigenen Namen: Resonanzenergie oder Mesomerieenergie.
Fassen wir unsere Erkenntnisse, die wir bisher gemacht haben, einmal zusammen:
Das Benzol-Molekül ist formal so aufgebaut wie ein Cyclohexatrien-Molekül. Allerdings sind alle Bindungen im Benzol-Molekül gleich lang, es gibt weder C-C-Einfach- noch C=C-Doppelbindungen. Das Benzol geht auch keine elektrophile Addition ein, und es ist wesentlich energieärmer und damit stabiler als ein hypothetisches Cyclohexatrien-Molekül, wie die Hydrierungsversuche zeigen.
Wichtigste Erkenntnis: Alle C-C - Bindungen im Benzol-Molekül sind gleichwertig, es sind weder Einfach- noch Doppelbindungen, und sie sind sehr stabil.
Oszillationshypothese von KEKULÉ:
Chemiker wie KEKULÉ machten sich bereits im 19. Jahrhundert Gedanken über die Molekülstruktur des Benzols und stellten sich die Frage, was wohl das Besondere am Benzol-Molekül ist. KEKULÉ führte jede Menge chemischer Versuche mit Benzol durch, die ihn zu der Erkenntnis führten, dass alle C-C-Bindungen im Benzol-Molekül gleichwertig sind. KEKULÉ stellte schließlich eine bahnbrechende Hypothese auf, die diese Gleichwertigkeit der Bindungen zu erklären versuchte
Oszillationshypothese: Die C=C-Doppelbindungen im Benzol-Molekül "klappen" mehrere Tausend Mal pro Sekunde um. Für eine kurze Zeit liegt jede C-C-Bindung als Einfachbindung vor, dann wieder als Doppelbindung.
Diese kühne Hypothese machen wir uns durch eine Abbildung klar:
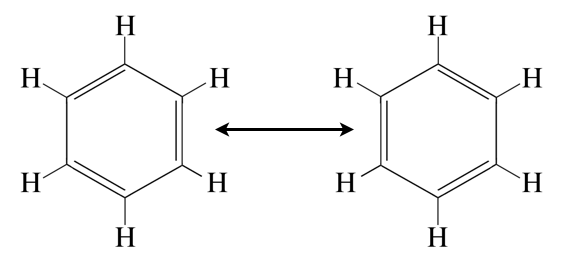
Genau so stellte man sich nach der Oszillationshypothese von 1872 die Benzolstruktur vor. Demnach "klappen" die Doppelbindungen mehrere 100 oder gar 1000 mal pro Sekunde um. Eine faszinierende Erklärung, die von den meisten Leuten sofort verstanden wurde.
Leider ist diese Hypothese falsch. Die Doppelbindungen klappen nicht um, sondern - wie man heute weiß - ist jede C-C-Bindung im Benzol-Molekül tatsächlich zur Hälfte eine Einfachbindung und zur Hälfte eine Doppelbindung. Näheres erfahren Sie auf der Lexikon-Seite zur Mesomerie, die Ende 2019 aktualisiert wurde.
Mesomerie kann man mit dem in der Schule gebrächlichen Kugelwolkenmodell natürlich nicht erklären. Es wird langsam Zeit, dass wir uns an ein leistungsfähigeres Atommodell gewöhnen.
Sie müssen nicht das gesamte Orbitalmodell beherrschen, es reicht, wenn Sie die verschiedenen Hybridisierungszustände des C-Atoms kennen.
- Falls Sie das Orbitalmodell noch gar nicht kennen, gehen Sie bitte auf die Index-Seite zum Orbitalmodell.
- Wenn Sie sich über Hybridisierung allgemein informieren möchten, können Sie auf die Seite zur Hybridisierung gehen.
- Wollen Sie sich gezielt über das C-Atom im Orbitalmodell informieren, können Sie auch gleich auf die Seite "Das C-Atom im Orbitalmodell" gehen. Alternativ können Sie sich das Arbeitsblatt "Modelle des C-Atoms" herunterladen und durcharbeiten, auf dem alles schülergerecht (ich hoffe zumindest) erklärt ist.
Für Experten:
Der aromatische Zustand des Benzol-Moleküls
Alle sechs C-Atome des Benzols sind sp2-hybridisiert, und die sechs pz-Orbitale sind parallel ausgerichtet, so dass sie sich (leicht) überlappen können. So entsteht ein gemeinsames ringförmiges Molekülorbital, in dem sich die sechs pi-Elektronen frei bewegen können, sowohl oberhalb wie auch unterhalb der Ringebene.
All das habe ich aber besser auf meiner fünften Seite zum Orbitalmodell ausgeführt, "Das Benzol-Molekül", die Sie sich jetzt unbedingt anschauen sollten.
Nicht nur Benzol gehört zu den Aromaten, auch alle Verbindungen, die sich direkt vom Benzol ableiten, zum Beispiel Phenol, Nitrobenzol oder Anilin. Aber auch viele andere organische Verbindungen, die dem Benzol überhaupt nicht ähneln, sind aromatisch. Wann genau eine Verbindung zu den Aromaten gehört, hat der Chemiker Erich Hückel (1896-1980) um 1930 festgelegt. Siehe dazu die nächste Seite "Die Hückel-Regel".