Da diese Seite recht lang und umfangreich ist, habe ich eine kleine Inhaltsübersicht an den Anfang gesetzt, damit Sie gezielt zu den Abschnitten springen können, die Sie interessieren.
1. Propen
Das nächsthöhere Alken nach Ethen ist das Propen, ein Propan-Molekül mit einer C=C-Doppelbindung:
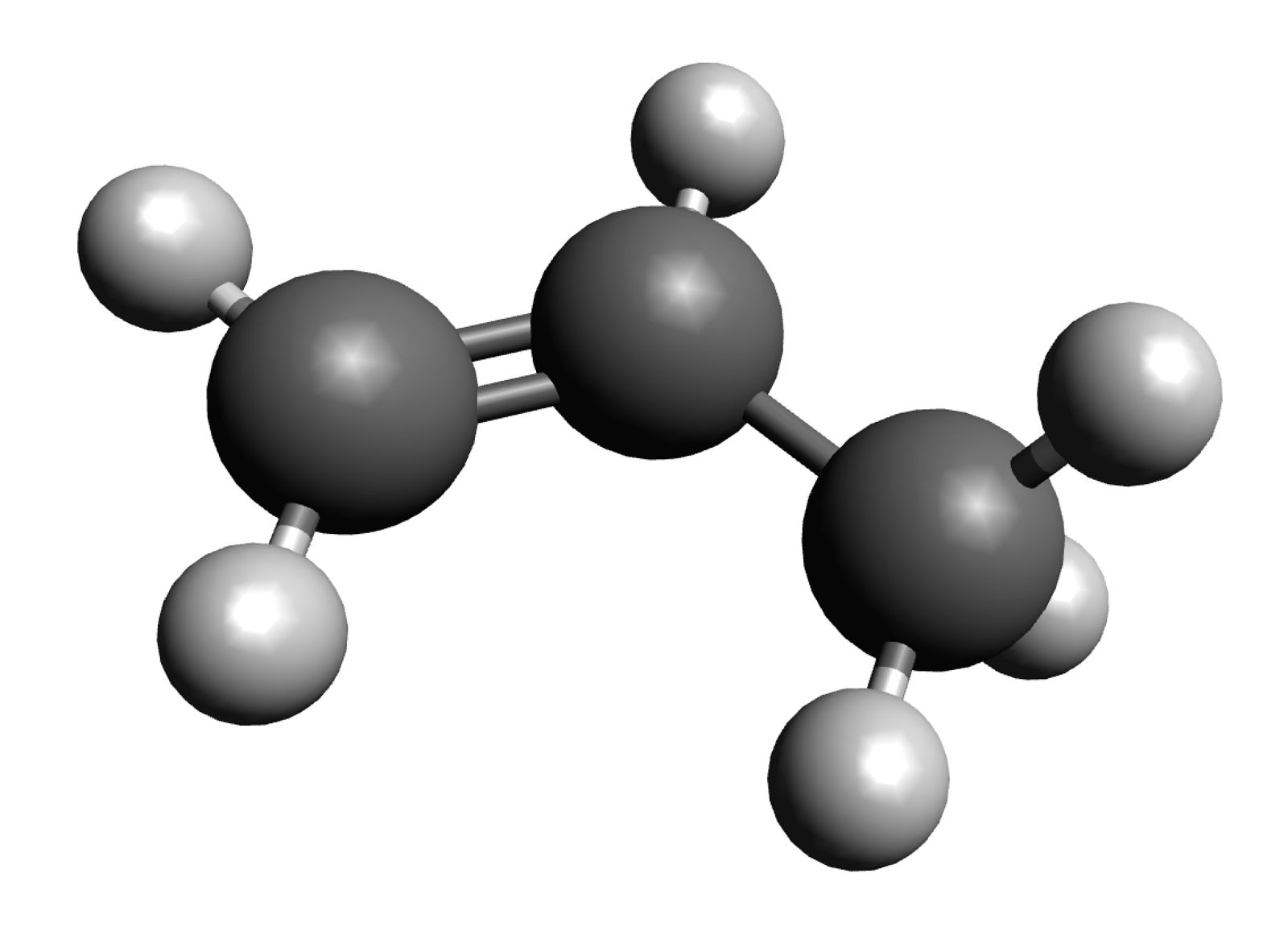
Das Propen-Molekül
Autor: Ulrich Helmich 2023, Lizenz: Lizenz: Public domain.
Propen ist ein farbloses, brennbares Gas, das man durch thermisches Cracken von Leichtbenzin erhält. Leichtbenzin ist eine der Erdölfraktionen, wird also bei der raffinierten Destillation von Rohöl gewonnen. Die physikalischen Eigenschaften ähneln denen des Propans, die chemischen Eigenschaften allerdings nicht. Genau so wie Ethen neigt auch Propen zur elektrophilen Addition und zur Polymerisation.
Für den Unterricht in der Sek. II ist es eigentlich nicht notwendig, sich intensiver mit dem Gas Propen zu beschäftigen. Wer aber trotzdem weitere Einzelheiten zum Propen nachlesen möchte, geht am besten auf den entsprechenden Wikipedia-Artikel, die Seite von Thomas Seilnacht oder den Eintrag im Spektrum-Lexikon der Chemie.
2. Höhere Alkene ↑
2.1 Physikalische Eigenschaften
Im Grunde haben die Alkene ähnliche physikalische Eigenschaften wie die entsprechenden Alkane. Beide Stoffgruppen haben sehr niedrige Schmelz- und Siedetemperaturen sowie geringe Dichten. Die gemeinsame Ursache hierfür sind die sehr schwachen intermolekularen Bindungen, die ausschließlich durch die London-Kräfte verursacht werden.
Sowohl Alkane wie auch Alkene sind nahezu unlöslich in Wasser. Die umgebenden Wasser-Moleküle schließen sich zu größeren Strukturen zusammen, verantwortlich hierfür sind die relativ starken Wasserstoffbrücken-Bindungen zwischen den Wasser-Molekülen. Die Alkan- und Alken-Moleküle können an diesen Strukturen nicht teilhaben und bleiben daher unter sich (siehe: hydrophober Effekt).
2.2 Chemische Eigenschaften
Die chemischen Eigenschaften der Alkene ähneln sich: Alle Alkene neigen zur Elektrophilen Addition , zur Radikalischen Addition und zur Polymerbildung, wenn sich ein Alken an ein anderes addiert und sich weitere Alken-Moleküle anlagern.
➥Radikalische Addition
Auf diesen Seiten auf meiner Homepage finden Sie viele Informationen zu diesen beiden Reaktionstypen.
Zwei wichtige Reaktion sollten noch erwähnt werden:
Oxidation
Ähnlich wie Alkane lassen sich auch die Alkene sehr leicht oxidieren, wobei Wasser und Kohlendioxid entstehen.
Radikalische Substitution
Ein längeres Alken wie beispielsweise 2-Penten hat ja nicht nur die C=C-Doppelbindung, die für die Additionsreaktion verantwortlich ist, sondern auch noch einige CH3- und -CH2-Gruppen. Diese können natürlich eine radikalische Substitution eingehen, ähnlich wie die Alkane.
3. Die drei Arten der Isomerie ↑
Betrachten wir die Strukturformeln der vier Buten-Isomere:

Die vier Isomere des Butens
Autor: Ulrich Helmich 2022, Lizenz: ---
Fall 1: But-1-en und Isobuten
Hier handelt es sich um eine Konstitutions-Isomerie. Die Moleküle der beiden Verbindungen haben einen grundsätzlich unterschiedlichen Aufbau (Konstitution). Das But-1-en besteht aus einer Kette von vier C-Atomen mit einer Doppelbindungen zwischen den C-Atomen 1 und 2, während das Isobuten eine Kette aus drei C-Atomen bildet mit einer CH3-Gruppe am zweiten C-Atom. Die Doppelbindung befindet sich zwischen den C-Atomen 1 und 2.
Fall 2: But-1-en und die beiden But-2-ene
Die beiden Butene haben das gleiche Grundgerüst und somit die gleiche Konstitution, allerdings unterscheiden sie sich in der Stellung der C=C-Doppelbindung. Beim But-1-en befindet sie sich zwischen den C-Atomen 1 und 2, beim But-2-en zwischen den C-Atomen 2 und 3. Man spricht hier auch von einer Bindungs-Isomerie.
Fall 3: cis-But-2-en und trans-But-2-en
Die Konstitution ist hier identisch, und auch die Stellung der C=C-Doppelbindung. Aber trotzdem unterscheiden sich die beiden Isomere, und zwar in der räumlichen Anordnung der beiden Methyl-Gruppen. Beim cis-Isomer befinden sich die beiden CH3-Gruppen auf der gleichen Seite der Doppelbindung (in der Abbildung zeigen beide Gruppen nach unten). Beim trans-Isomer befinden sich die beiden Methyl-Gruppen dagegen auf entgegengesetzten Seiten der Doppelbindung (oben / unten).
Die sogenannte cis/trans-Isomerie ist ein wichtiger Spezialfall der Stereo-Isomerie. Stereo-Isomere unterscheiden sich nicht in der Konstitution oder der Position von funktionellen Gruppen, sondern lediglich in der räumlichen Orientierung bestimmter Atome oder Atomgruppen. Ein anderer bekannter Spezialfall der Stereo-Isomerie ist die Spiegelbild-Isomerie, bei der sich die beiden Isomere wie Bild und Spiegelbild verhalten. Dies ist aber bei den Butenen nicht der Fall.
Auf dieser Folgeseite wird näher auf die cis-trans-Isomerie eingegangen.
Dies ist die Einstiegsseite in das große Thema der Isomerie im Chemie-Lexikon. Von dort aus gelangen Sie auf die Spezielseiten für die einzelnen Isomerie-Typen.
Auf dieser Lexikonseite erfahren Sie weitere Einzelheiten nicht nur über die einfache cis/trans-Isomerie, sondern auch über die wesentlich leistungsfähigere Z/E-Isomerie.
4. Nomenklatur verzweigter Alkene ↑
Genau wie bei den Alkanen gibt es auch verzweigte Alkene; das Isobuten haben wir eben ja bereits kennengelernt, es ist das einfachste verzweigte Alken. Schauen wir uns nun einmal zwei verzweigte Heptene an:
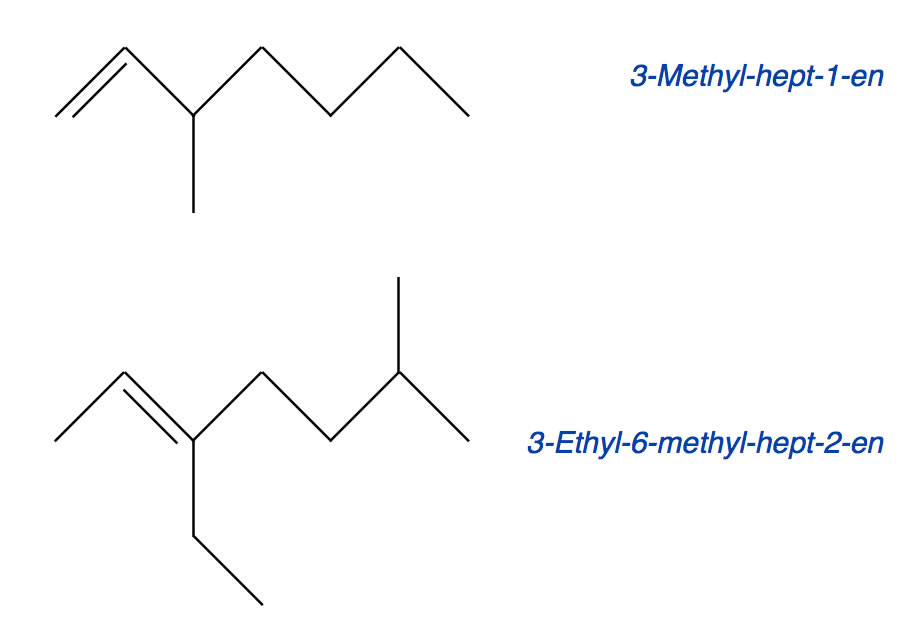
Zwei verzweigte Alkene
Autor: Ulrich Helmich 2018, Lizenz: Lizenz: CC BY-NC-SA 4.0
Das obere Alken ist ein Hepten, das als 3-Methyl-hept-1-en bezeichnet wird. Die längste durchgehende Kohlenstoffkette beseht aus sieben C-Atomen, daher handelt es sich um ein Hepten. Die C=C-Doppelbindung befindet sich zwischen dem 1. und dem 2. C-Atom, also liegt ein Hept-1-en vor. Am 3. C-Atom sitzt ein Methyl-Rest, daher haben wir es hier mit dem 3-Methyl-hept-1-en zu tun.
Auf analoge Weise kommt man bei dem unteren Alken zu dem Namen 3-Ethyl-6-methyl-hept-2-en. Die Doppelbindung hat Vorrang bei der Namensgebung, daher kommt der Name 5-Ethyl-2-methyl-hept-5-en nicht in Frage; die Position der Doppelbindung muss immer eine möglichst keine Ziffer bekommen.
Betrachten wir nun ein weiteres Alken:
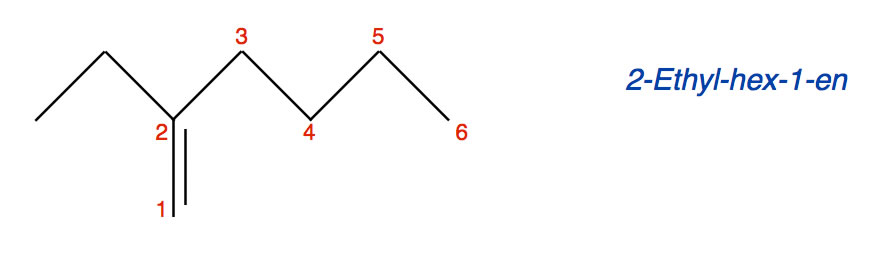
Ein komplizierteres Alken
Autor: Ulrich Helmich 2018, Lizenz: Lizenz: CC BY-NC-SA 4.0
Wenn man hier die längste durchgehende Kohlenstoffkette sucht, kommt man auf sieben C-Atome. Trotzdem ist der Stammname dieser Verbindung nicht "-hepten", sondern "-hexen". Wie kann man das erklären?
Bei verzweigten Alkenen gilt die Regel, dass die Kohlenstoffkette Priorität hat, in der die C=C-Doppelbindung vorkommt, auch wenn sie kürzer ist als die längste Kohlenstoffkette im Molekül. Genau das ist beim oberen Beispiel der Fall. Die Verbindung hat den Namen 2-Ethyl-hex-1-en.
In der Abteilung "Studienvorbereitung OC" findet sich im Abschnitt "Alkene" eine Spezialseite zur Nomenklatur. Wer von Ihnen überlegt, ob er oder sie Chemie, Biologie, Pharmazie oder Medizin studieren möchte, sollte sich diese Seite einmal näher ansehen.
Seitenanfang -
Allgemeines -
Ethen -
höhere Alkene -
cis/trans-Isomerie -
Darstellung -
Dimere -
Polymere -
Abitur