Die cis/trans-Isomerie der Alkene und Cycloalkane ist eine Art der Stereoisomerie, bei der sich die Isomere nicht wie Bild und Spiegelbild verhalten. Die cis-trans-Isomerie ist daher eine Form der Diastereomerie.

Hier sehen wir zwei 2-Buten-Moleküle, links in der cis-Konfiguration und rechts in der trans-Konfiguration. Beide Konfigurationen unterscheiden sich nur in der räumlichen Stellung der beiden Methyl-Gruppen. Bei der cis-Konfiguration stehen die beiden Gruppen auf der gleichen Seite der Referenzebene (hier: der Doppelbindung), und bei der trans-Konfiguration stehen die beiden Methyl-Gruppen auf entgegengesetzten Seiten der Referenzebene.
Beide Isomere haben unterschiedliche chemische und physikalische Eigenschaften. So hat die cis-Form einen Schmelzpunkt von -138,9 ºC, die trans-Form einen Schmelzpunkt von -105,5 ºC. Die Siedepunkte liegen dagegen nur um ca. 3 ºC auseinander (Einzelheiten siehe: Butene).
Erklären kann man die unterschiedlichen physikalischen Eigenschaften leicht mit dem Dipolcharakter der beiden Moleküle. Die Methyl-Gruppen haben einen induktiven Effekt, "schieben" also Elektronen zur Doppelbindung hin. Im cis-Isomer verstärkt sich dieser Effekt der Methyl-Gruppen, im trans-Isomer kompensiert sich der Effekt, daher ist das cis-Isomer ein stärkerer Dipol als das trans-Isomer.

Hier sehen wir ein cis/trans-Isomerie bei einem Cycloalkan. Die Referenzebene ist hier der Ring. Bei der cis-Konfiguration befinden sich beide Substituenten auf der gleichen Seite der Ringebene, bei der trans-Konfiguration auf gegenüberliegenden Seiten.
Die Z/E-Terminologie
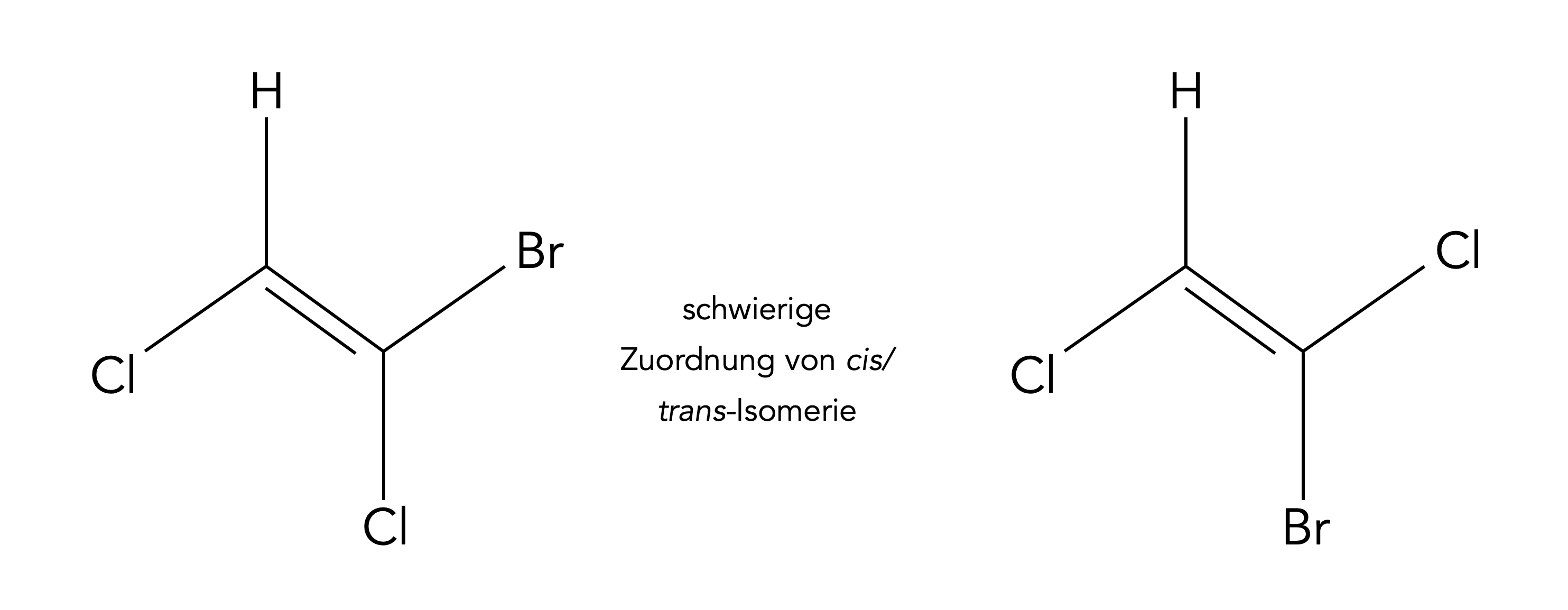
Neben den Begriffen cis/trans hat sich in letzter Zeit die Z/E-Terminologie etabliert. Dabei bedeutet Z = "zusammen", also auf der gleichen Seite liegend, und E = "entfernt", also auf der gegenüberliegenden Seite der Referenzebene liegend. Somit könnte man Z mit cis gleichsetzen und E mit trans.
Schwierig wird es allerdings, wenn es sich um unterschiedliche Substituenten handelt, wie in dem oben abgebildeten Fall um Chlor- und Brom-Atome.
Die linke Verbindung heißt nach der alten Terminologie cis-Brom-dichlorethen, weil die beiden Chlor-Atome auf der gleichen Seite der Doppelbindung liegen. Nach der neuen Z/E-Terminologie spricht man jedoch nicht von Z-Brom-dichlorethen, sondern von E-Brom-dichlorethen.
Das liegt daran, dass die beiden Substituenten nicht die gleiche Priorität (Rangordnung) besitzen. So hat Chlor eine höhere Priorität als Wasserstoff, aber eine niedrigere Priorität als Brom. Es gilt also Br > Cl > H.
Beim E-Brom-dichlorethen liegen die Substituenten mit der höheren Rangordnung auf gegenüberliegenden Seiten der Doppelbindung, daher ist hier die Bezeichnung "E" = "entfernt" gerechtfertigt. Beim Z-Brom-dichlorethen dagegen liegen die Substituenten mit der höheren Rangordnung auf der gleichen Seite der Doppelbindung, daher ist hier die Bezeichnung "Z" = "zusammen" gerechtfertigt.
Wir sehen also, dass die Nomenklatur von cis/trans- bzw. Z/E-Isomeren nicht so ganz einfach ist, vor allem, wenn die Substituenten unterschiedliche Priorität besitzen.