Addition von Alkenen
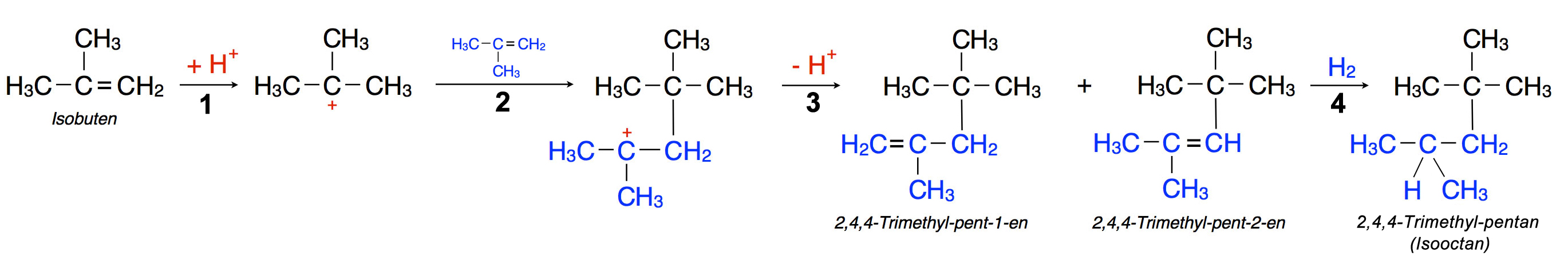
Die Hauptreaktion der Alkene ist die Elektrophile Addition. Weil die C=C-Doppelbindung insgesamt vier Bindungselektronen besitzt, ist dort die Elektronendichte besonders hoch. Das zieht natürlich elektrophile Teilchen an, zum Beispiel Protonen. Bei der Addition von Bromwasserstoff HBr spaltet sich das HBr-Molekül heterolytisch, und das Proton addiert sich an eines der beiden C-Atome der C=C-Doppelbindung. Dabei gilt die Regel von Markownikow, nach der sich das Proton stets so an die Doppelbindung setzt, dass das stabilere Carbenium-Ion entsteht.
Carbenium-Ionen sind ebenfalls Elektrophile
Nun ist ein Carbenium-Ion positiv geladen. Das heißt, ein Carbenium-Ion ist ebenfalls ein elektrophiles Teilchen, ein sehr starkes sogar. Auf der Suche nach Elektronen kann sich ein Carbenium-Ion an eine C=C-Doppelbindung anlagern, die ja zwei locker gebundene pi-Elektronen besitzt.
- Das schwarz gezeichnete Isobuten-Molekül wird protoniert (die Reaktion läuft unter Säure-Katalyse ab), es bildet sich ein Carbenium-Ion.
- Das Carbenium-Ion reagiert als Elektrophil mit der C=C-Doppelbindung eines zweiten Isobuten-Moleküls (blau). Es bildet sich ein neues, doppelt so großes Carbenium-Ion.
- Durch Abspaltung eines Protons entstehen die beiden Verbindungen 2,4,4-Trimethyl-pent-1-en und 2,2,4-Trimethyl-pent-2-en. Einen solchen Zusammenschluss von zwei Molekülen bezeichnet man auch als Dimerisierung; ein Dimer ist ein Gebilde, das aus zwei Molekülen besteht.
- Durch Hydrierung der beiden Reaktionsprodukte entsteht das gewünschte Isooctan, wichtiger Treibstoffzusatz für Benzin.
Weitere Einzelheiten finden Sie auf den Seiten zur Studienvorbereitung Organik.