Polyethen (PE)
Alkene können nicht nur dimerisieren (siehe "Dimerisierung von Alkenen"), sondern auch polymerisieren. Allerdings ist der Mechanismus, nach dem Alkene Polymere bilden, meistens kein kationischer (elektrophile Addition), sondern ein radikalischer.
Das einfachste Polymer auf Alkenbasis ist sicherlich das Polyethen (PE), früher auch als Polyethylen bezeichnet. Da Ethen bei Zimmertemperatur gasförmig ist, ist die Herstellung von PE gar nicht so einfach und wurde erst 1933 zum ersten Mal durchgeführt (entdeckt wurde Polyethen schon 1898 von Hans von Pechmann). Komplexere Alkene, die bei Zimmertemperatur flüssig sind, lassen sich viel leichter polymerisieren. Das Polystyrol wurde beispielsweise schon drei Jahre vorher synthetisiert.
Der radikalische Reaktionsmechanismus
Ein radikalisches Startermolekül, das dem Ethen hinzugefügt werden muss, lagert sich an ein Ethen-Molekül an.
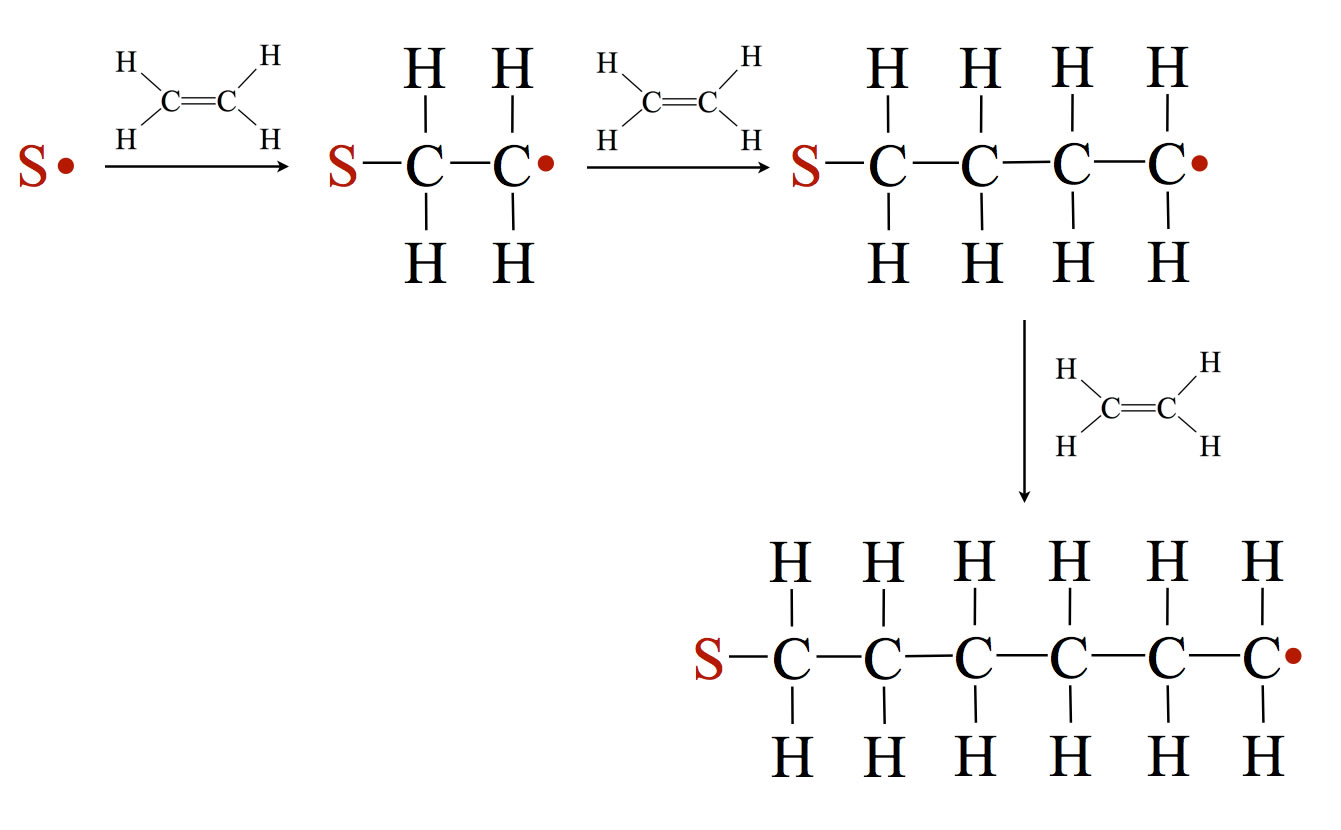
Reaktionsmechanismus der Polymerisierung von Ethen
Startermoleküle sind Radikale, die man durch thermische oder photolytische Spaltung bestimmter organischer Verbindungen gewinnt. Peroxide sind hier besonders beliebte Starterverbindungen. Durch Spaltung eines solchen Starters erhält man zwei Starter-Radikale S*.
Die Doppelbindung wird dabei "aufgeklappt", das eine Elektron der pi-Bindung paart sich mit dem einsamen Elektron des Starter-Radikals, und das andere Elektron der pi-Bindung - ja, das bleibt erst mal für sich allein. Das heißt, aus dem Ethen-Molekül ist ein Ethyl-Radikal geworden, das mit dem Starter verbunden ist. Dieses Ethyl-Radikal lagert sich an ein zweites Ethen-Molekül. Auch hier "klappt" die Doppelbindung auf, das eine Pi-Elektron paart sich mit dem einsamen Elektron des Ethyl-Radikals, und das andere Pi-Elektron bleibt zunächst ungepaart. Es ist jetzt ein Butyl-Radikal entstanden. Und so geht das weiter, bis sich ein langes Polymer aus vielen Tausend (bis zu 10.000) Ethen-Molekülen gebildet hat.
Zu den Eigenschaften von Polyethen siehe meine Seite "Polyethen" in der Abteilung Kunststoffe sowie den entsprechenden Wikipedia-Artikel.
Polypropen (PP) und Polybuten (PB)
Die Polymerisation von Propen und n-Buten funktioniert im Prinzip nach dem gleichen radikalischen Kettenmechanismus wie beim Ethen. Allerdings ist das Propyl-Radikal durch die Methylgruppe stabilisiert. Diese übt einen +I-Effekt auf das radikalische C-Atom aus, so dass dort die Elektronendichte etwas erhöht wird, was wiederum den radikalischen Charakter etwas abschwächt. Eine Polypropen-Synthese über radikalische Polymerisation ist daher nicht so ganz einfach, längere Polypropen-Moleküle kann man so nicht gewinnen. Außerdem sind die Methylgruppen der Polymerkette unregelmäßig angeordnet und nicht schön einheitlich zur gleichen Seite ausgerichtet, was die Materialeigenschaften des Kunststoffs beeinträchtigt.
Mit diesem chemischen Verfahren kann man Polyethen, -propen und -buten bei niedrigeren Temperaturen gezielt herstellen. Eingesetzt wird dazu ein spezieller Katalysator, der Ziegler-Natta-Katalysator. Gegenüber der radikalischen Polymerisation hat das Ziegler-Natta-Verfahren mehrere Vorteile. Mehr darüber erfahren Sie auf dieser Seite.
Polypropen wurde erstmals 1954 synthetisiert. Nach Polyethen ist Polypropen der zweithäufigste produzierte Kunststoff weltweit. Übrigens werden zwei Drittel des weltweit hergestellten Propens für die Synthese von Polypropen verwendet.
Polybuten (PB) hat ähnliche Eigenschaften wie Polyethen und Polypropen. Einzelheiten siehe Wikipedia-Artikel (der allerdings nicht besonders ausführlich ist). Wer Englisch kann, sollte sich den englischen Wikipedia-Artikel zum Polybuten anschauen, der ist deutlich ausführlicher.
Polyisobuten (PIB)
Dieser Kunststoff hat ähnliche Eigenschaften wie die oben behandeltet. Warum bekommt das Polyisobuten dann hier einen eigenen Abschnitt? Das Interessante sind nicht die Eigenschaften des Polyisobutens, sondern die Herstellung, genauer gesagt, der Reaktionsmechanismus, der der Herstellung zu Grunde liegt. Polyisobuten wird nämlich nicht durch eine radikalische Polymerisation synthetisiert, sondern durch eine kationische. Die kationische Polymerisation erfolgt so ähnlich wie die Dimerisierung von Alkenen. Ein positives Ion setzt sich an die Doppelbindung (meistens ein Proton), dann entsteht ein Carbenium-Ion, das sich als Elektrophil an die C=C-Doppelbindung des nächsten Isobuten-Moleküls setzt. Es entsteht ein Octen-Kation, das sich an die C=C-Doppelbindung des dritten Isobuten-Moleküls addiert und so weiter. Einzelheiten zu diesem Mechanismus siehe die Seite "Polymerisation" in der Kunststoff-Abteilung dieser Homepage.