Gibt man etwas Wasser in einen Standzylinder und dann etwas Pentan, Hexan oder Hexen, dann stellt man fest, dass sich die beiden Flüssigkeiten nicht mischen, es bilden sich zwei gut sichtbar getrennte Phasen. Das Alkan bzw. das Alken schwimmt wegen seiner geringeren Dichte auf dem Wasser.
Die Frage, die sich bei diesem Versuch immer stellt, ist die: Wieso vermischen sich die beiden Flüssigkeiten nicht?
Die Ursache dafür liegt in dem hydrophoben Effekt, der am besten mit der folgenden Abbildung erklärt werden kann:
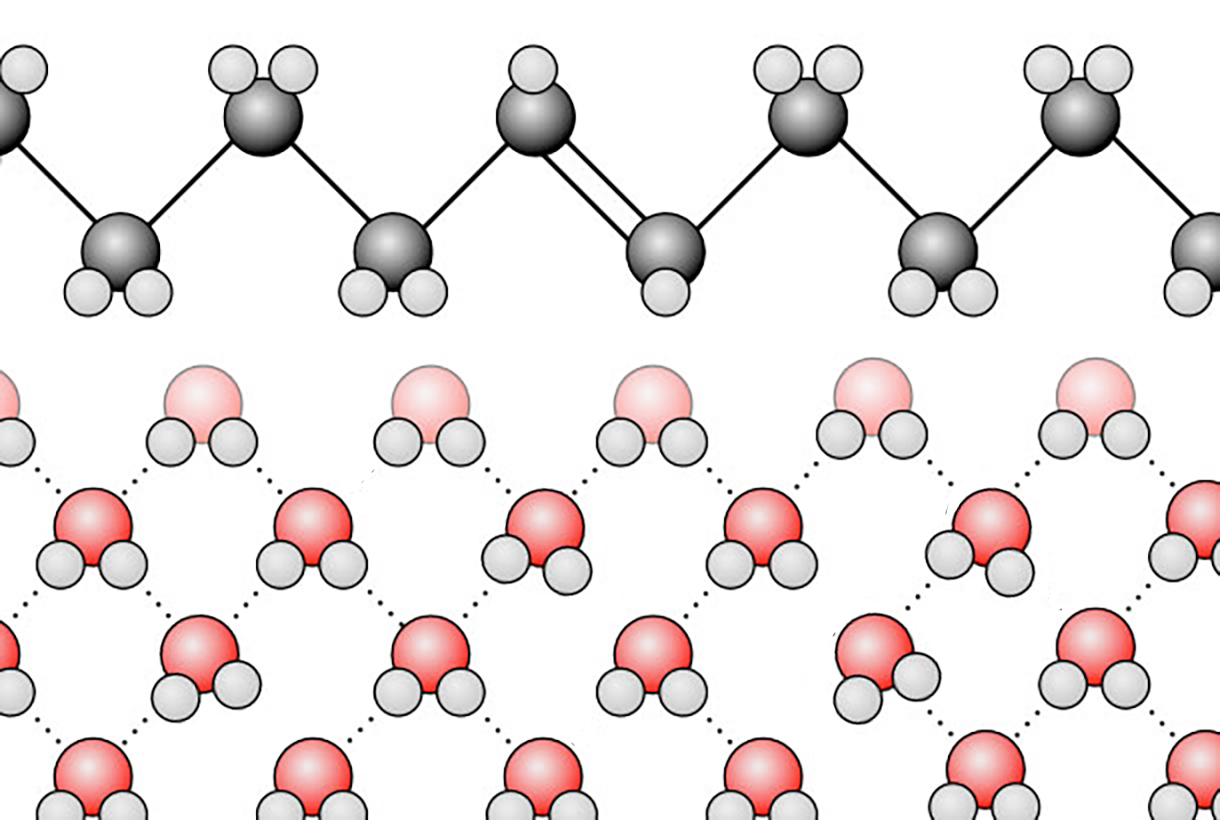
Veranschaulichung des hydrophoben Effekts
Autor: Ulrich Helmich, Lizenz: Public domain
Im Bild sehen wir einen vergrößerten Ausschnitt der Phasengrenze zwischen einem längerkettigen Alken und Wasser. Man achte auf die Wasserstoffbrücken-Bindungen zwischen den Wasser-Molekülen.
Die Wasser-Moleküle, die sich "im Innern" der wässrigen Phase befinden, können jeweils vier H-Brücken zu anderen Wasser-Molekülen ausbilden. Das ist energetisch sehr günstig: Zum Trennen einer chemischen Bindung wird Energie benötigt. Entsteht dagegen eine chemische Bindung, wird umgekehrt Energie freigesetzt. Wenn ein Wasser-Molekül vier H-Brücken bilden kann, wird viermal so viel Energie freigesetzt wie bei einem Wasser-Molekül, das nur zwei H-Brücken bilden kann. Und genau das ist der Fall bei den Wasser-Molekülen, die sich an der Grenzfläche zur Alken-Phase befinden, diese H2O-Moleküle können jeweils nur zwei H-Brücken ausbilden.
Die H-Atome der Methylen-Gruppen des Alkans/Alkens sind ja nicht in der Lage, H-Brücken zu bilden, weil sie nicht an einem elektronegativen N- oder O-Atom sitzen, sondern "nur" an einem C-Atom.
Die Wasser-Moleküle an der Phasengrenze sind also gegenüber den "inneren" Wasser-Molekülen energetisch benachteiligt.
Daher "versuchen" sie, ebenfalls in das "Innere" des Wassers zu gelangen. Auf gar keinen Fall bilden sie dagegen Bindungen zu den Kohlenwasserstoff-Molekülen in der Alkan- oder Alken-Phase.
Dieses Phänomen, dass die Wasser-Moleküle "lieber unter sich" bleiben, weil das wegen der vier möglichen H-Brücken energetisch günstiger ist, bezeichnet man als hydrophoben Effekt.
Das Römpp-Lexikon [2] erklärt den hydrophoben Effekt wie folgt:
Der hydrophobe Effekt "beruht weniger auf anziehenden Kräften zwischen den hydrophoben Molekülen, sondern auf dem Effekt der Vermeidung einer ... Störung der Wasser-Struktur durch diese Moleküle. Man spricht deshalb auch von hydrophober Wechselwirkung."
Eine weitere Veranschaulichung und Erklärung des hydrophoben Effekts findet sich in vielen Lehrbüchern die Biochemie, zum Beispiel im Lehninger [3]. Betrachten wir dazu die folgende Abbildung
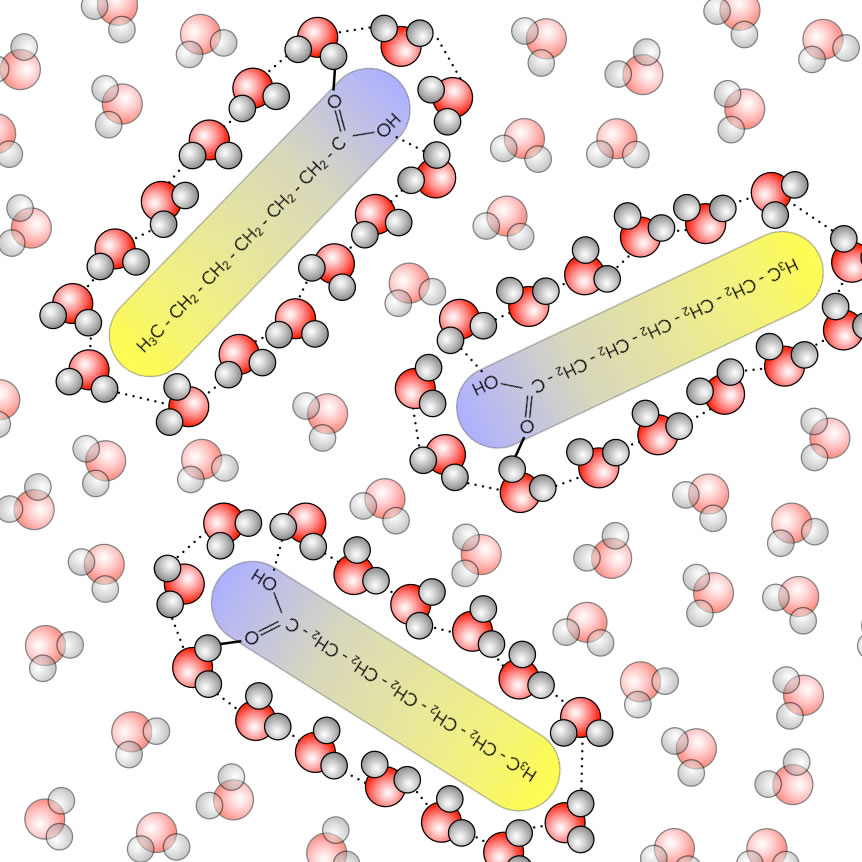
Drei Heptansäure-Moleküle in Wasser
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Das obige Bild zeigt schematisch drei Heptansäure-Moleküle, die sich in dem Lösemittel Wasser befinden.
Achten Sie auf die etwas kräftiger dargestellten Wasser-Moleküle, welche die drei Heptansäure-Moleküle wie ein Käfig umgeben. Untereinander sind diese Wasser-Moleküle durch Wasserstoffbrücken-Bindungen verbunden. Diese Käfige aus Wasser-Molekülen stellen einen hochgeordneten, entropiearmen (und damit weniger wahrscheinlichen) Zustand dar. In der hier dargestellten Modell-Situation befinden sich insgesamt 45 Wasser-Molekül in solchen entropiearmen Käfigen.
Schauen wir uns nun das nächste Bild an.
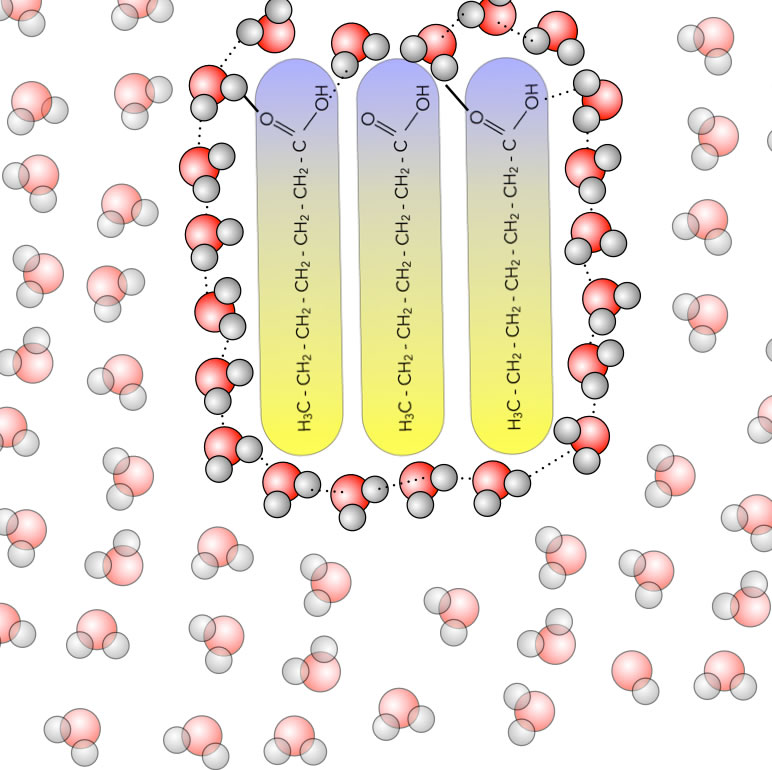
Drei Heptansäure-Moleküle schließen sich zusammen
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Die drei Heptansäure-Moleküle haben sich jetzt zusammengeschlossen, quasi zu einem "kleinen Ölfleck" auf dem Wasser. Jetzt sind nur noch 21 Wasser-Moleküle an der Bildung eines Käfigs beteiligt anstatt vorher 45 Moleküle. Das heißt, es befinden sich deutlich weniger Wasser-Moleküle in einem hochgeordneten, entropiearmen Zustand. Die Gesamt-Entropie des Systems hat zugenommen.
Diese Entropie-Zunahme durch Bildung von "Ölflecken" oder "Öltropfen", also durch die Aggregation hydrophober Moleküle oder der hydrophoben Teile amphipolarer Moleküle ist die eigentliche Triebkraft für den hydrophoben Effekt. Diese Entropie-Zunahme ist der Grund dafür, dass sich Benzin nicht mit Wasser mischt.
Würde sich Benzin mit dem Wasser mischen, wäre die Entropie zwar auch höher als bei dem 2-Phasen-System Benzin oben und Wasser unten, aber sie würde nicht so stark zunehmen wie bei dem hydrophoben Effekt.
Quellen:
- Stillwell, William. An Introduction to Biological Membranes. Elsevier Science 2016.
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.