Inhalt
Auf dieser Seite werden ein paar sehr wichtige Moleküle und ihr Aufbau vorgestellt:
Das Methan-Molekül
Kommen wir nun zu einem sehr wichtigen Molekül. Methan selbst ist vielleicht gar nicht so interessant als Stoff, aber es ist die einfachste organische Verbindung. Und mit organischen Verbindungen müssen sich alle Schüler(innen) auseinandersetzen, die sich in der Oberstufe mit den Fächern Chemie, Biologie oder Ernährungslehre ernsthaft beschäftigen wollen.
Das Kohlenstoff-Atom im Kugelwolkenmodell
Die Abbildung 1 zeigt das Kohlenstoff-Atom, wie es sich nach dem Kugelwolkenmodell darstellt. Die nächste Abbildung stellt auf ein Wasserstoff-Atom nach dem Kugelwolkenmodell dar:

Das Wasserstoff-Atom nach dem Kugelwolkenmodell
Gemäß der Edelgasregel (Oktettregel) "wollen" alle Atome vollständig besetzte Kugelwolken haben, das heißt, jede Kugelwolke "möchte" mit zwei Elektronen besetzt sein. Atome, die nur wenige Außenelektronen haben wie zum Beispiel Natrium oder Magnesium geben diese Außenelektronen einfach komplett ab und werden dadurch zu positiv geladenen Ionen. Atome, denen nur noch ein oder zwei Elektronen für den Edelgaszustand fehlen, nehmen diese fehlenden Elektronen komplett auf und werden dadurch zu negativ geladenen Ionen. Das alles hatten wir bereits besprochen, als wir über die Ionenbindung sprachen. Elemente wie Kohlenstoff haben aber Atome mit vier Außenelektronen. Es wäre energetisch jetzt sehr ungünstig, alle vier Elektronen vollständig abzugeben und dann vierwertig positive Ionen zu bilden. Genau so ungünstig wäre das Gegenteil, nämlich die Aufnahme von vier Elektronen unter Bildung von vierwertig negativen Ionen. Elemente wie Kohlenstoff, Stickstoff etc. bevorzugen hier einen völlig anderen Weg, den wir bereits auf der letzten Seite kennen gelernt haben, nämlich das Teilen von Elektronen mit anderen Atomen.
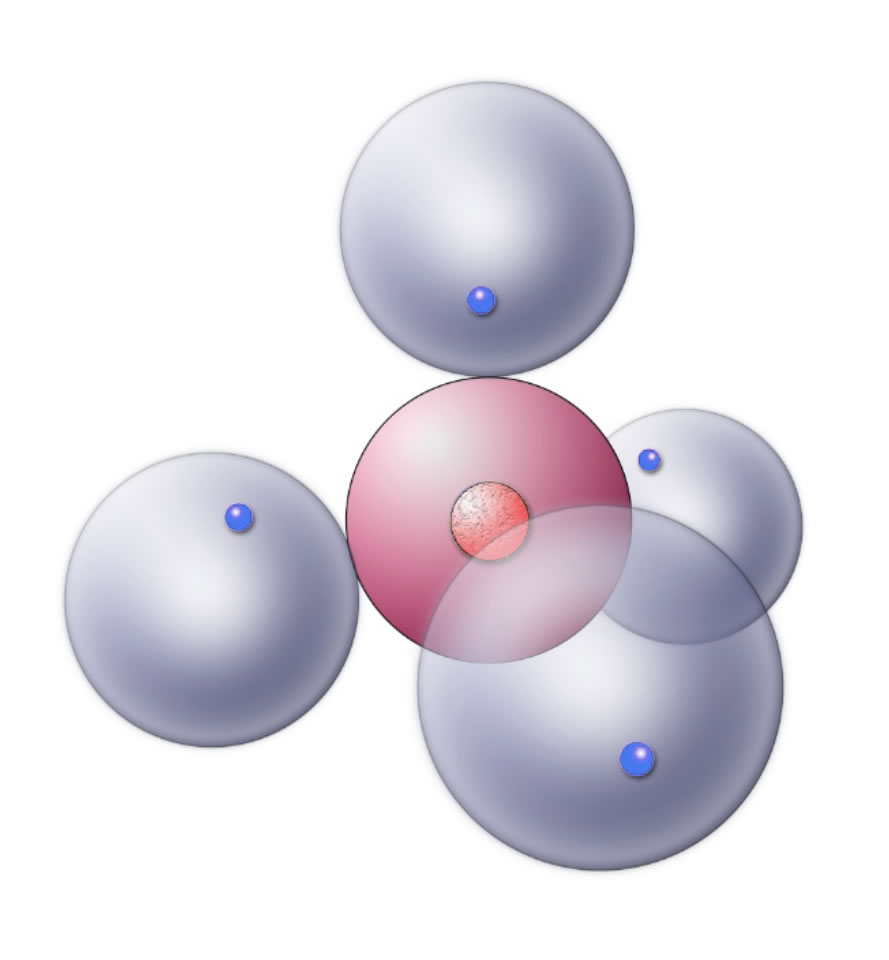
Die vier einfach besetzten Kugelwolken des C-Atoms vereinigen sich daher mit den ebenfalls einfach besetzten Kugelwolken von vier H-Atomen. Das sieht dann so aus:
Das Methan-Molekül im Kugelwolkenmodell
Graphisch ist diese Darstellung noch nicht perfekt, die sich vereinigenden Kugelwolken hätten eigentlich ohne scharfe Grenzen dargestellt werden müssen.
Wenn wir uns mit dem Thema "Organische Chemie" beschäftigen (am Ende der 9. Klasse und natürlich am Anfang der Einführungsphase in die Oberstufe), werden wir das Methanmolekül noch wesentlich ausführlicher behandeln.
Auch für die Umweltchemie spielt Methan eine wichtige Rolle, weniger als Treibhausgas, sondern vielmehr als alternative Energiequelle; Stichwort "Biogas".
Jetzt aber auf zum nächsten wichtigen Molekül, dem Ammoniakmolekül.
Das Ammoniak-Molekül ↑
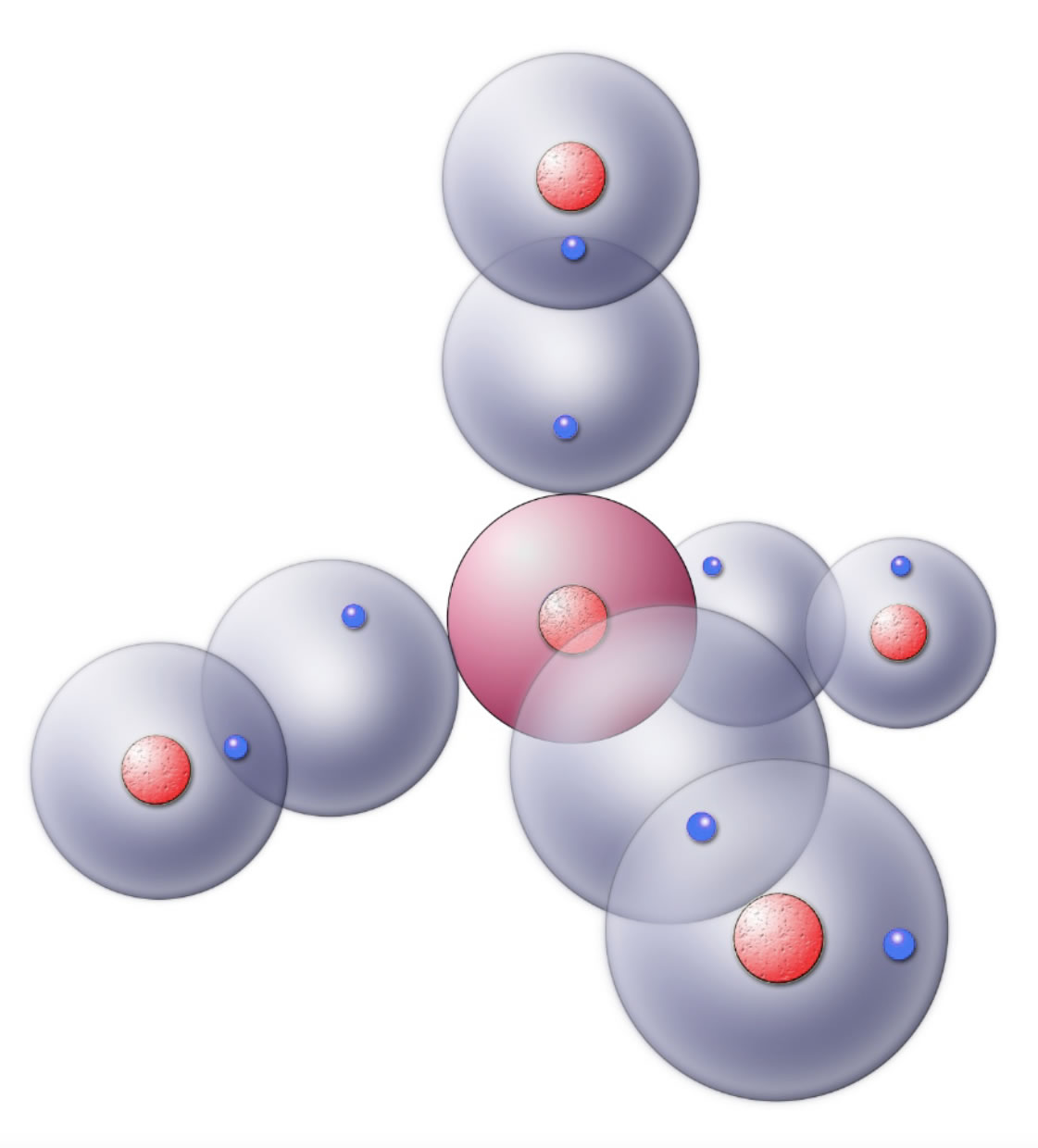
Beim Ammoniak NH3 verbindet sich ein Stickstoff-Atom mit drei Wasserstoff-Atomen. Das N-Atom hat insgesamt fünf Außenelektronen. Drei Kugelwolken sind mit je einem Elektron besetzt, eine Kugelwolke ist doppelt besetzt. Die drei einfach besetzten Kugelwolken können nun mit den ebenfalls einfach besetzten Kugelwolken von drei H-Atomen überlappen und so drei kovalente Bindungen bilden.

Das Ammoniak-Molekül im Kugelwolkenmodell
Zur Bildung des Ammoniak-Moleküls kommt es, wenn sich ein Stickstoff-Atom mit drei Wasserstoff-Atomen vereinigt. Das N-Atom hat drei einfach besetzte Kugelwolke und eine doppelt besetzte, ein sogenanntes freies Elektronenpaar, in der Abbildung hinten rechts zu sehen. Es können also drei kovalente N-H-Bindungen gebildet werden.
Das Wasser-Molekül ↑
Noch wichtiger als das Ammoniakmolekül ist das Wassermolekül. Schließlich kommt alles Leben aus dem Wasser, und wir selbst bestehen zu einem hohen Prozentsatz aus Wasser. Und Wasser ist ein wichtiges Lösemittel in der Chemie. Grund genug also, uns mit diesem Molekül intensiv zu beschäftigen.
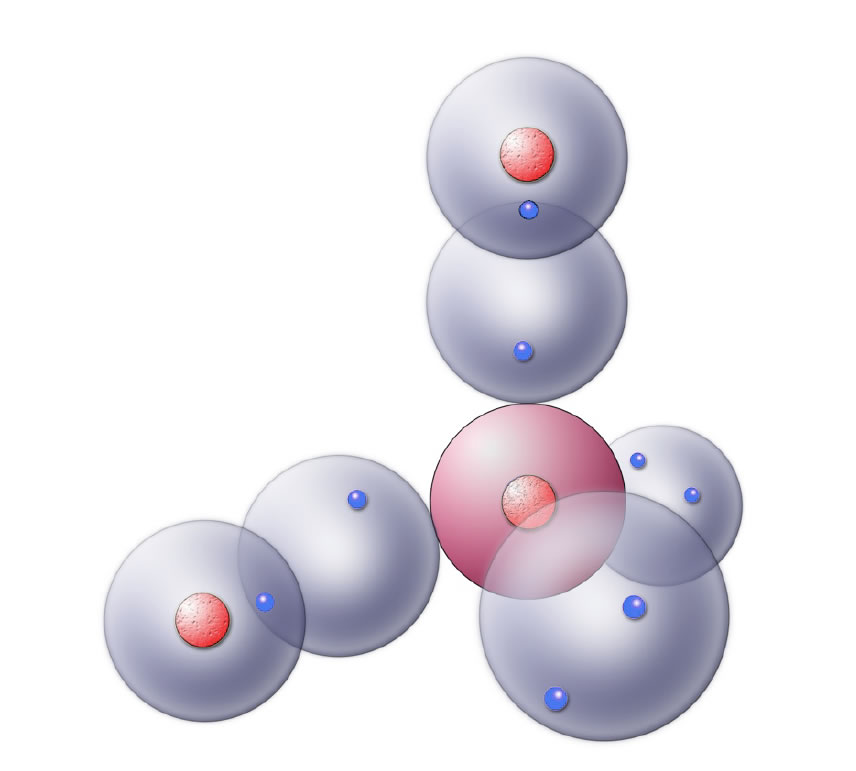
Das Wasser-Molekül im Kugelwolkenmodell
Dass jetzt keiner glaubt, wir wären schon fertig mit dem Wassermolekül! Dafür ist das Wasser ein viel zu wichtiges Thema, aber aus Platzgründen müssen wir dieses Thema auf eine eigene Seite auslagern, sonst würde der Rahmen dieser Seite gesprengt. Eine genauere Darstellung des Wassermoleküls findet sich auch auf der nächsten Seite.
Das Sauerstoff-Molekül ↑
Sauerstoff ist ein lebenswichtiges Element, das auch in der Chemie eine wichtige Rolle bei vielen chemischen Reaktionen spielt, zum Beispiel bei den Oxidationen. Das Element Sauerstoff kommt in Form zweiatomiger Moleküle in der Natur vor, Sauerstoff hat also die Summenformel O2. Aber wie kommt es zur Bildung dieses Moleküls?
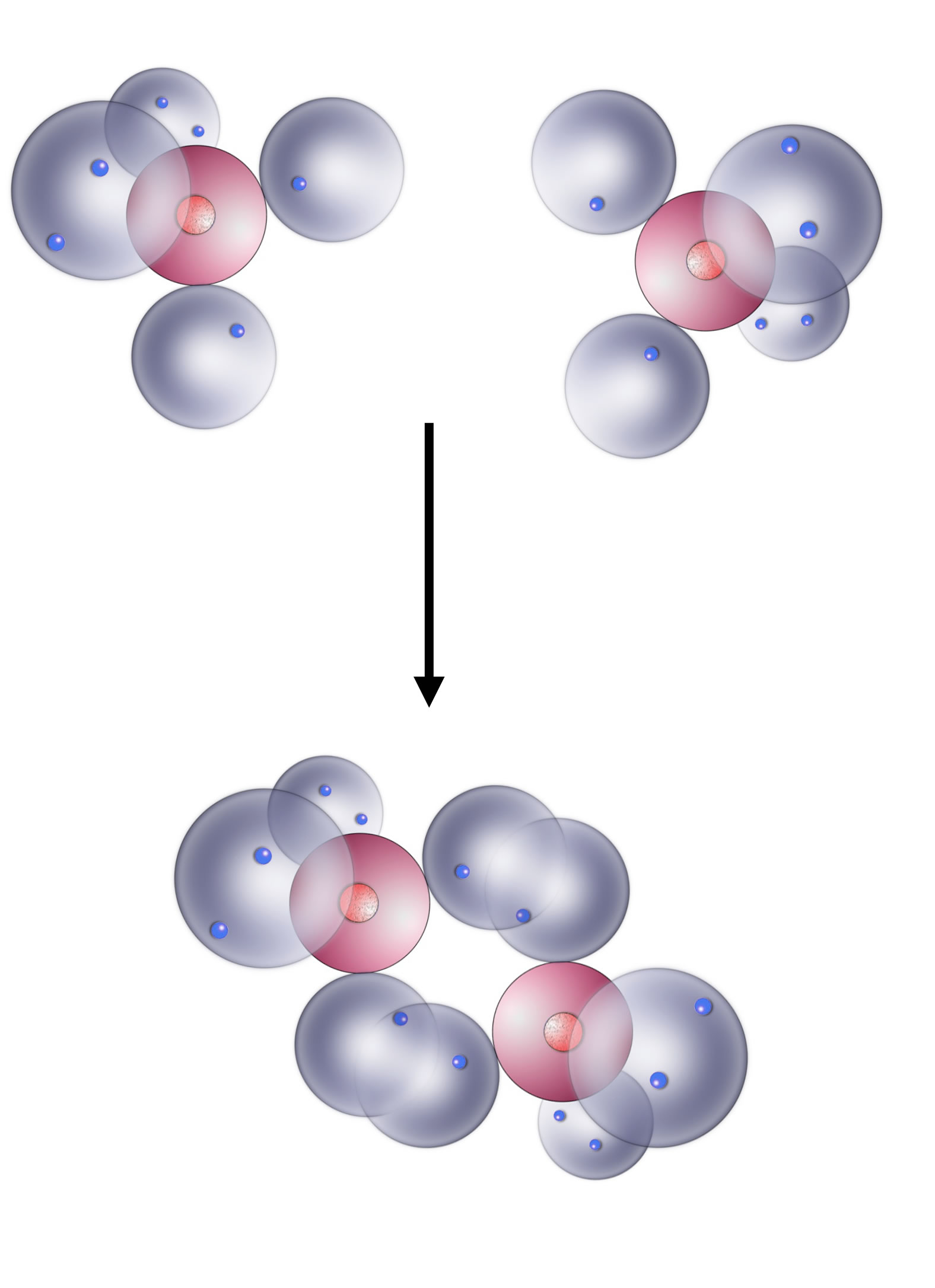
Das Sauerstoff-Molekül im Kugelwolkenmodell
Jedes O-Atom hat zwei einfach besetzte Kugelwolken. In der Abbildung oben sind zwei dieser O-Atome zu sehen, und zum Glück sind sie auch schon so gedreht worden, dass eigentlich jeder Schüler und jede Schülerin sehen müsste, was gleich passieren wird.
Die obere einfach besetzte Kugelwolke des linken O-Atoms vereinigt sich mit der oberen einfach besetzten Kugelwolke des rechten O-Atoms. Es entsteht eine kovalente O-O-Bindung. Das Gleiche passiert mit den beiden unteren einfach besetzten Kugelwolken. Es bildet sich eine zweite kovalente O-O-Bindung. Zusammen bezeichnet man diese beiden Bindungen als O=O-Doppelbindung.
Das Kohlendioxid-Molekül ↑
Kohlendioxid entsteht, wenn Menschen und Tiere ausatmen, und bei der Verbrennung von fossilen Brennstoffen wie Erdöl, Holz, Kohle etc. Der Treibhauseffekt, der für die vielen Klimakatastrophen in letzter Zeit verantwortlich sein soll, ist zum großen Teil auf Kohlendioxid zurückzuführen.
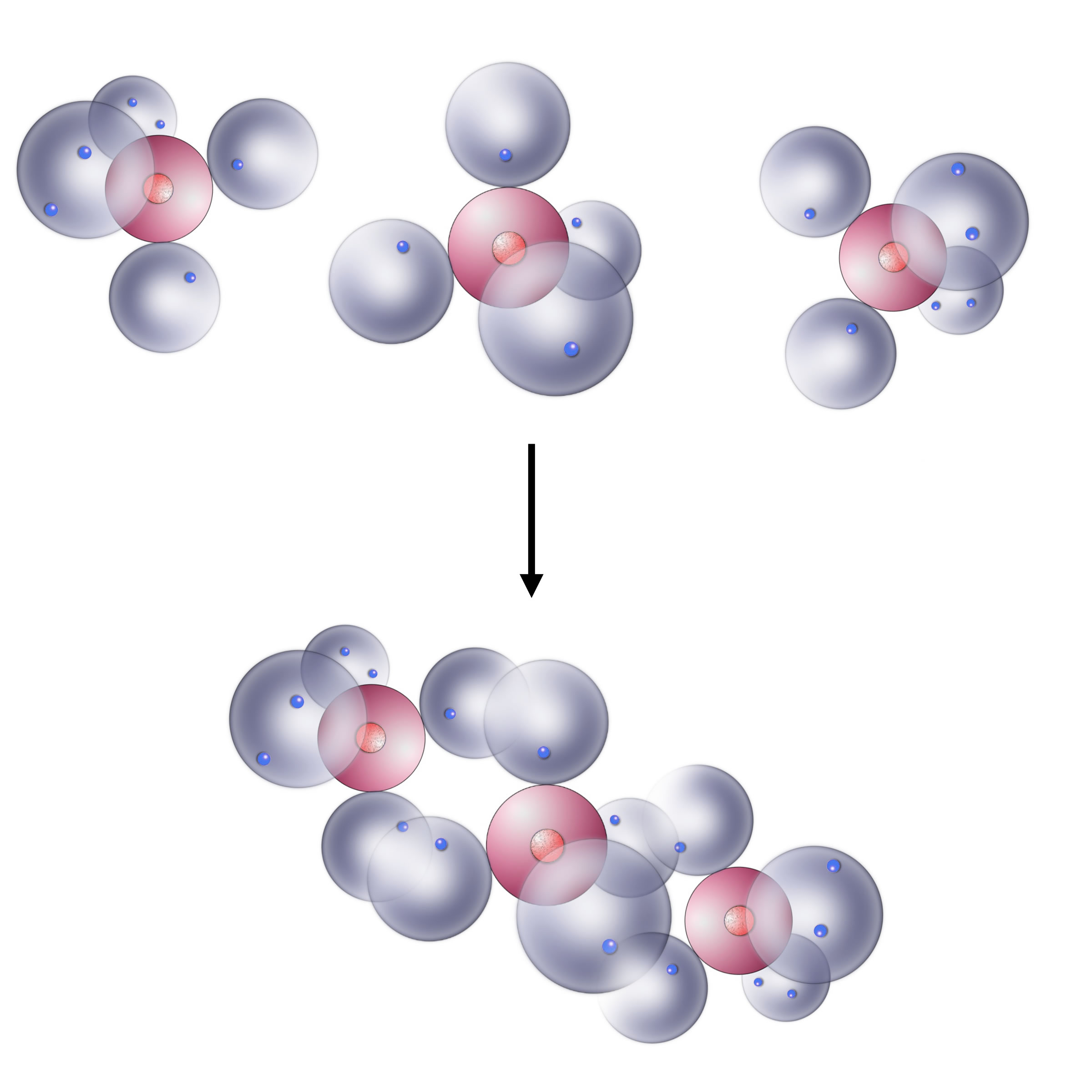
Die Bildung des Kohlendioxid-Moleküls nach dem Kugelwolkenmodell
Das C-Atom hat vier einfach besetzte Kugelwolken, jedes O-Atom hat zwei dieser einfach besetzten Kuzgelwolken. Auf der Abbildung sind die O-Atome schon strategisch günstig eingezeichnet. Die einfach besetzten Kugelwolken der O-Atome sind nämlich schon in Richtung C-Atom orientiert.
Zwei Kugelwolken des C-Atoms überlappen jetzt mit den beiden einfach besetzten Kugelwolken des linken O-Atoms. Es entstehen also zwei gemeinsame Kugelwolken mit je zwei Bindungselektronen. Es bildet sich eine doppelte Elektronenpaarbindung, die in diesem Fall als C=O-Doppelbindung bezeichnet werden kann. Auf der rechten Seite der Abbildung passiert genau das Gleiche. Die beiden Kugelwolken des C-Atoms, die noch übrig sind, überlappen mit den beiden einfach besetzten Kugelwolken des rechten O-Atoms. Wieder entstehen zwei Elektronenpaarbindungen, die als C=O-Doppelbindung bezeichnet werden.
Mit Doppelbindungen werden wir uns in der Klasse 8/9 nicht allzu viel beschäftigen, eher in der organischen Chemie der Stufe EF (10) und Q1 (11). Neben der Doppelbindung gibt es auch noch die Dreifachbindung, z.B. zwischen zwei Stickstoffatomen. Auf die wollen wir hier aber nicht weiter eingehen.
Seitenanfang -
weiter mit
polaren Bindungen