Ein Methan-Molekül ist tetraederförmig
Ein Methan-Molekül besteht aus einem Kohlenstoff-Atom, das von vier Wasserstoff-Atomen umgeben ist. Räumlich muss man sich das so vorstellen, dass sich die vier H-Atome in den vier Ecken eines Tetraeders befinden und das C-Atom in der Mitte des Tetraeders.
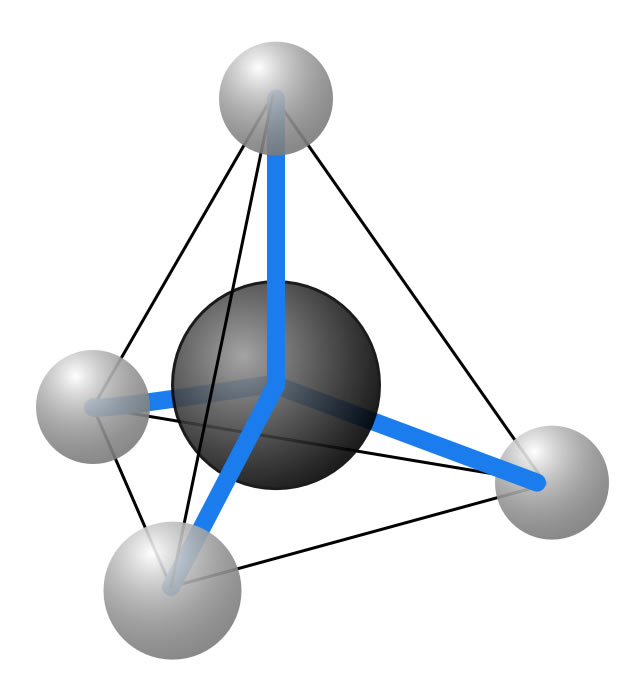
Der Methan-Tetraeder
Autor: Ulrich Helmich
2018, Lizenz: Public domain.
Hätte das Methan eine planare Struktur, wie im folgenden Bild zu sehen...
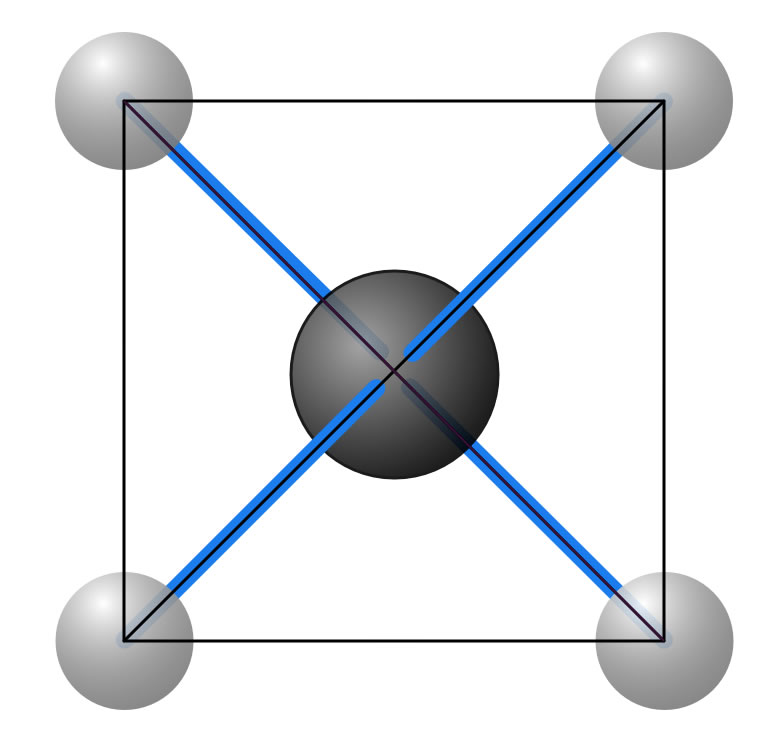
Eine planare Struktur des Methan-Moleküls
Autor: Ulrich Helmich
2018, Lizenz: Public domain.
...dann wären die nebeneinander liegenden H-Atome näher beieinander als die diagonal gegenüberliegend. Man müsste also zwei verschiedene H-H-Abstände im Molekül messen können, was aber nicht der Fall ist.
Strukturdaten des Methan-Moleküls
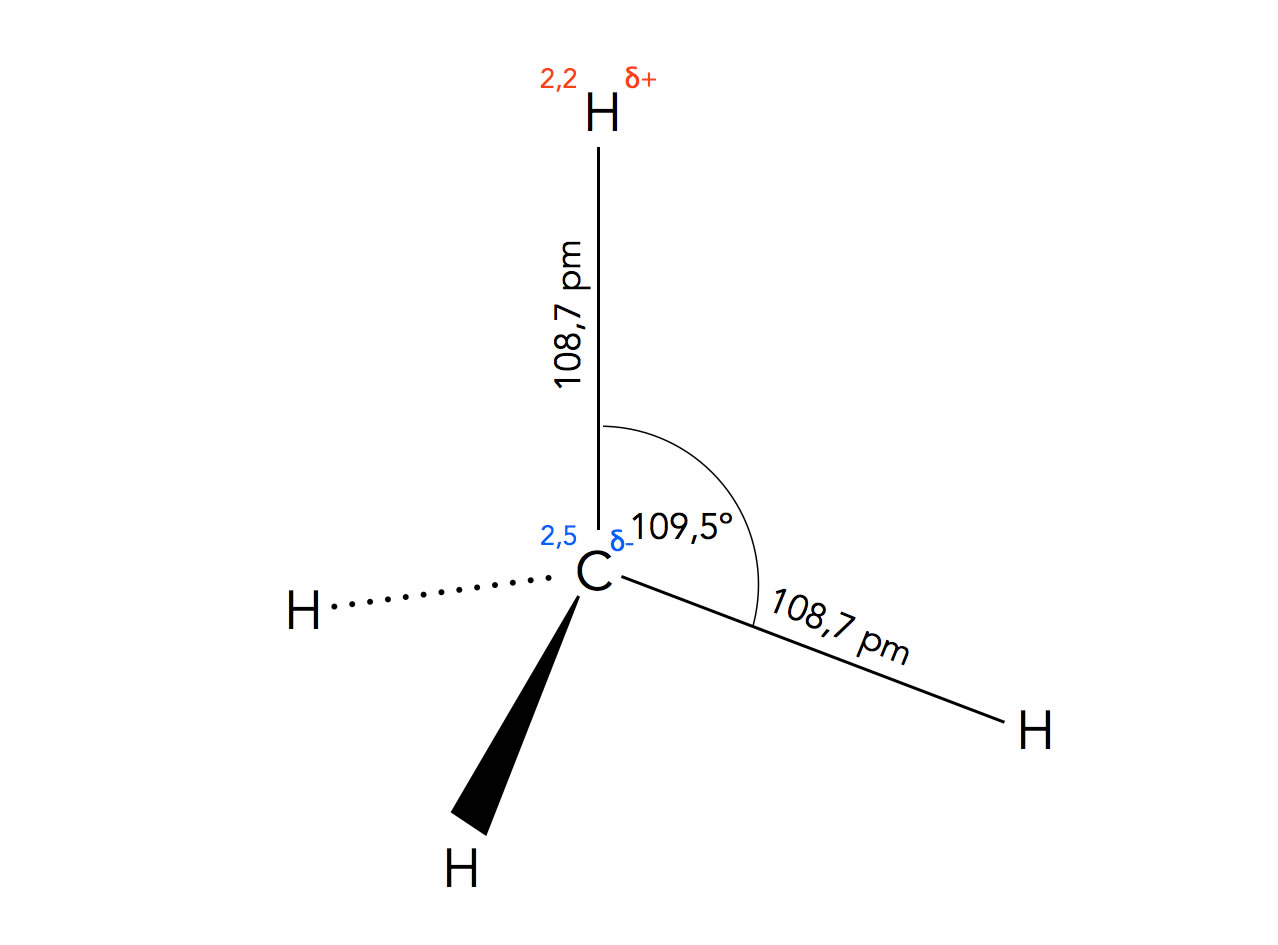
Strukturdaten des Methan-Moleküls
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die vier H-Atome des Methans sind tetraedrisch angeordnet, der Bindungswinkel H-C-H beträgt also jeweils 109,5º.
Die vier C-H-Bindungen sind nicht ganz unpolar, da ein gewisser EN-Unterschied zwischen Kohlenstoff (2,5) und Wasserstoff (2,2) vorhanden ist, aber für die meisten Belange wird die C-H-Bindung als unpolar bezeichnet. Auch vom physikalischen Verhalten her ist die Verbindung Methan unpolar, was man u.a. an dem sehr niedrigen Siedepunkt und der extrem schlechten Wasserlöslichkeit erkennen kann.
Die Bindungslänge der C-H-Bindungen beträgt 108,7 pm, und die Bindungsdissoziationsenergie liegt bei 411 kJ/mol, wobei das nur ein Durchschnittswert ist; zur Abspaltung des ersten H-Atoms sind beispielsweise 421 kJ/mol notwendig.
Methan im Schalenmodell EF
In älteren Chemiebüchern findet man oft noch Zeichnungen des Methan-Moleküls, die auf dem Schalenmodell basieren:

Das Methan-Molekül nach dem Schalenmodell des Atoms
Autor: Ulrich Helmich 2019, Lizenz: Public domain.
Wenn man sich eine solche Abbildung betrachtet, stellen sich gleich mehrere Fragen. Müsste das Methan nicht eine quadratisch-planare Struktur haben, bei der sich alle fünf Atome in einer Ebene befinden? Wie können sich die acht Elektronen der L-Schale des Kohlenstoffs frei auf der Schale bewegen, wenn sie gleichzeitig an den H-Atomen "hängen"?
Bei der Besprechung von elektrochemischen Vorgängen, Oxidation, Reduktion, Elektrolyse und so weiter kann man das Schalenmodell des Atoms durchaus verwenden, hier leistet es gute Dienste. Wenn es aber um die räumliche Struktur von Molekülen geht, versagt das Schalenmodell. Aus diesem Grunde sollte man sich in der gymnasialen Oberstufe ausschließlich mit dem Kugelwolkenmodell beschäftigen, und bei komplexeren Themen wie Aromaten oder Farbstoffchemie auch mit dem noch anspruchsvolleren Orbitalmodell.
Methan im Kugelwolkenmodell EF,Q1
Die tetraederförmige Struktur des Methan-Moleküls liegt im Aufbau des Kohlenstoff-Atoms begründet. Nach dem Kugelwolkenmodell hat das C-Atom vier einfach besetzte Kugelwolken, die das innere Atom (also den Atomkern mit den beiden Elektronen der K-Schale) tetraederförmig umgeben. Jede der vier Kugelwolken ist mit einem Elektron besetzt. Mit vier H-Atomen bilden diese vier Kugelwolken nun kovalente C-H-Bindungen; die Tetraederstruktur bleibt dabei erhalten, weil es sich um vier gleiche Atome handelt, die sich gegenseitig gleich stark abstoßen.
Der Grund für die tetraederförmige Anordnung der vier Kugelwolken des C-Atoms ist die gegenseitige Abstoßung dieser negativ geladenen Wolken. Es existiert nur eine geometrische Möglichkeit, den Abstand zwischen den vier Kugelwolken maximal zu halten, nämlich die Tetraederstruktur. Bei allen anderen geometrischen Anordnungen gibt es immer mindestens zwei Kugelwolken, die sich näher kommen als im Tetraeder.
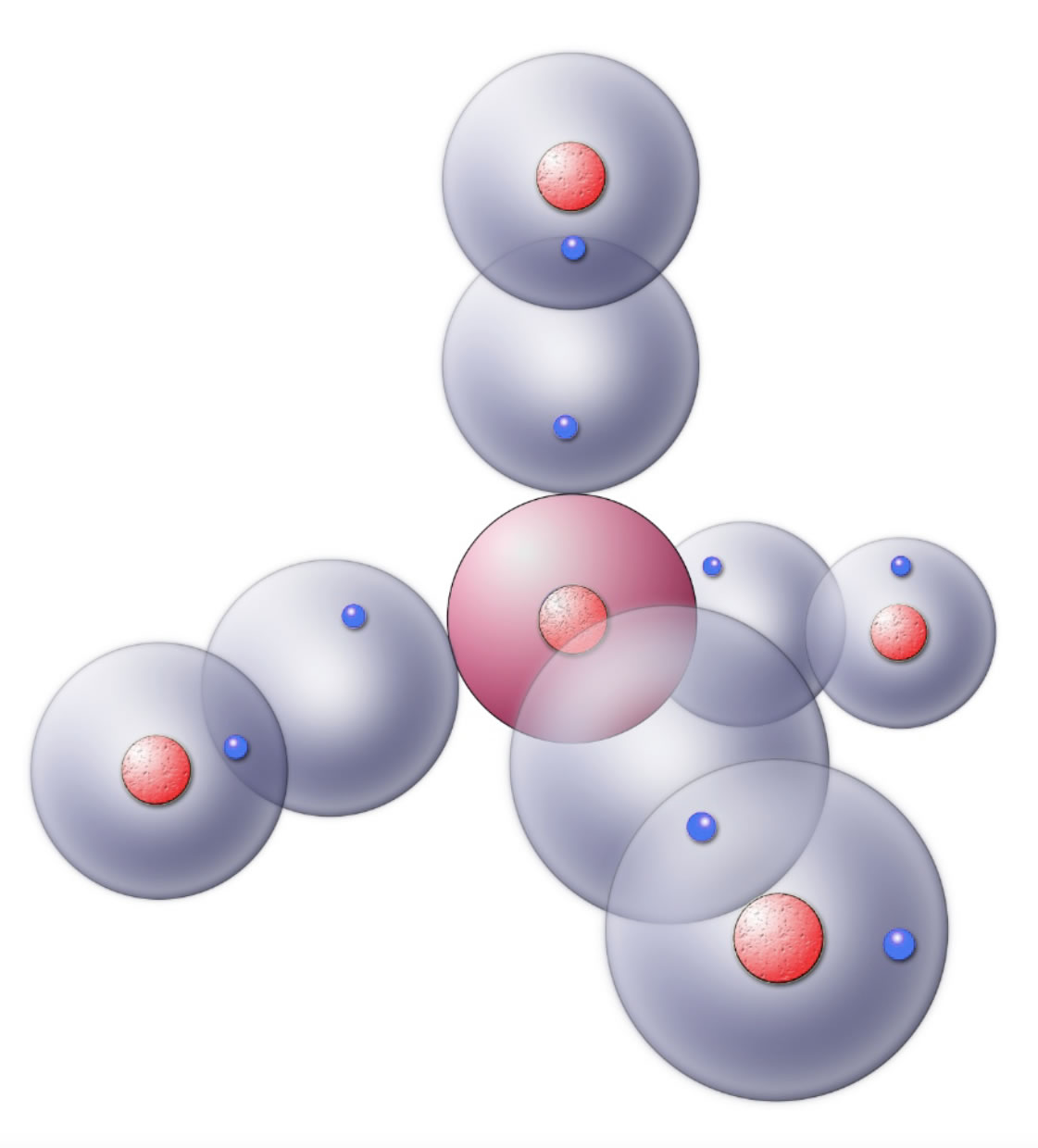
Das Methan-Molekül nach dem Kugelwolkenmodell
Autor: Ulrich Helmich 2018, Lizenz: Public domain
Diese Zeichnung stellt das Methan-Molekül nach dem Kugelwolkenmodell dar, allerdings noch nicht ganz perfekt. Die Kugelwolken der H-Atome und des Methans sind zu einer einzigen Elektronenwolke verschmolzen, was in der Abbildung nur durch die Überlappung der Wolken angedeutet wird. Im nächsten Schritt muss man sich vorstellen, dass die Grenzen zwischen den H-Wolken und den C-Wolken verschwinden. Die beiden Bindungselektronen können sich dann in der gemeinsamen Wolke überall aufhalten.
Methan im Orbitalmodell Q2, Studium
Hier finden Sie grundlegende Informationen zum Orbitalmodell, mit dem man wesentlich mehr anfangen kann als mit dem Kugelwolkenmodell.
Nach dem Orbitalmodell müsste Methan eigentlich die Summenformel CH2 und einen H-C-H-Bindungswinkel von 90º haben.
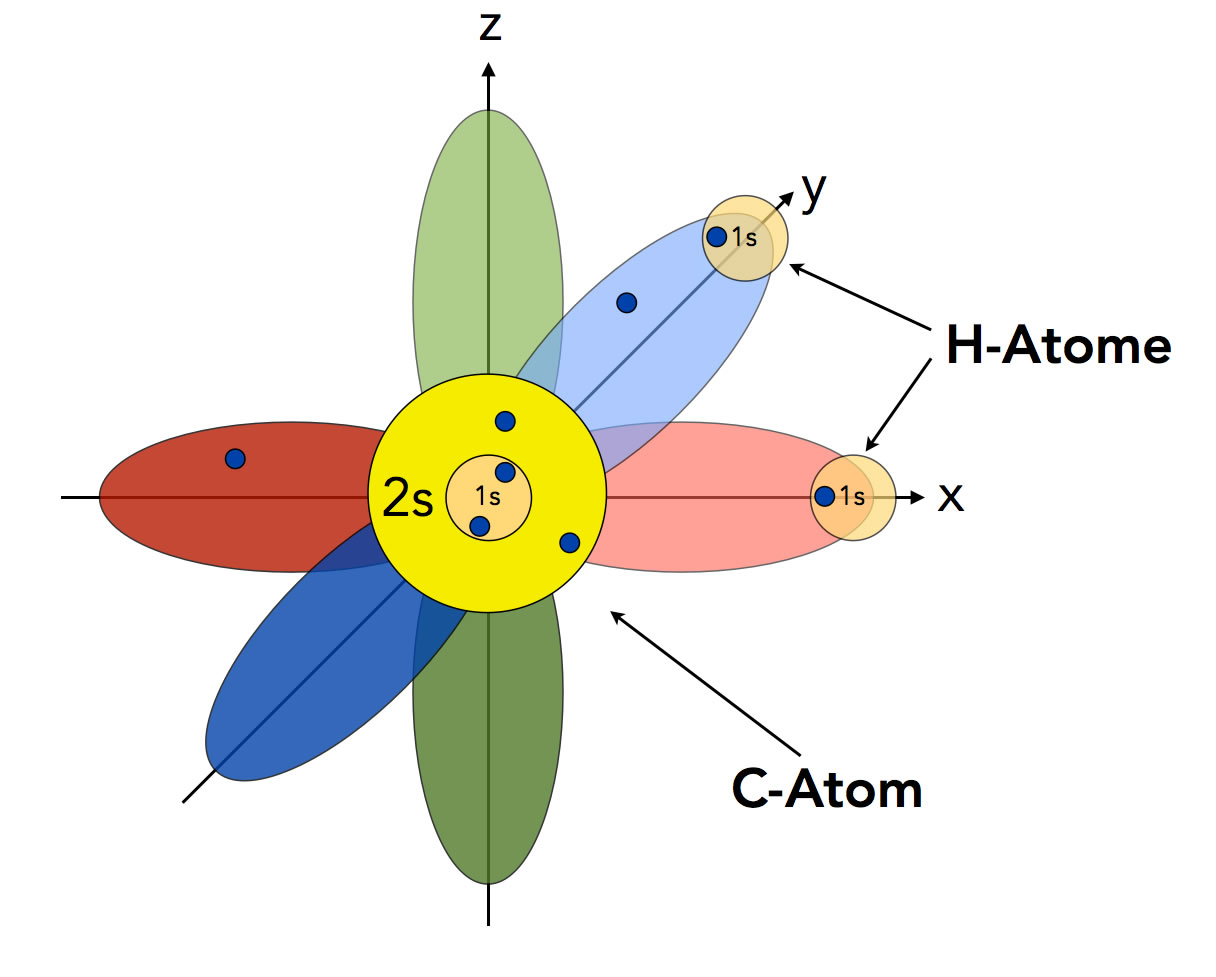
Das Methan-Molekül, wie es eigentlich nach dem Orbitalmodell aussehen müsste.
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das C-Atom hat nach dem Orbitalmodell ein kugelförmiges 2s-Orbital, das mit zwei Elektronen besetzt ist, und drei senkrecht aufeinander stehende p-Orbitale, von denen aber nur zwei mit je einem Elektron besetzt sind. Nur diese beiden einfach besetzten p-Orbitale (px und py) können mit dem 1s-Orbital eines H-Atoms überlappen und eine kovalente Bindung bilden. Nach dieser Vorstellung müsste Methan
- Die Summenformel CH2 haben,
- einen H-C-H-Bindungswinkel von 90º besitzen,
- eine Lewis-Säure sein (wegen des leeren pz-Orbitals, welches das Elektronenpaar einer Lewis-Base aufnehmen könnte).
Alle drei Eigenschaften treffen aber nicht zu. Das Methan-Molekül hat die Summenformel CH4, die H-C-H-Bindungswinkel betragen 109,5 º, und Methan ist mit Sicherheit keine Lewis-Säure. Mit Lewis-Basen wie :NH3 müsste ja sonst eine Reaktion zu CH2-NH3 stattfinden.
Um nun trotzdem die bekannten Eigenschaften des Methans (und anderer Verbindungen) mit dem Orbitalmodell in Einklang zu bringen, hat man das Konzept der Hybridisierung entwickelt. Danach vereinigen sich die drei 2p-Orbitale des C-Atoms mit dem 2s-Orbital zu vier gleichwertigen sp3-Hybridorbitalen, die wundersamerweise genau tetraedrisch angeordnet sind.
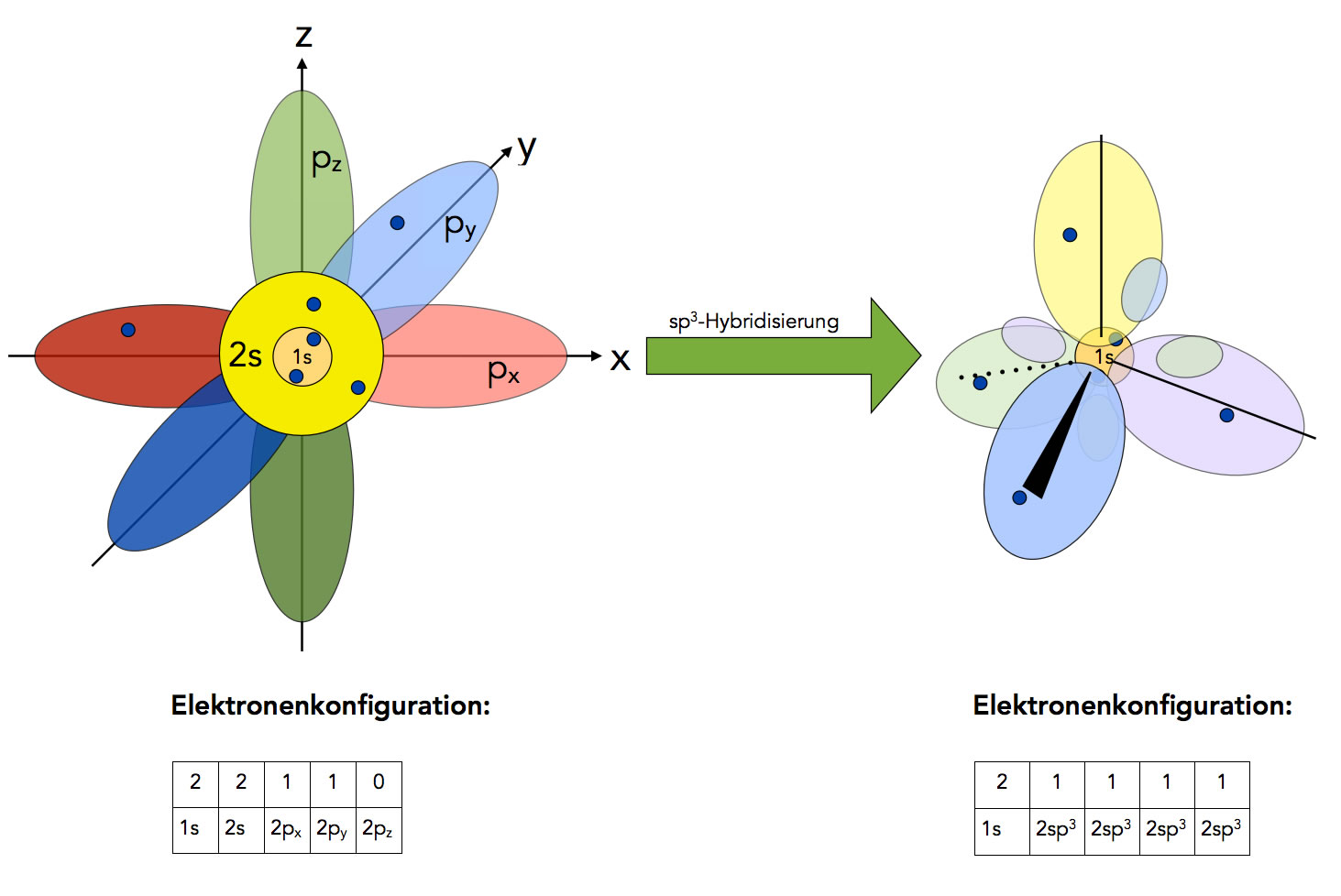
Hybridisierung des C-Atoms
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Wenn man nicht so genau hinschaut, sieht das hybridisierte C-Atom jetzt fast so aus wie das C-Atom nach dem Kugelwolkenmodell. Schaut man genauer hin, dann sieht man, dass ein sp3-Hybridorbital aus zwei ungleich großen, sich gegenüberliegenden Orbitallappen besteht. In den meisten Abbildung werden die kleinen Orbitallappen aber nicht mit eingezeichnet, daher sieht die Darstellung des C-Atoms oft genau so aus wie nach dem Kugelwolkenmodell.
Die vier gleichwertigen sp3-Hybridorbitale enthalten je ein Elektron, können also jeweils mit dem einfach besetzten s-Orbital eines H-Atoms überlappen. Daher hat Methan die Summenformel CH4, und das Molekül hat eine tetraedrische Gestalt.