Dieser Kurs geht davon aus, dass das Kern-Hülle-Modell sowie das Schalen-Modell des Atoms bekannt sind. Außerdem sollten die Ionenbindung nach dem Schalen-Modell sowie die Oktettregel behandelt worden sein.
Diese große Präsentation (PDF-Datei) steht nun kostenlos zur Verfügung - für Kollegen und Kolleginnen zum Einsatz im Unterricht, für Schüler(innen) zur Vorbereitung von Referaten.
Grenzen des Schalen-Modells
Das Kugelwolken-Modell ist eine Erweiterung des Schalen-Modells und gleichzeitig eine Vereinfachung des Orbitalmodells. Um die Grenzen des Schalenmodells aufzuzeigen, wollen wir uns eine kleine und harmlose Frage stellen:
Wieso hat das Wasser-Molekül eigentlich eine gewinkelte Gestalt und keine lineare?
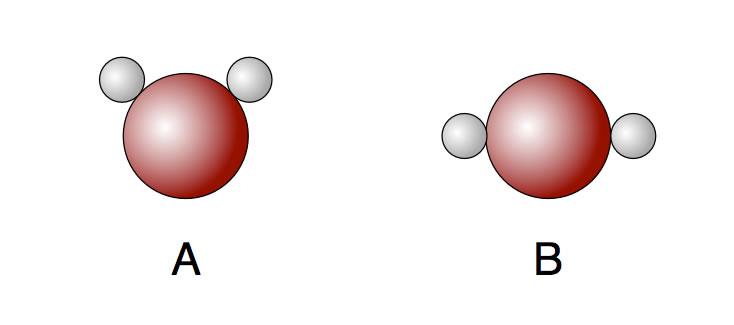
Zwei mögliche Raumstrukturen des Wasser-Moleküls: links gewinkelt, rechts linear.
Mit Hilfe des Schalen-Modells könnte man die Struktur A schnell begründen:
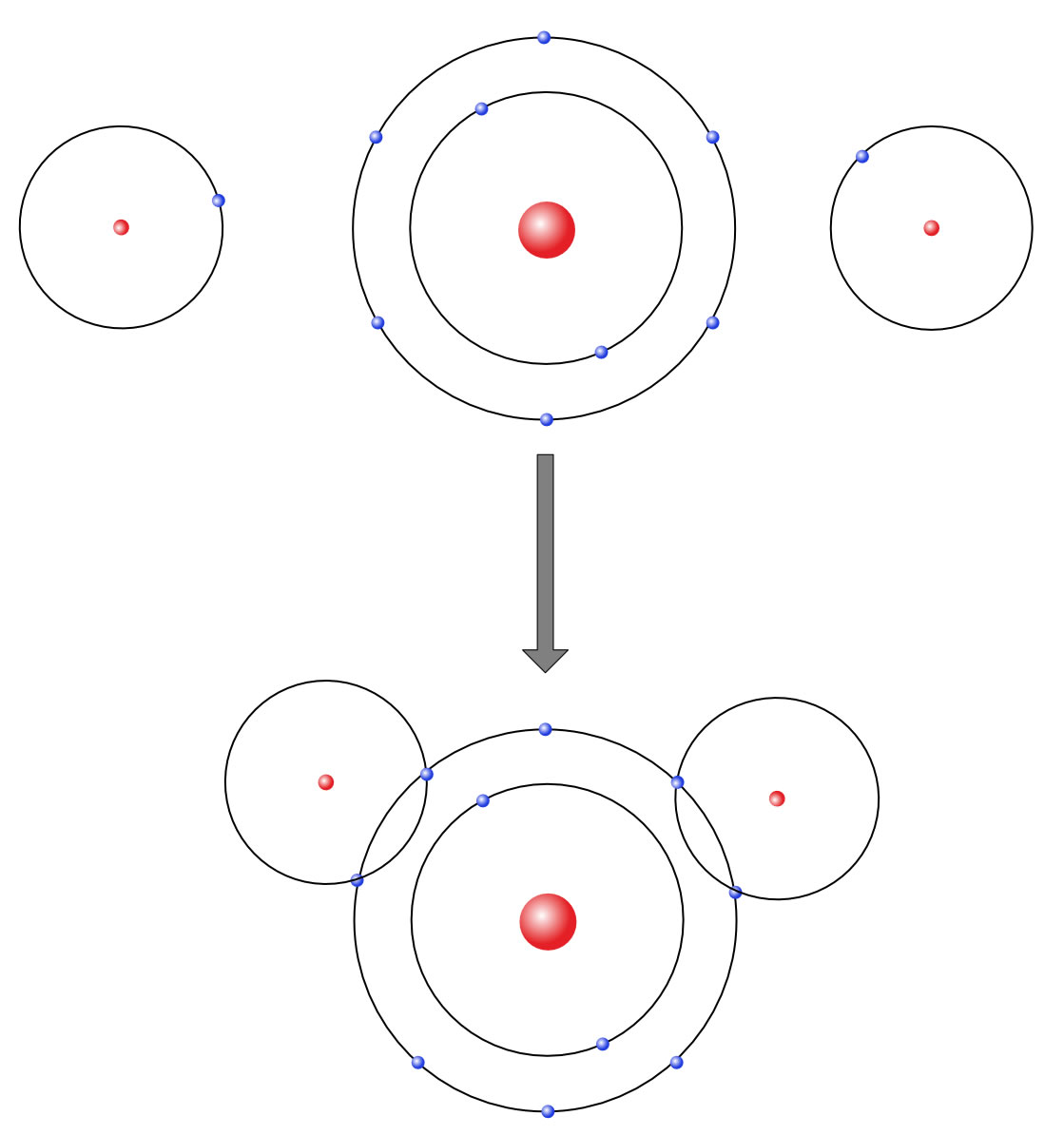
Eine Begründung für Struktur A nach dem Schalen-Modell des Atoms
Eine solche Abbildung findet man in vielen älteren Schulbüchern. Dem Sauerstoff-Atom mit seinen sechs Außenelektronen fehlen zwei Elektronen für die Edelgaskonfiguration. Es verbindet sich mit zwei Wasserstoff-Atomen und teilt sich mit diesen je ein Elektron. So befinden sich acht Elektronen auf der Außenschale des Sauerstoffs und zwei Elektronen auf der Außenschale des Wasserstoffs. Mit der hier gezeigten Anordnung der drei Atome könnte man die Struktur A des Wasser-Moleküls gut erklären.
Aber genauso gut könnte man mit dem Schalenmodell auch die Struktur B des Wasser-Moleküls begründen:
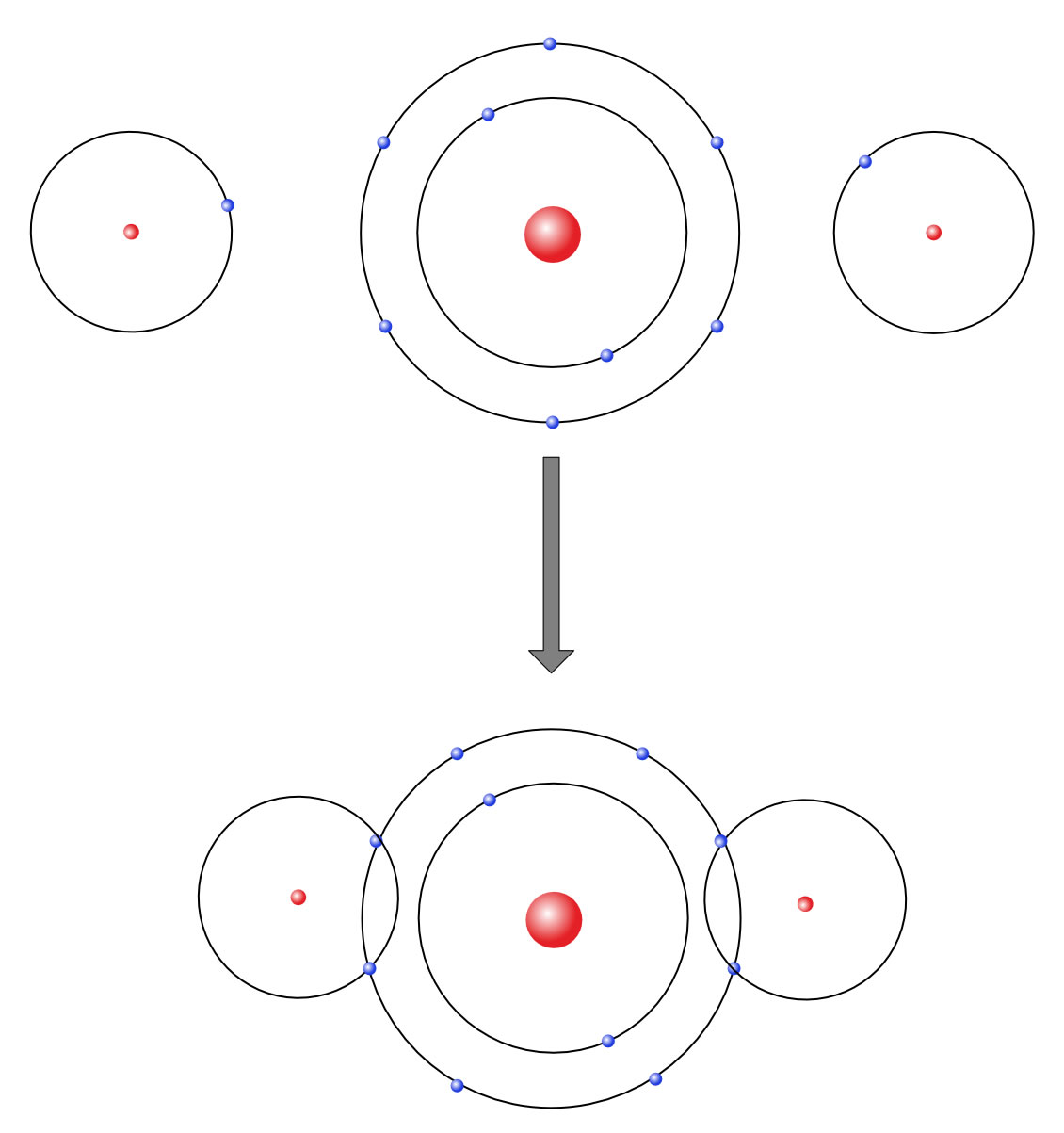
Eine Begründung für Struktur B nach dem Schalen-Modell des Atoms
Mit dem Schalenmodell könnte man also alle möglichen Strukturen des Wasser-Moleküls begründen, aber das Schalenmodell liefert keine Begründung für die tatsächliche gewinkelte Struktur des Wasser-Moleküls.
Auch die Struktur anderer Moleküle kann das Schalen-Modell nicht erklären. Nehmen wir als Beispiel das Methan.
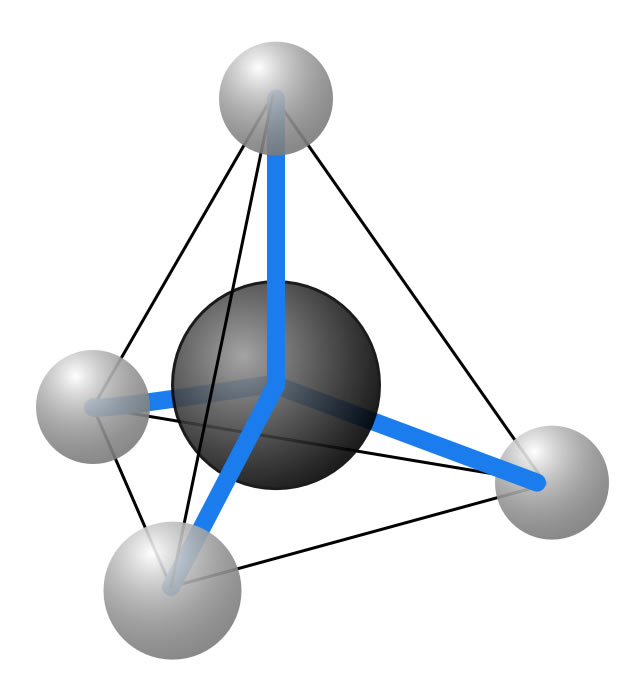
Das Methan-Molekül
In der Mitte des Methan-Moleküls befindet sich ein Kohlenstoff-Atom (schwarz gezeichnet). Dieses C-Atom ist von vier Wasserstoff-Atomen umgeben. Geometrisch gesehen, befinden sich die vier H-Atome in den vier Ecken eines Tetraeders, das C-Atom sitzt genau in der Mitte dieses Tetraeders. Einen Tetraeder kann man sich übrigens zur Veranschaulichung selbst herstellen, indem man vier gleichseitige Dreiecke ausschneidet und zusammenklebt.
Warum das CH4-Molekül diese Tetraeder-Gestalt hat, kann das Schalen-Modell nicht erklären. Nach diesem einfachen Atommodell könnten sich die vier H-Atome auch genau so gut in den vier Ecken eines Quadrates befinden und das C-Atom in der Mitte dieses Quadrates.
Das Schalen-Modell des Atoms kann viele chemische Phänomene erklären, aber die Struktur von Molekülen wie beispielsweise von Wasser oder Methan kann das Schalen-Modell nicht erklären!
Eine Erweiterung des Schalen-Modells
Das Kugelwolken-Modell stellt eine Erweiterung des Schalen-Modells dar, so dass man die räumliche Gestalt von Molekülen erklären kann. Schauen wir uns doch einfach mal das Kohlenstoff-Atom näher an, einmal ist es nach dem Schalen-Modell dargestellt, und daneben nach dem neuen Kugelwolken-Modell:
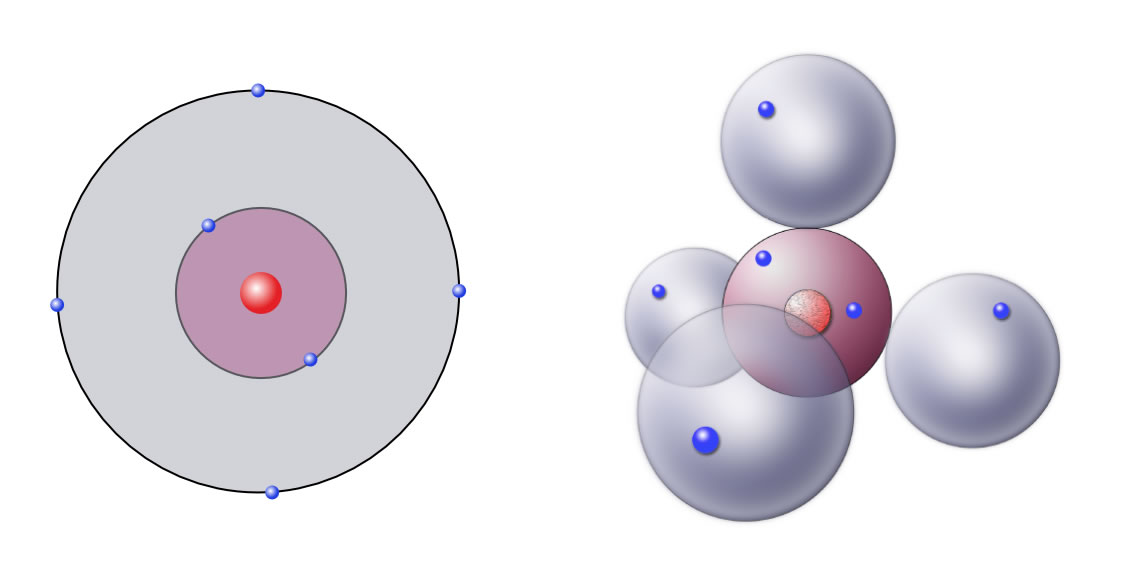
Links: Das C-Atom im Schalenmodell
Rechts: Das C-Atom im Kugelwolkenmodell
Das sieht ja auf den ersten Blick echt komisch aus! Dabei ist die Sache ganz einfach: Die Elektronen der Außenschale des C-Atoms befinden sich im Kugelwolkenmodell nicht mehr alle auf der gleichen Außenschale, sondern es gibt vier Bereiche in der Elektronenhülle, in denen sich die Elektronen aufhalten können. Diese vier Bereiche haben eine kugelförmige Gestalt und heißen Kugelwolken. "Wolken" deshalb, weil die Außengrenzen dieser vier Bereiche nicht scharf sind, sondern wie bei einer Regenwolke ziemlich verwischt oder unscharf.
Jede Kugelwolke kann maximal zwei Elektronen aufnehmen. Da das C-Atom nur vier Außenelektronen hat, befindet sich in jeder der vier Kugelwolken nur je ein Elektron.
Die nächste Abbildung zeigt das Stickstoff-Atom und das Sauerstoff-Atom nach dem Kugelwolkenmodell:
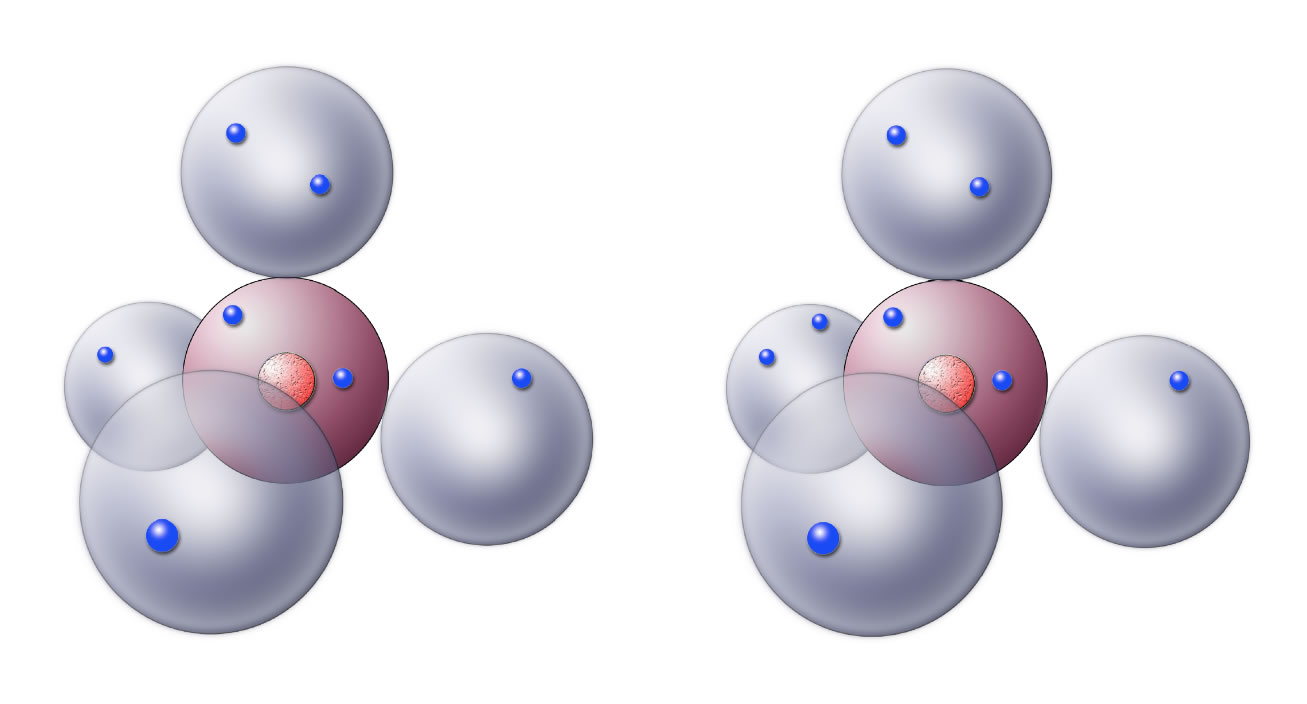
Links: Das N-Atom im Kugelwolkenmodell
Rechts: Das O-Atom im Kugelwolkenmodell
Die fünf Außenelektronen des Stickstoff-Atoms verteilen sich auf die vier Kugelwolken. Eine Kugelwolke nimmt zwei Elektronen auf, die drei anderen Kugelwolken enthalten je ein Elektron.
Beim Sauerstoff-Atom ist es so, dass zwei Kugelwolken doppelt besetzt sind, also je zwei Elektronen enthalten. Die beiden anderen Kugelwolken enthalten nur ein Elektron.
Der Bau des Fluor-Atoms und des Neon-Atoms sollte jetzt eigentlich schon klar sein. Fluor hat sieben Außenelektronen, also werden drei Kugelwolken doppelt besetzt sein, und Neon hat acht Außenelektronen, daher sollten alle vier Kugelwolken je zwei Elektronen enthalten.
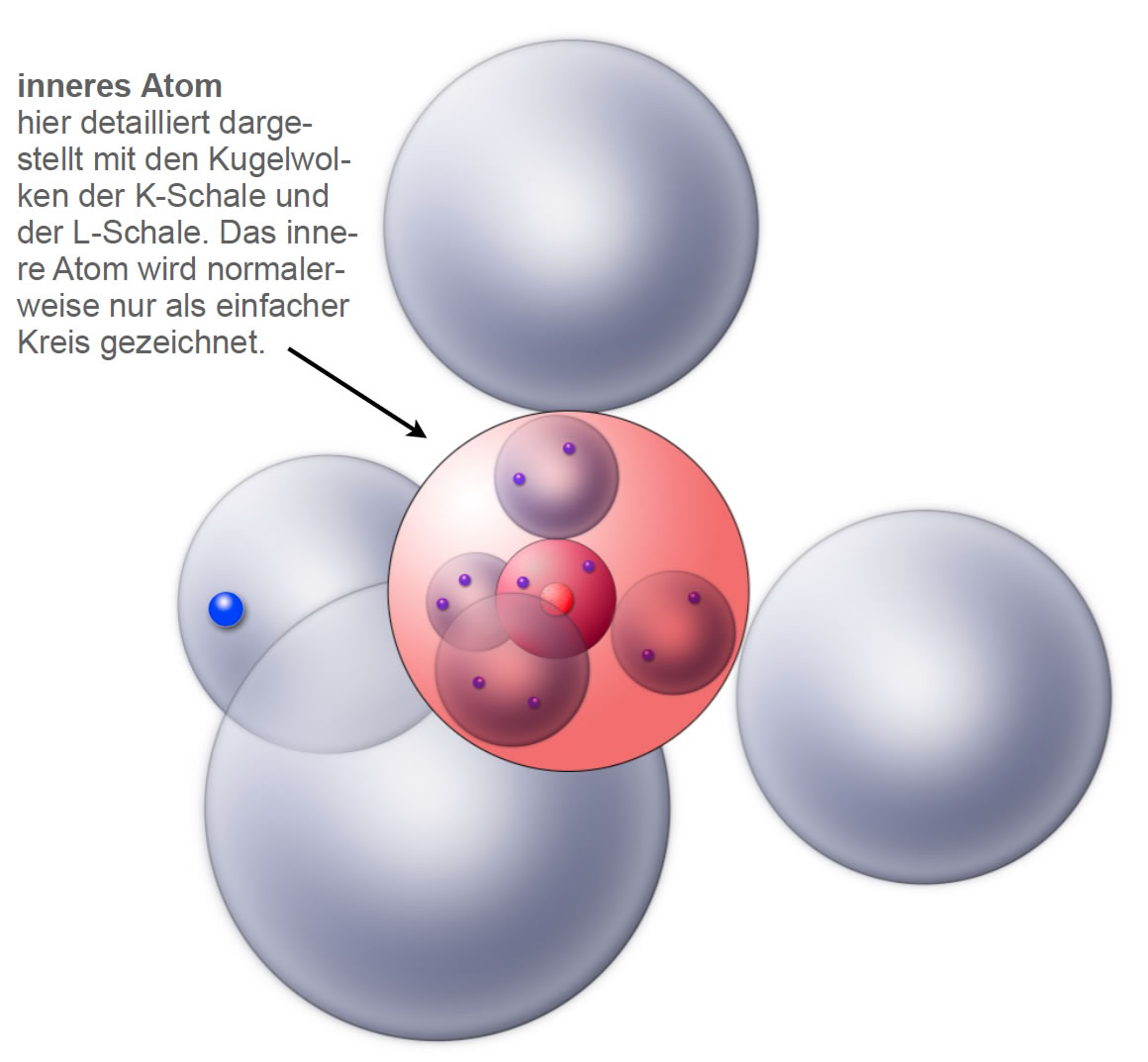
Das Natrium-Atom im Kugelwolkenmodell
Das Natrium-Atom hat nach dem Schalenmodell drei besetzte Schalen. Die K-Schale enthält zwei Elektronen, die L-Schale acht und die äußere M-Schale ein Elektron. Nach dem Kugelwolkenmodell besteht die K-Schale aus einer Kugelwolke, die den Atomkern symmetrisch umgibt. Die L-Schale besteht aus vier Kugelwolken, die das "innere Atom", also den Kern und die K-Schale, tetraederförmig umgeben. Die Tetraedergestalt hatten wir ja schon weiter oben bei der Besprechung des Methan-Moleküls kennen gelernt (Abbildung 4). Die M-Schale besteht ebenfalls aus vier Kugelwolken, welche das "innere Atom" (Kern, K-Schale, L-Schale) tetraederförmig umgeben. Allerdings ist nur eine dieser vier Kugelwolken mit einem Elektron besetzt, die anderen drei Kugelwolken sind leer.
In manchen Büchern werden leere Kugelwolken überhaupt nicht gezeichnet. Wenn eine Kugelwolke kein Elektron enthält, existiert sie im Grunde auch gar nicht.
Für Experten
Die Kugelwolke ist ja kein scharf umrissener Raum, sondern bezeichnet einen Bereich innerhalb des Atoms, in dem man mit einer bestimmten Wahrscheinlichkeit ein Elektron antreffen kann. Man spricht hier auch von Aufenthaltsräumen oder Orbitalen. Wenn ein solcher Aufenthaltsraum leer ist, sich also kein Elektron in ihm aufhält, ist die Wahrscheinlichkeit, hier ein Elektron anzutreffen, auch Null. Das ist der Grund dafür, dass solche leeren Kugelwolken oft gar nicht gezeichnet werden.
Didaktisch macht es aber schon Sinn, auch die leeren Kugelwolken zu zeichnen. So versteht jeder ohne Probleme, dass in dem Atom noch genug Platz für weitere Elektronen ist.
Warum sind nun diese vier Kugelwolken beim Kohlenstoff-Atom tetraedrisch um das "innere Atom" gruppiert?
Jede Kugelwolke enthält Elektronen, und Elektronen stoßen sich wegen ihrer negativen Ladung gegenseitig ab. Damit ein Zustand mit möglichst geringer Energie ("energetisch günstig") erreicht wird, versuchen sich, diese Elektronen so weit wie möglich aus dem Weg zu gehen. In der Tetraedergestalt sind die Abstände zwischen den vier Kugelwolken maximal, in allen anderen geometrischen Anordnungen kommen sich die Kugelwolken näher.
Vereinfachte Darstellung der Atome
Wenn man sich die Abbildung 7 mit dem Natrium-Atom anschaut, hat man ja regelrecht Angst davor, selbst Atome nach dem Kugelwolkenmodell zu zeichnen. Erst muss man den Atomkern malen, dann die K-Schale mit den beiden Elektronen, dann die vier Kugelwolken der L-Schale mit den acht Elektronen und schließlich die vier Kugelwolken der M-Schale.
Das muss nicht sein, es geht einfacher, und das ist auch das Schöne an dem Kugelwolkenmodell. Man kann den Atomkern und alle inneren Schalen einfach zu einem "inneren Atom" zusammenfassen. Dieses innere Atom wird dann als simpler Kreis gezeichnet, in den man das Elementsymbol hineinschreibt. Man muss dann nur noch die vier äußeren Kugelwolken zeichnen.
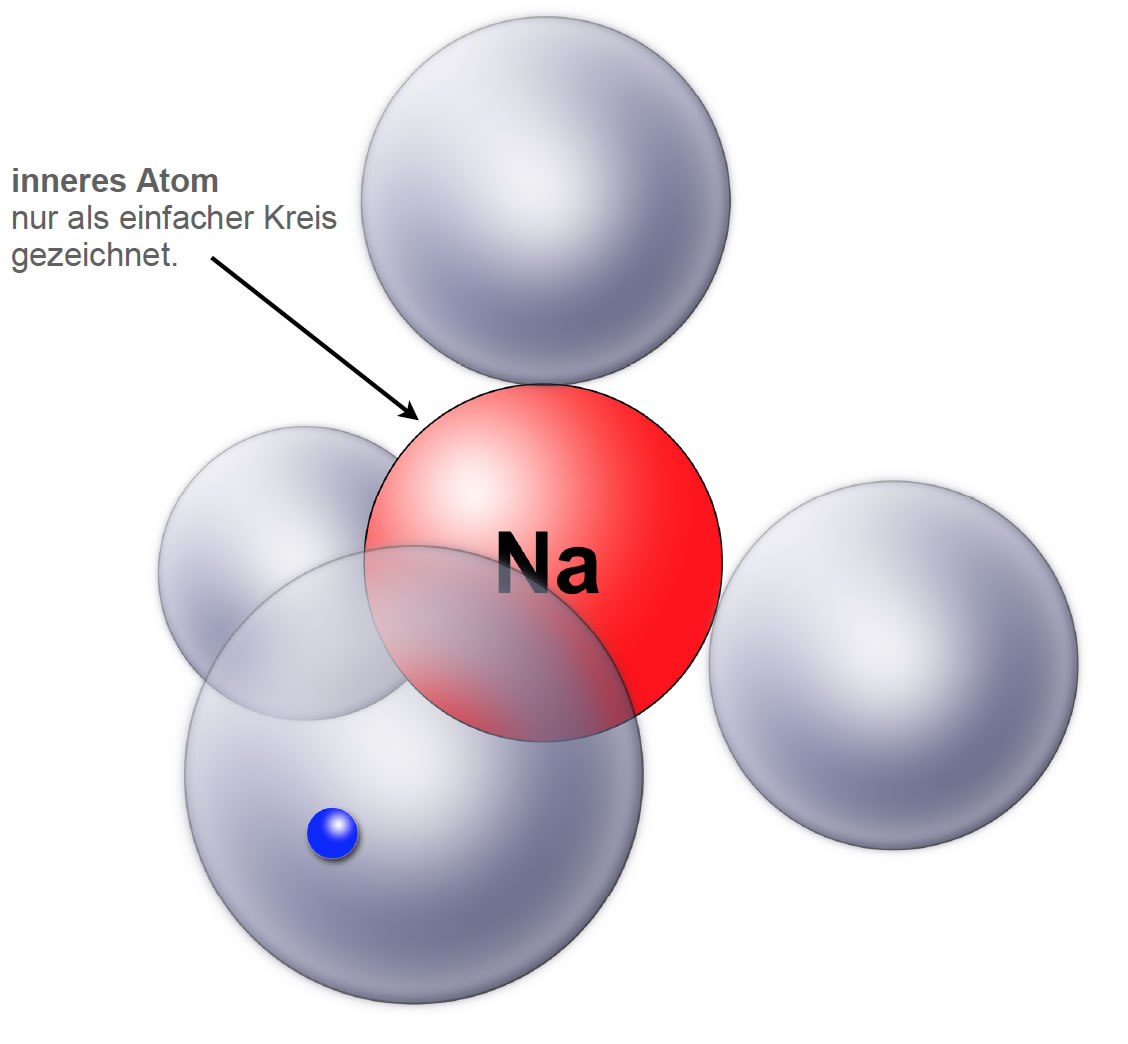
Vereinfachte Darstellung des Natrium-Atoms nach dem Kugelwolkenmodell
Auf dem Papier kann das Atom auch noch einfacher dargestellt werden, die dreidimensionalen Schattierungen bzw. Farbverläufe sind nicht nötig, es reichen einfache Kreise. Allerdings sollte man darauf achten, dass eine der Kugelwolken ganz vorne liegt und eine andere ganz hinten. Das kann man auch auf dem Papier leicht durch unterschiedlich große Kreise darstellen.
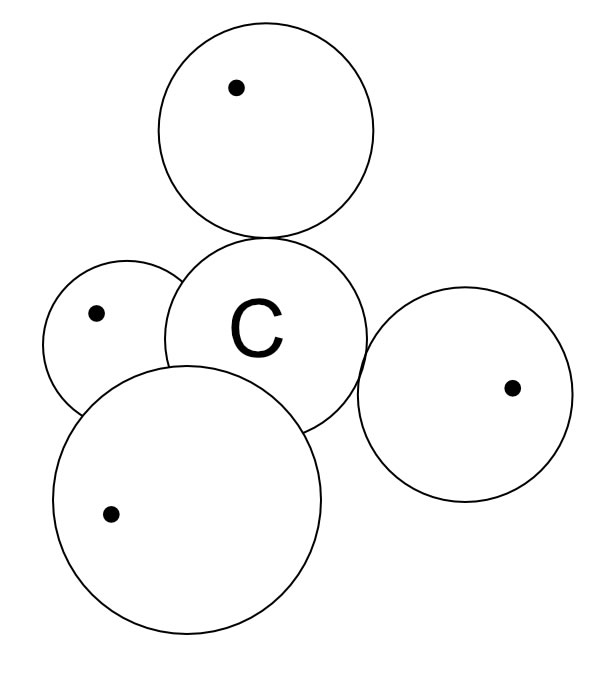
Einfache Darstellung des C-Atoms
So könnte man das Kohlenstoff-Atom mit Bleistift und Papier ganz einfach darstellen.
Seitenanfang -
weiter mit der
Elektronenpaarbindung