Unpolare und polare Bindungen
Nachdem wir einige wichtige Moleküle behandelt haben, konzentrieren wir uns noch einmal auf die kovalente Bindung (Elektronenpaarbindung, Molekülbindung) selbst.
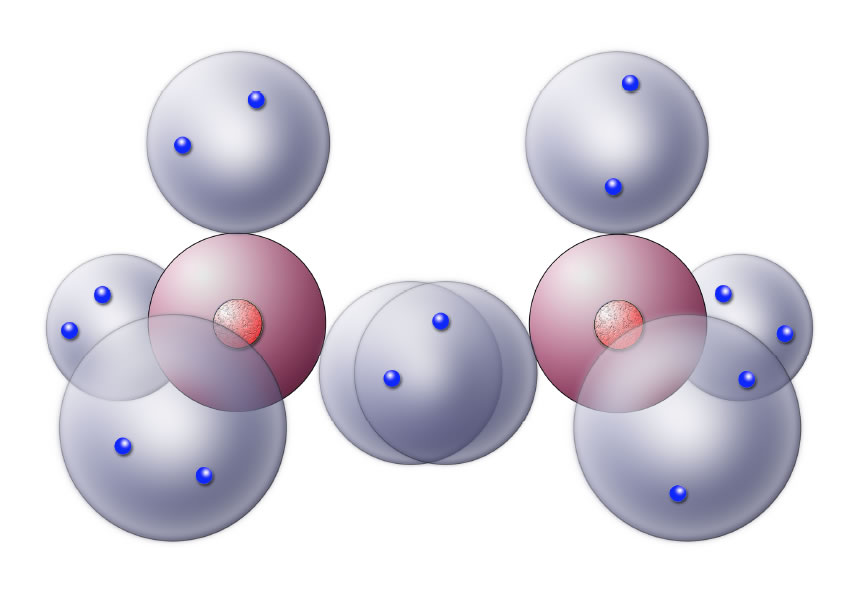
Das Chlor-Molekül Cl2
Im Cl2-Molekül ziehen die beiden gleichen Chlor-Atomkerne die beiden Bindungselektronen gleich stark an. Es gibt also keinen Grund dafür, dass sich die Bindungselektronen eher auf der einen oder auf der anderen Seite der bindenden Kugelwolke aufhalten. Die kovalente Bindung in dem Cl2-Molekül hat keinen Plus- und keinen Minuspol. Daher spricht man hier von einer unpolaren kovalenten Bindung.
Die Begriffe polar/unpolar
Die kovalente Bindung im Cl2-Molekül heißt unpolar, weil es keinen Pluspol und keinen Minuspol innerhalb dieser Kugelwolke gibt.
Am besten verdeutlicht man diesen Begriff, indem man einfach mal das Gegenteil beschreibt, nämlich eine polare Bindung.
Wir ersetzen jetzt das eine Chlor-Atom des Cl2-Moleküls durch ein Fluor-Atom und erhalten ein FCl-Molekül. Fluor-Atome sind kleiner als Chlor-Atome, sie ziehen Bindungselektronen daher stärker an (wegen der geringeren Entfernung zum Atomkern). Man sagt auch, Fluor-Atome besitzen eine größere Elektronegativität (= die Fähigkeit, Bindungselektronen anzuziehnen).
Im FCl-Molekül könnte man dann vielleicht feststellen, dass sich jedes der beiden Bindungselektronen zu 60% der Zeit in der Nähe des F-Atoms aufhält und nur zu 40% der Zeit in der Nähe des Cl-Atoms. Die bindende Kugelwolke hätte dann ein negatives Ende (am F-Atom) und ein positives Ende (am Cl-Atom). Die kovalente Bindung hätte dann also zwei Pole, einen Minuspol und einen Pluspol. Eine solche Bindung würde man dann als polare kovalente Bindung (oder kurz polare Bindung) bezeichnen.
Das H2O-Molekül ist ein Dipol
Werfen wir nun einen engeren Blick auf das Wasser-Molekül. Im H2O-Molekül haben wir zwei O-H-Bindungen. Da Sauerstoff-Atome eine höhere Elektronegativität haben als Wasserstoff-Atome, sind beide O-H-Bindungen polare Bindungen, der Minuspol befindet sich dabei am Sauerstoff-Atom, während die beiden H-Atome die Pluspole darstellen.
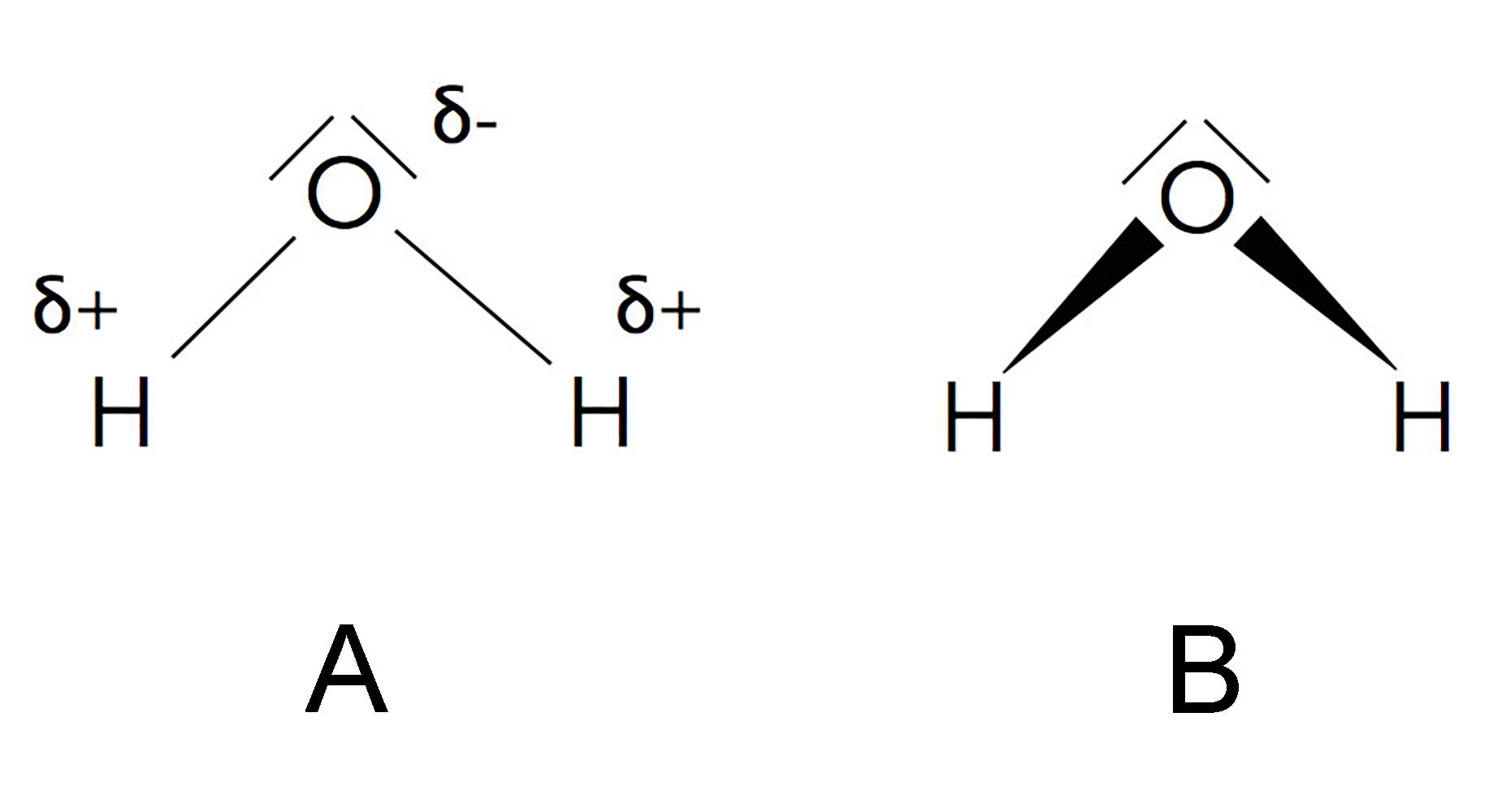
Zwei Möglichkeiten der Darstellung eines Wasser-Dipols
| Dieses Bild zeigt zwei verschiedene Möglichkeiten, diese Tatsache graphisch darzustellen. Links werden die Plus- und Minuspole des H2O-Moleküls durch den griechischen Buchstaben δ (delta), gefolgt von einem Plus- oder Minuszeichen gekennzeichnet: δ- am Sauerstoff-Pol, δ+ an den beiden Wasserstoff-Polen. | Rechts sehen wir eine andere Darstellung. Die Keile zwischen den Atomen sollen die Elektronendichte veranschaulichen. Am Sauerstoff-Atom ist die Elektronendichte innerhalb der polaren kovalenten Bindung sehr groß (weil sich die Bindungselektronen hier öfter aufhalten). An den Wasserstoff-Enden dagegen ist die Elektronendichte relativ gering (hier halten sich die Bindungselektronen nicht so oft auf). |
Ein Beweis für den Dipol-Charakter des Wassers
Mit einem ganz simplen Schulversuch kann man den Dipol-Charakter der Wasser-Moleküle beweisen. Man lässt aus einer Bürette einen dünnen Wasserstrahl in ein Becherglas laufen. Man muss nur darauf achten, dass der Abstand zwischen der Bürettenspitze und dem oberen Rand des Becherglases sehr groß ist, so um die 20 bis 30 cm.
Während das Wasser in das Becherglas läuft, hält man nun einen elektrisch aufgeladenen Gegenstand in die Nähe des Wasserstrahls. Der Gegenstand darf den Wasserstrahl allerdings nicht berühren! Mit Overhead-Folien oder dünnen durchsichtigen Folien, in die manche Gegenstände verpackt werden, gelingt dieser Versuch meistens.
Wenn man nun die elektrisch aufgeladene Folie in die Nähe des Wasserstrahls bringt, verbiegt sich der Strahl plötzlich auf seltsame Weise. Er wird durch die Ladung der Folie abgelenkt.
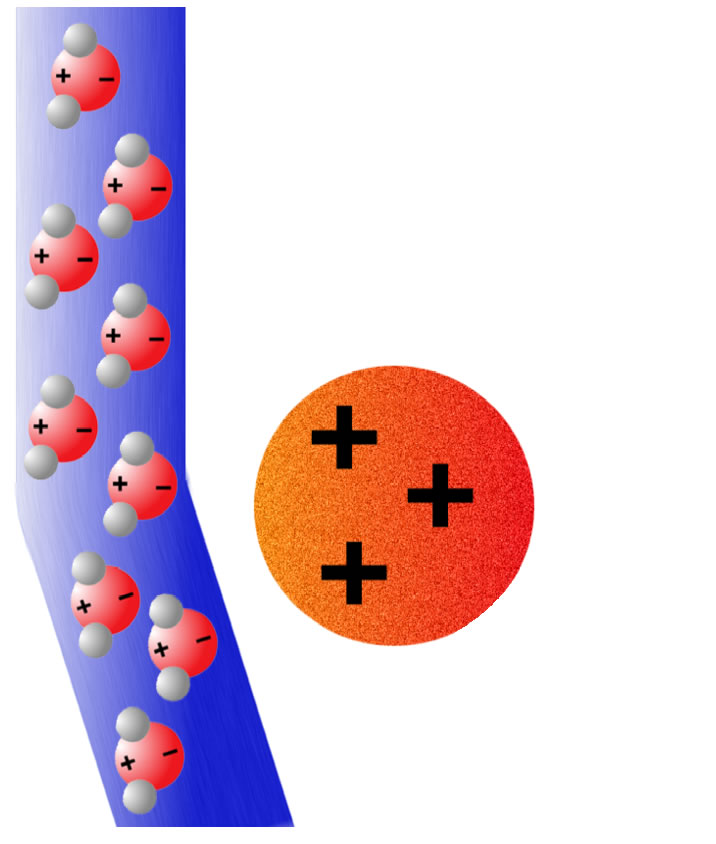
Ablenkung des Wasserstrahls
Hier sehen wir eine Schemazeichnung, die die Ablenkung eines Wasserstrahls durch einen positiv geladenen Kunststoff-Stab verdeutlicht.
Jedes Wasser-Molekül ist ein elektrischer Dipol, hat also ein positives und ein negatives Ende. Wenn der Kunststoff-Stab positiv geladen ist, orientieren sich alle Wasser-Moleküle im Wasserstrahl so, dass sie ihr negatives Ende zum positiven Stab hin ausrichten. Positiv und negativ ziehen sich an. Daher wird der Wasserstrahl von dem positiven Stab angezogen.
Kleine Denk-Aufgabe
Wenn der Wasserstrahl von einem positiven Gegenstand angezogen wird, müsste er dann nicht von einem negativen Gegenstand abgestoßen werden?
Führt man diesen Versuch mit einem negativ aufgeladenem Gegenstand durch, wird der Wasserstrahl ebenfalls angezogen. Auf den ersten Blick mag das widersprüchlich und vielleicht sogar unsinnig erscheinen. Aber überlegen wir mal weiter.
Die Wasser-Moleküle sind ja frei beweglich in dem Wasserstrahl, sie können sich in alle Richtungen drehen und bewegen. Wenn nun ein negativ geladener Stab in die Nähe des Strahls gehalten wird, drehen sich die Wasser-Moleküle mit ihren negativen Ende zum positiven Stab hin. So werden sie wieder von dem Stab elektrisch angezogen, und der Wasserstrahl biegt sich wieder in Richtung des Stabes.
Seitenanfang -
weiter mit der Elektronegativität