Das Chlormolekül
Mit dem Kugelwolkenmodell kann man die Ionenbindung nicht besser erklären als mit dem Schalenmodell; das Kugelwolkenmodell wird eigentlich erst gebraucht, wenn man Molekülverbindungen wie Wasser, Ammoniak, Methan, Ethanol etc. behandeln will.
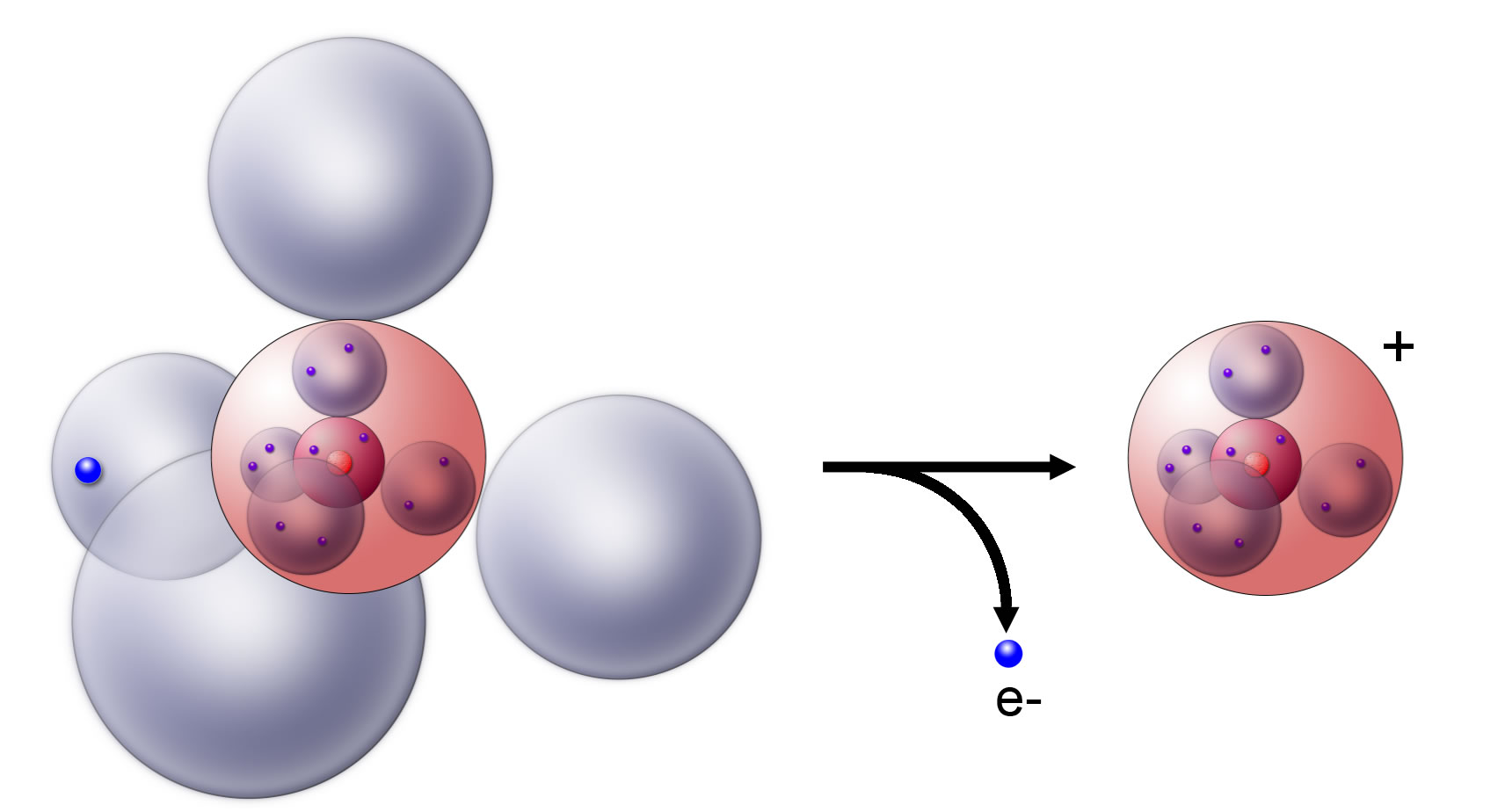
Das Natrium-Atom gibt sein Außenelektron ab
Die Abbildung 1 zeigt, wie das Natrium-Atom sein Außenelektron abgibt, und zwar mit Hilfe einer Kugelwolkenmodell-Darstellung. An sich völlig unnötig, dieser Aufwand, eine Darstellung mit Hilfe des Schalenmodells hätte hier völlig gereicht. Aber wenn man sich erst mal an das Kugelwolkenmodell gewöhnt hat, verwendet man es eigentlich immer, auch dann, wenn das Schalenmodell ausreichen würde.
Das Element Chlor kommt in der Natur immer zweiatomig vor als Cl2. Wieso eigentlich?
Ein Chlor-Atom hat sieben Außenelektronen, es hätte aber gern acht. Nun könnte - rein theoretisch - ein Chlor-Atom eines seiner Außenelektronen an ein zweites Chlor-Atom abgeben. Das zweite Chlor-Atom hätte dann tatsächlich acht Außenelektronen, wäre dann allerdings negativ geladen. Das erste Chlor-Atom aber hätte nur noch sechs Außenelektronen und wäre damit noch weiter vom erstrebten Edelgaszustand entfernt als vorher. Außerdem wäre es positiv geladen und würde dann das negativ geladene Chlorid-Ion sofort anziehen. Dann hätten wir eine Ionenbindung. Stoffe, deren Teilchen durch Ionenbindungen zusammengehalten werden, sind bei Zimmertemperatur meistens fest, bis auf wenige Ausnahmen. Es handelt sich nämlich um Salze wie NaCl, MgO und so weiter, die ja sogar recht hohe Schmelztemperaturen haben, wie wir schon gesehen haben.
Chlor ist aber bei Zimmertemperatur kein festes Salz, sondern ein Gas, und die Chlor-Moleküle bestehen immer aus zwei Chlor-Atomen. Wie kann man das erklären?
Zeichnen wir doch einfach mal zwei Chlor-Atome:
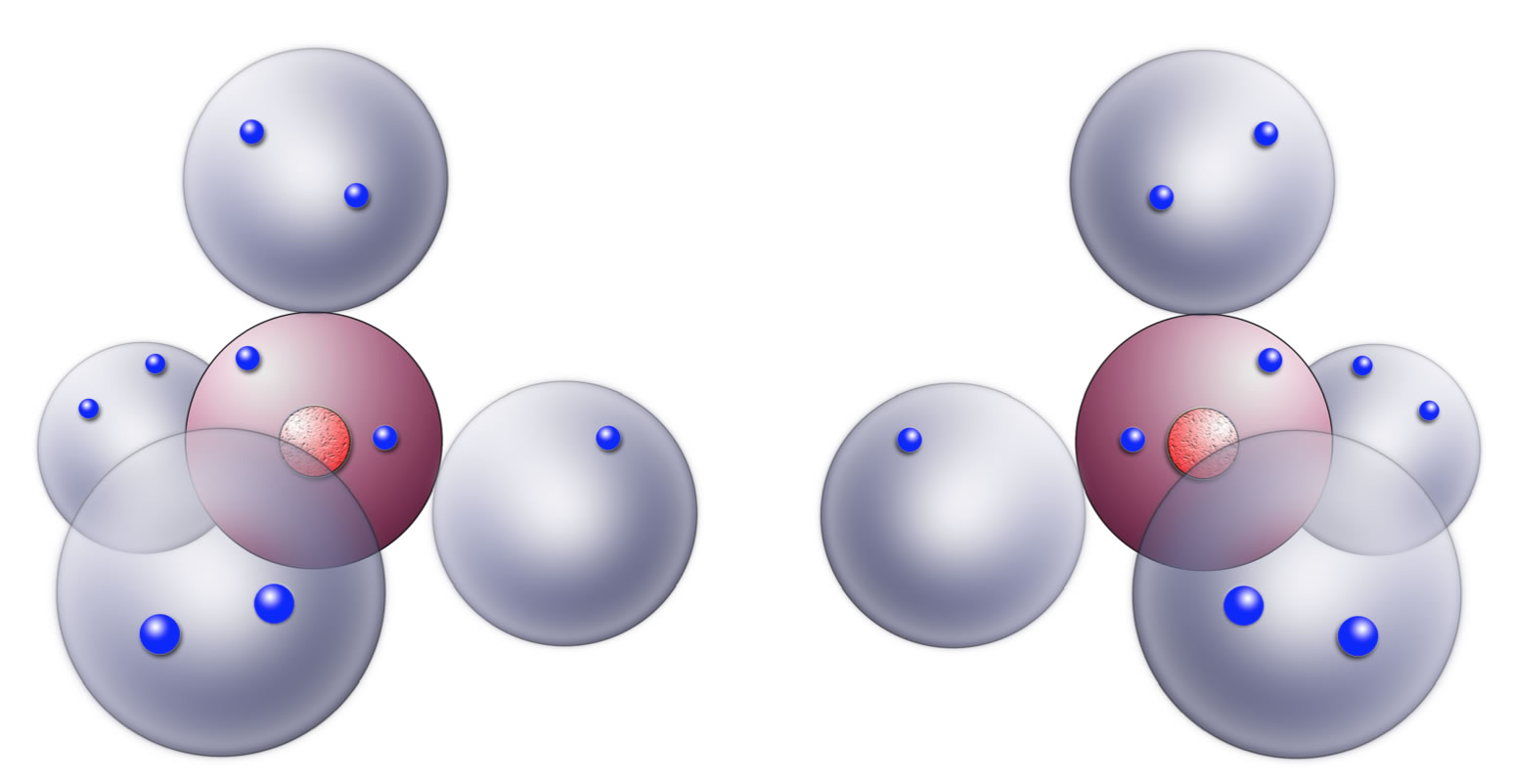
Zwei Chlor-Atome
Die beiden Chlor-Atome "wollen" jede Kugelwolke mit zwei Elektronen besetzt haben, das wäre dann der Edelgaszustand. Drei Kugelwolken besitzen bereits zwei Elektronen, aber die vierte Kugelwolke eines Chlor-Atoms ist mit nur einem Elektron besetzt. Ein Elektronentransfer von einem Chlor-Atom zum anderen würde zu einem festen Ionenkristall führen. Dieser Weg scheidet also aus.
Gibt es noch eine andere Möglichkeit, durch die jede einfach besetzte Kugelwolke zu einer doppelt besetzten werden könnte?
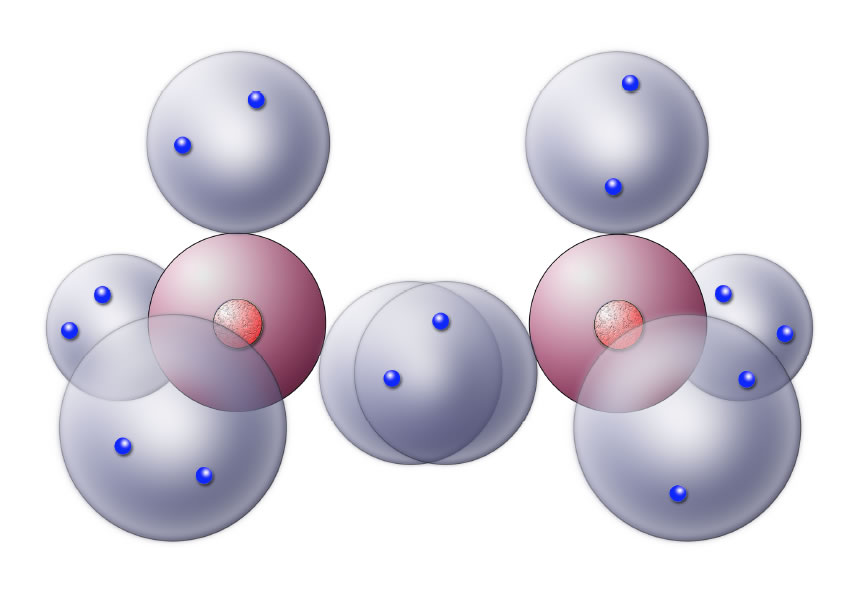
Die Bildung eines Chlor-Moleküls
Die eine einfach besetzte Kugelwolke vereinigt sich mit der anderen einfach besetzten Kugelwolke. Es bildet sich eine zweifach besetzte Kugelwolke, die beiden Chlor-Atomen gemeinsam gehört. Jedes Chlor-Atom hat dadurch vier doppelt besetzte Kugelwolken und hat somit den Edelgaszustand erreicht.
Fachbegriffe
Jetzt kommen wieder ein paar Fachbegriffe. Die gemeinsamen Elektronen in der gemeinsamen Kugelwolke werden als gemeinsames Elektronenpaar bezeichnet oder auch als Bindungselektronen. Die beiden Elektronen halten sozusagen die beiden Atome zusammen, daher der Begriff "Bindungselektronen". Die Art der chemischen Bindung, die wir hier sehen, unterscheidet sich recht stark von der bisher bekannten Ionenbindung. Diese chemische Bindung ist genau so stark wie die Ionenbindung, hat aber mehrere andere Namen. Die bekanntesten Namen sind Elektronenpaarbindung, kovalente Bindung oder Molekülbindung.
Zusammen mit der Ionenbindung gehört die Elektronenpaarbindung zu den starken chemischen Bindungen. Auch die metallische Bindung, die wir noch nicht besprochen haben, gehört zu den starken chemischen Bindungen. Neben den starken chemischen Bindungen gibt es auch die schwachen chemischen Bindungen. Dazu gehören die van-der-Waals-Kräfte, die Dipol-Bindungen und die Wasserstoffbrücken-Bindungen, die auch in einem der folgenden Kapitel besprochen werden.
Die Elektronenpaarbindung im Detail ↑
Wir wollen uns jetzt mit einer Frage beschäftigen, die garantiert keinen Alltagsbezug hat, sondern "nur" von theoretischem Interesse ist und dem Training der grauen Zellen dient (was ja auch ganz interessant sein kann).
Wieso können die beiden Bindungselektronen überhaupt die beiden Chlor-Atome zusammenhalten? Wie kommt es zu der chemischen Bindung?
Die beiden Elektronen stoßen sich doch eigentlich gegenseitig ab; und auch die positiven Atomkerne stoßen sich ab. Müssten dann nicht die beiden Chlor-Atome auseinanderfliegen?
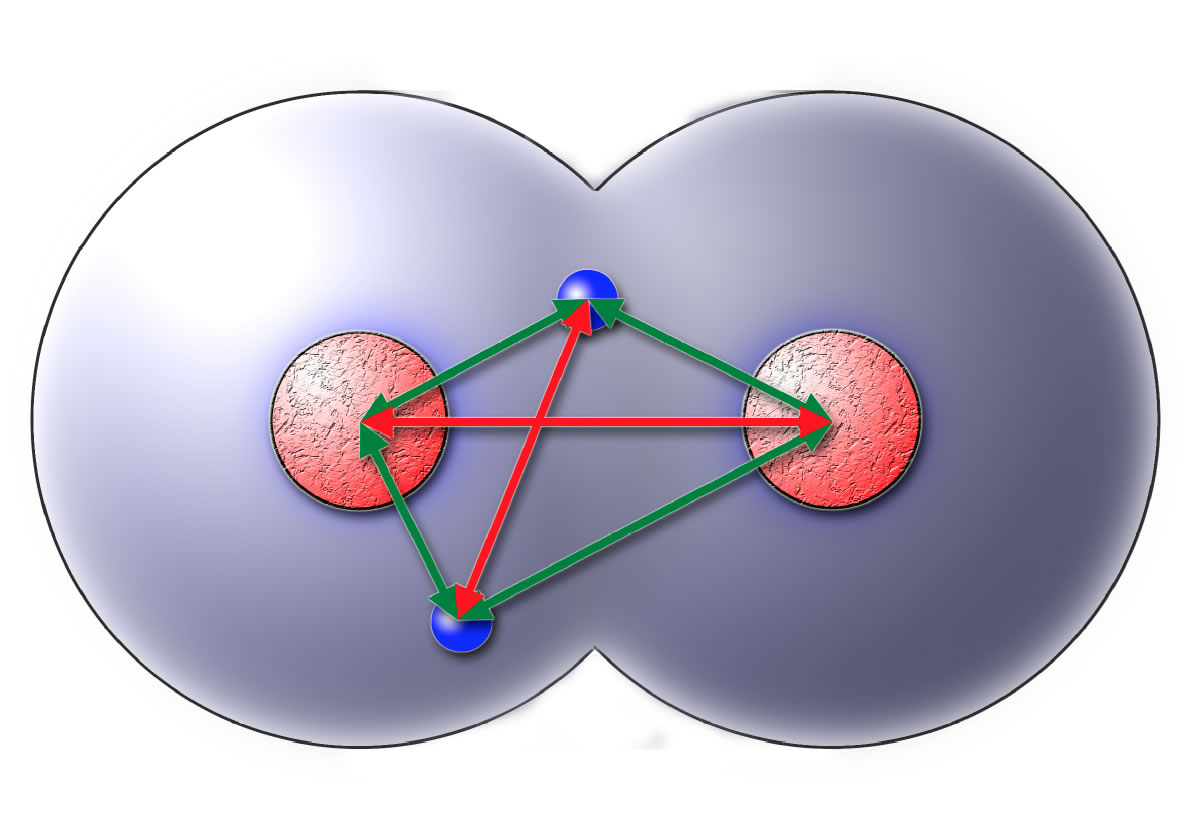
Das H2-Molekül im Kugelwolkenmodell
In diesem Bild ist das Wasserstoff-Molekül nach dem Kugelwolkenmodell dargestellt. Jedes H-Atom hat nur eine Kugelwolke, die den Atomkern (das Proton) symmetrisch umgibt. Diese Kugelwolke ist mit einem Elektron besetzt. Im Wasserstoff-Molekül vereinigen sich nun die Kugelwolken von zwei H-Atomen zu einer größeren gemeinsamen Kugelwolke mit einem gemeinsamen Elektronpaar.
Die roten und grünen Pfeile sollen die Abstoßungs- bzw. Anziehungskräfte innerhalb des H2-Moleküls verdeutlichen. Die beiden positiven Atomkerne stoßen sich ab, und die beiden Elektronen stoßen sich ebenfalls ab. Also haben wir es hier mit insgesamt zwei Abstoßungskräften zu tun (rote Pfeile). Jeder Atomkern zieht beide Elektronen an, das sind zusammen vier Anziehungskräfte. Insgesamt überwiegen also die Anziehungskräfte in diesem System.
Gut, das ist natürlich eine extrem starke Vereinfachung, aber im Prinzip ist diese Vereinfachung korrekt. Die beiden Elektronen wirken sozusagen als "Kitt", der die beiden Atomkerne zusammenhält. Darum ist die Bezeichung bindendes Elektronenpaar oder Bindungselektronen durchaus korrekt.
Seitenanfang -
weiter mit
Molekülstrukturen