Ein Wasser-Molekül besteht aus einem stark elektronegativen Sauerstoff-Atom und zwei schwach elektronegativen Wasserstoff-Atomen.
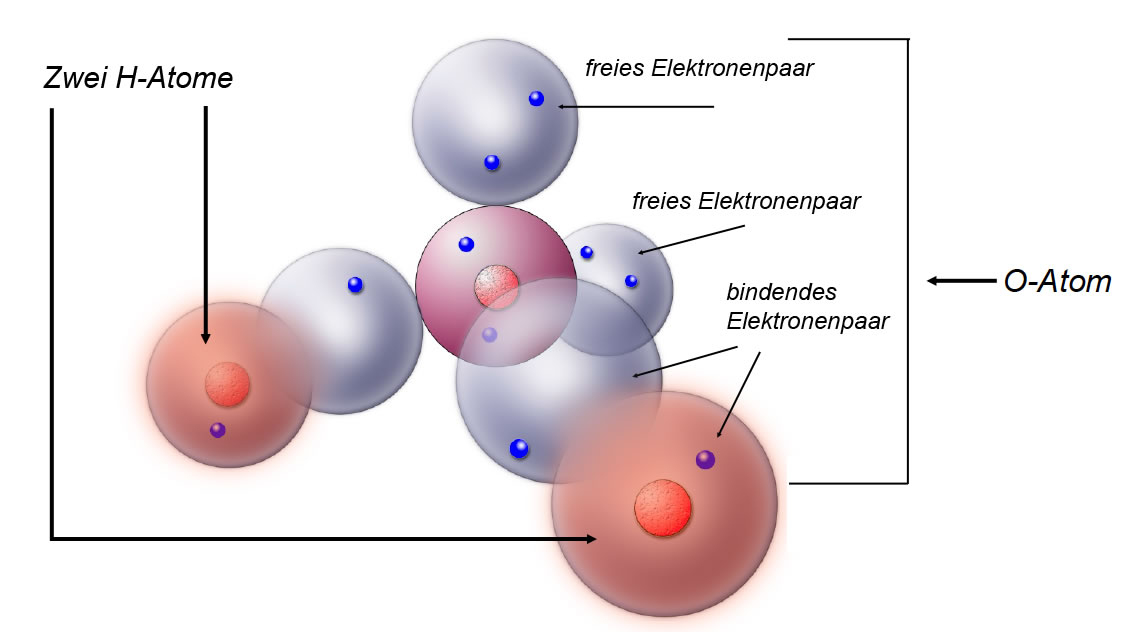
Ein Wasser-Molekül, dargestellt nach dem Kugelwolkenmodell
Autor: Ulrich Helmich, Lizenz: Public domain
Hier sehen wir eine Zeichnung des Wasser-Moleküls nach dem Kugelwolkenmodell. Ein H-Atom besitzt eine einfach besetzte Kugelwolke, die nach einem zweiten Elektron strebt. Ein O-Atom hat zwei doppelt besetzte Kugelwolken (freie Elektronenpaare) und zwei einfach besetzte Kugelwolken, die ebenfalls nach einem zweiten Elektron streben. Bei der Bildung des Wasser-Moleküls überlappen nun je eine einfach besetzte H-Kugelwolke und eine einfach besetzte O-Kugelwolke zu einer gemeinsamen Kugelwolke mit einem bindenden Elektronenpaar.
Die O-H-Bindungslänge im Wasser-Molekül beträgt 96,5 pm, der H-O-H-Bindungswinkel 104,5º.
Eigentlich sollte der Bindungswinkel 109,5 Grad betragen (Winkel eines perfekten Tetraeders), aber am Sauerstoff-Atom sitzen noch zwei freie Elektronenpaare, und die negativen Ladungen dieser Elektronenpaare drücken die Elektronenpaare der kovalenten O-H-Bindungen etwas zusammen, so dass sich der Bindungswinkel von 109,5 Grad auf 104,5 Grad verkleinert.
Wegen der hohen Elektronegativität des O-Atoms halten sich die Bindungselektronen der O-H-Bindung statistisch gesehen öfter in der Nähe des O-Atoms auf als in der Nähe des H-Atoms. Daher ist die O-H-Bindung polarisiert; der Sauerstoff bildet dabei das negative Ende, der Wasserstoff das positive Ende.
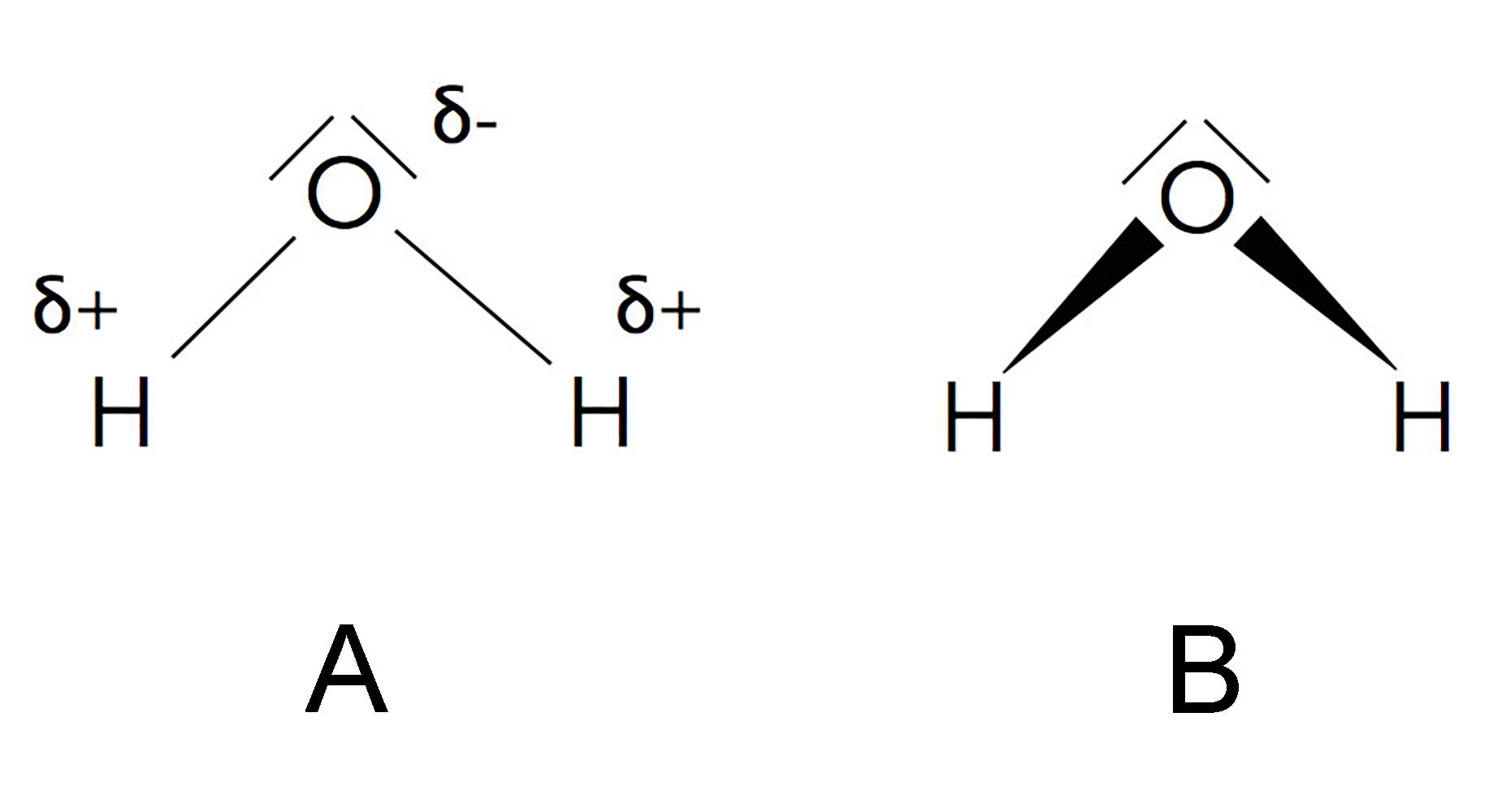
Zwei Möglichkeiten der Darstellung der Polarität von Wasser-Molekülen
Aufgrund des Bindungswinkels addieren sich die Dipolmomente der beiden O-H-Bindungen, so dass das Wasser-Molekül insgesamt ein recht kräftiger Dipol ist. Allerdings ist das Fluorwasserstoff-Molekül wegen der extrem hohen Elektronegativität des Fluor-Atoms ein noch viel stärkerer Dipol als das Wasser-Molekül, dennoch hat Fluorwasserstoff mit +16 ºC einen wesentlich niedrigeren Siedepunkt als Wasser mit +100 ºC.
Wasser-Moleküle bilden Wasserstoffbrücken-Bindungen
Der Grund hierfür ist in der Tatsache zu suchen, dass Wasser-Moleküle mit jeweils zwei anderen Wasser-Molekülen Wasserstoffbrücken-Bindungen (H-Brücken) eingehen können, während Fluorwasserstoff-Moleküle nur mit jeweils einem anderen HF-Molekül H-Brücken bilden können.
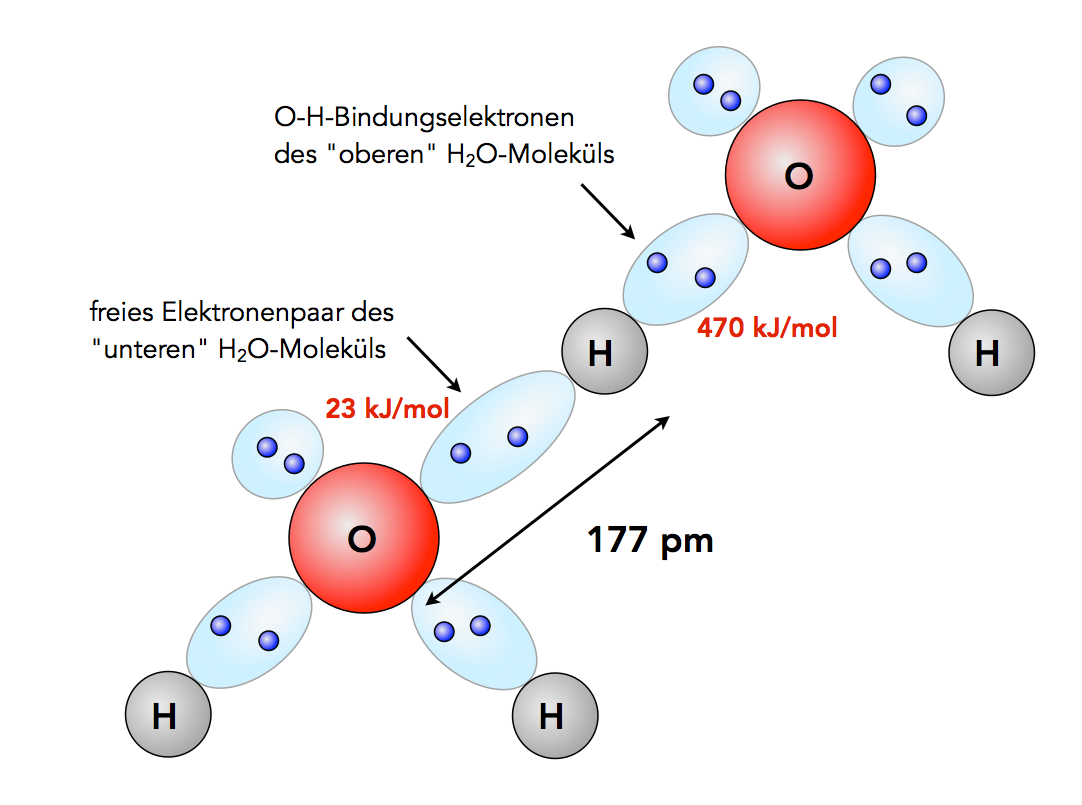
Zwei Wasser-Moleküle sind durch eine Wasserstoffbrücke miteinander verbunden
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Warum ist die H-Brücke stärker als eine reine elektrostatische Wechselwirkung bzw. Dipol-Dipol-Wechselwirkung? Betrachten wir dazu die obere Abbildung. Das positiv polarisierte H-Atom des "oberen" Wasser-Moleküls und das negativ polarisierte O-Atom des "unteren" Moleküle ziehen sich nicht nur elektrostatisch an. Achten Sie auf das freie Elektronenpaar des "unteren" Moleküls. Es hat Kontakt aufgenommen mit dem H-Atom des oberen Moleküls. Die Elektronenwolke (Kugelwolke, Orbital) ist jetzt aber recht langgestreckt, das heißt, die Elektronendichte innerhalb dieser Wolke hat abgenommen. Daher handelt es sich bei dieser Bindung nicht um eine echte kovalente Bindung, sondern um etwas Schwächeres. Die Bindungsenergie der H-Brücke beträgt nur 23 kJ/mol, während die Bindungsenergie einer normalen O-H-Bindung 470 kJ/mol beträgt, also mehr als das 20fache. Der kovalente Anteil einer H-Brücke beträgt ungefähr 10% [1].
Die Wasserstoffbrücken-Bindung ist also eine schwache chemische Bindung, besitzt aber einen gewissen kovalenten Anteil. Daher ist die H-Brücken-Bindung die stärkste der schwachen chemischen Bindungen.
Theoretisch kann jedes Wasser-Molekül mit vier benachbarten Wasser-Molekülen H-Brücken bilden. Jedes H-Atom kann sich mit einem freien Elektronenpaar eines anderen Moleküls verbinden, und jedes freie Elektronenpaar kann sich mit einem H-Atom eines anderen Moleküls verbinden:
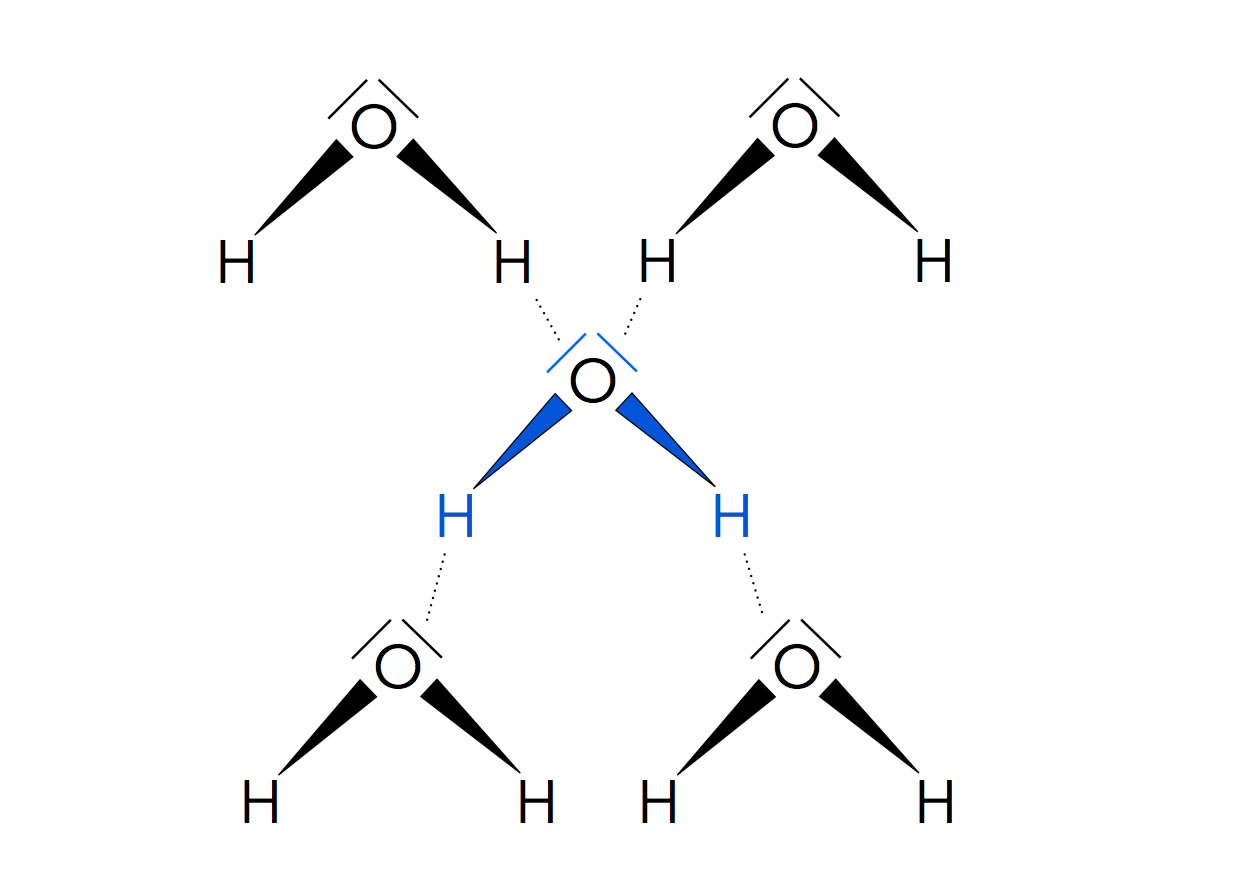
Ein Wasser-Molekül kann bis zu vier H-Brücken mit anderen Wasser-Molekülen ausbilden
Autor: Ulrich Helmich 2021, Lizenz: Public domain
In flüssigem Wasser sind die Wasser-Moleküle aber ständig in Bewegung, und H-Brücken sind nicht sehr lange beständig, nach maximal 20 ps (Picosekunden = 10-12 s) löst sich eine H-Brücke wieder auf. Daher bildet ein Wasser-Molekül bei Zimmertemperatur im Schnitt "nur" 3,4 H-Brücken mit anderen Wasser-Molekülen aus [1].
Im festen Eis dagegen bilden sich Kristalle, in denen die Wasser-Moleküle regelmäßig angeordnet sind. Hier bildet tatsächlich jedes Wasser-Molekül H-Brücken mit vier benachbarten Wasser-Molekülen aus.
Eigenschaften des Wassers
Die Bildung von H-Brücken ist auch für einige andere interessante Eigenschaften des Wassers verantwortlich. So ist Wasser ein ausgezeichnetes Lösungsmittel für niederkettige Alkohole, weil die Wasser-Moleküle H-Brücken mit den OH-Gruppen der Alkohole bilden können. Auch mehrwertige Alkohole sowie Zucker lösen sich wegen der OH-Gruppen sehr gut in Wasser.
Wasser ist pH-neutral, denn es ist gleichzeitig Säure und Base (amphoteres Molekül). Von Säuren wie HCl kann ein Wasser-Molekül ein Proton aufnehmen. Dieses lagert sich dann an eines der freien Elektronenpaare des O-Atoms an und bildet mit dem Wasser-Molekül ein Oxonium-Ion H3O+. An Basen wie NH3 kann Wasser dagegen ein Proton abgeben, es entstehen dann Hydroxid-Ionen OH-.
Reines Wasser hat eine sehr geringe elektrische Leitfähigkeit, die auf die Autoprotolyse der Wasser-Moleküle zurückzuführen ist: Ein Wasser-Molekül gibt ein Proton an ein anderes Wasser-Molekül ab, dadurch entstehen ein Oxonium-Ion und ein Hydroxid-Ion.
Typisch für Wasser ist auch die sogenannte Dichte-Anomalie. "Normale" Stoffe werden dichter, wenn man sie abkühlt, weil die Atome bzw. Moleküle weniger schwingen bzw. sich langsamer bewegen. Dadurch rücken sie näher zusammen, und die Dichte nimmt zu. Beim Erhitzen dagegen fangen die Teilchen eines Festkörpers stärker an zu schwingen bzw. die Teilchen einer Flüssigkeit oder eines Gases bewegen sich schneller, so dass die Abstände größer werden und die Dichte abnimmt.
Wasser dagegen hat ein Dichte-Maximum bei 4 ºC. Kühlt man warmes Wasser auf 4 ºC ab, verhält es sich zunächst normal; die Dichte nimmt zu. Kühlt man das Wasser jedoch noch stärker ab, nimmt die Dichte wieder ab. Eis ist daher leichter als 4 ºC warmes Wasser. Ursache für dieses abnormale Verhalten sind wieder die Wasserstoffbrücken-Bindungen zwischen den Wasser-Molekülen. Die H-Brücken halten die Wasser-Moleküle im Eis einerseits zusammen, andererseits sorgen sie aufgrund ihrer Struktur aber auch für einen gewissen Abstand zwischen den Wasser-Molekülen im Eiskristall.
Wegen dieser Dichte-Anomalie schwimmt das Eis auf dem Wasser, anstatt wie bei einer "normalen" Flüssigkeit unterzutauchen. Das wiederum ist der Grund dafür, dass ein See nie bis zum Grund zufriert und dass Lebewesen in einem tieferen See überwintern können.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.