Ein ungewöhnliches Molekül
Den Aufbau des Wasser-Moleküls haben wir ja bereits kennen gelernt. Das Wasser-Molekül ist ein Dipol, wobei das O-Atom den negativen Pol bildet und die beiden H-Atome den positiven Pol.
Mit diesem Dipol-Charakter kann man nun einige physikalische Eigenschaften des Wassers erklären, zum Beispiel den hohen Siedepunkt von 100 ºC, den recht hohen Schmelzpunkt von 0 ºC und die hohe Dichte von 1 g/cm3.
Ähnlich wie sich zwei Stabmagnete anziehen, so ziehen sich auch zwei Dipol-Moleküle an. Das negative Ende des einen Moleküls wird vom positiven Ende eines anderen Moleküls angezogen und so weiter. Die hohen Anziehungskräfte zwischen den Dipol-Molekülen müssen zum Beispiel beim Schmelzen oder beim Sieden überwunden werden, daher sind die Schmelztemperaturen bzw. Siedetemperaturen des Wasser auch recht hoch, zum Beispiel im Vergleich zum Methan-Molekül CH4, das mit 16 g/mol eine ähnliche Molmasse hat wie das Wasser-Molekül mit 18 g/mol. Selbst das Butan C4H10, das mit 58 g/mol eine viel höhere Molmasse hat als das Wasser, hat viel niedrigere Schmelz- und Siedepunkte und auch eine geringere Dichte als das Wasser. Diese "ungewöhnlichen" Eigenschaften des Wassers können eigentlich nur auf den Dipol-Charakter der Wasser-Moleküle zurück zu führen sein.
Ist das Wassermolekül lediglich ein starker Dipol?
Betrachten wir einmal die Siedetemperaturen verschiedener Stoffe, deren Moleküle durch mehr oder weniger starke polare Elektronenpaarbindungen zusammengehalten werden.
| Bezeichnung | Summenformel | Siedetemperatur |
| Diboran | B2H6 | -93 ºC |
| Methan | CH4 | -162 ºC |
| Ammoniak | NH3 | -33 ºC |
| Fluorwasserstoff | HF | +16 ºC |
Die Aufgabe, die ich selbst meinen Schüler(innen) hier immer stelle, lautet folgendermaßen:
Stelle die Siedetemperaturen der Moleküle in Abhängigkeit von der Gruppennummer des Hauptelementes (Bor, Kohlenstoff, Stickstoff, Fluor) graphisch dar.
Das Ergebnis dieser Aufgabe sieht dann meistens so aus:
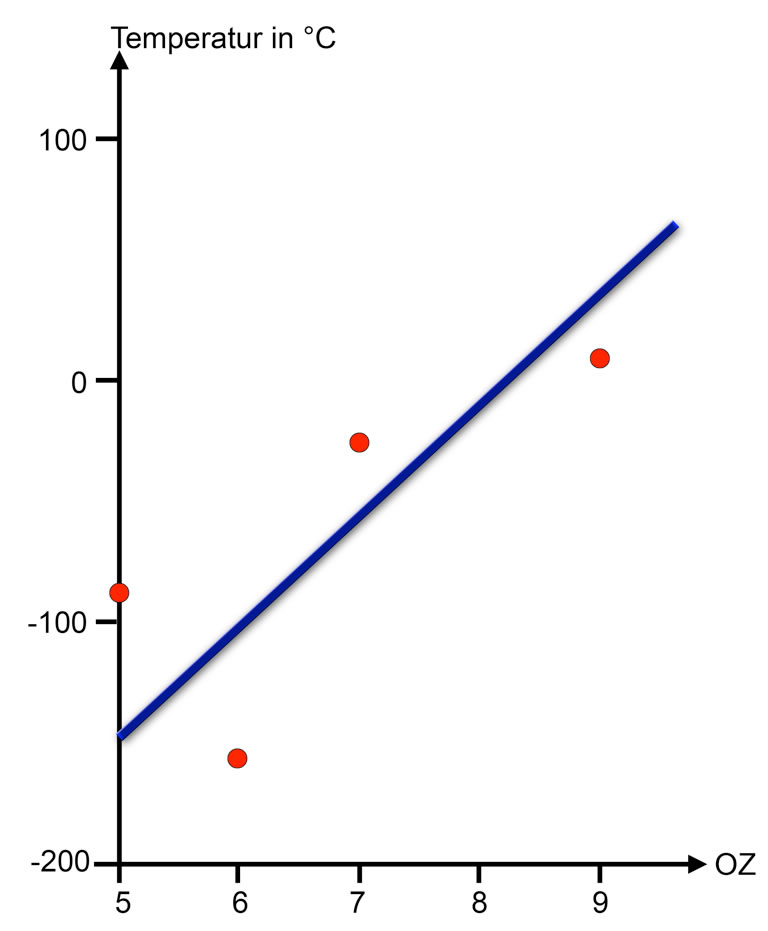
Abhängigkeit der Siedetemperaturen von vier Wasserstoffverbindungen in der Ordnungszahl (OZ) des Hauptelementes: Bor (5), Kohlenstoff (6), Stickstoff (7) und Fluor (9).
Der Siedepunkt des Diborans liegt etwas oberhalb der Ausgleichsgeraden, wahrscheinlich weil die Molmasse der Verbindung recht hoch ist. Eigentlich handelt es sich beim B2H6-Molekül um zwei BH3-Moleküle, die sich zusammengelagert haben.
Der Siedepunkt des Methans dagegen liegt unterhalb der Ausgleichsgeraden. Das könnte daher kommen, dass der EN-Unterschied zwischen Kohlenstoff und Wasserstoff recht gering ist, so dass die C-H-Bindungen nicht allzu polar sind. Außerdem, und das erscheint hier viel wichtiger, ist das Methan-Molekül völlig symmetrisch aufgebaut. Die Einflüsse der vier C-H-Bindungen löschen sich also gegenseitig aus. Die C-H-Bindungen sind zwar schwach polar, das CH4-Molekül selbst ist jedoch kein Dipol.
Die beiden anderen Verbindungen liegen in der Nähe der Ausgleichsgeraden, verhalten sich also wie erwartet.
Die nächste Aufgabe, die ich dann meinen Schüler(innen) immer stelle, ist diese:
Das Wasser-Molekül ist noch nicht in der Graphik berücksichtigt worden. Der Siedepunkt des Wassers müsste an Position 8, der Ordnungszahl des Sauerstoffs, eingezeichnet werden. Wie groß müsste der Siedepunkt des Wassers theoretisch sein, wenn man ihn mit den anderen vier Verbindungen vergleicht?
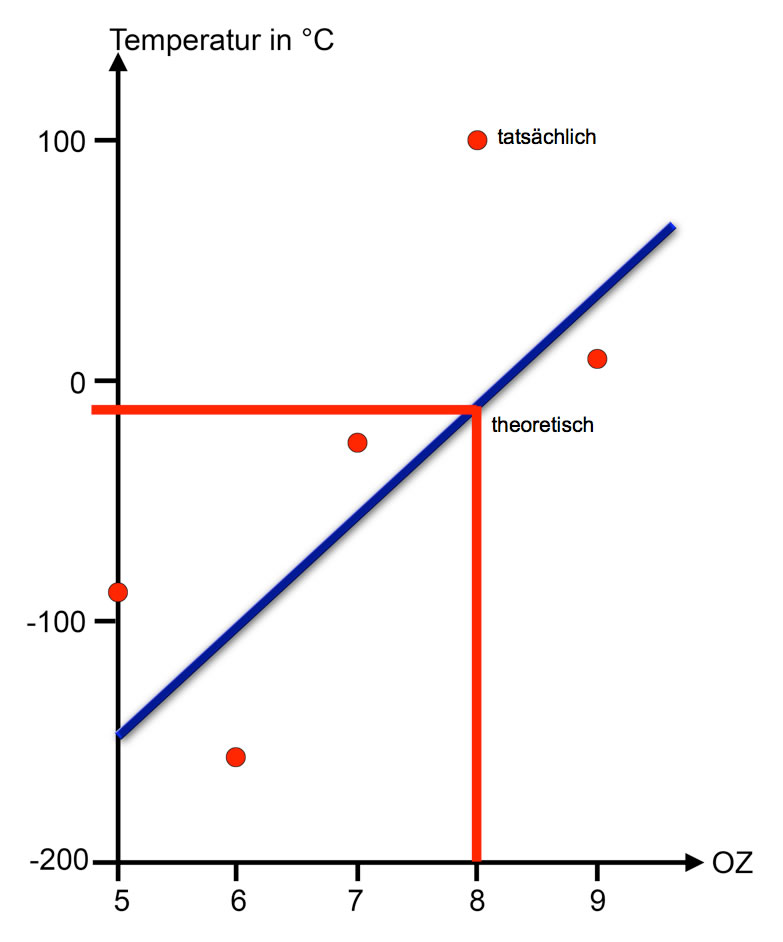
Theoretischer und tatsächlicher Siedepunkt des Wassers
Theoretisch müsste Wasser einen Siedepunkt von ca. -10 ºC haben. Damit würde sich das Wasser in die Reihe der vier anderen Nichtmetall-Hydride der zweiten Periode des PSE einreihen.
Wären die physikalischen Eigenschaften des Wassers ausschließlich auf den Dipol-Charakter der Wasser-Moleküle zurück zu führen, dann hätte das Wasser tatsächlich einen so niedrigen Siedepunkt. Aber wie ist der tatsächliche Siedepunkt von 100 ºC zu erklären?
Wasserstoffbrücken-Bindungen
Was ist es nun, das dem Wasser-Moleküle seine besonderen Eigenschaften verleiht? Es muss doch etwas Stärkeres geben als normale Dipol-Bindungen. Und damit wären wir auch schon beim Thema dieser Seite, den Wasserstoffbrücken-Bindungen. Betrachten wir dazu doch mal das folgende Bild:
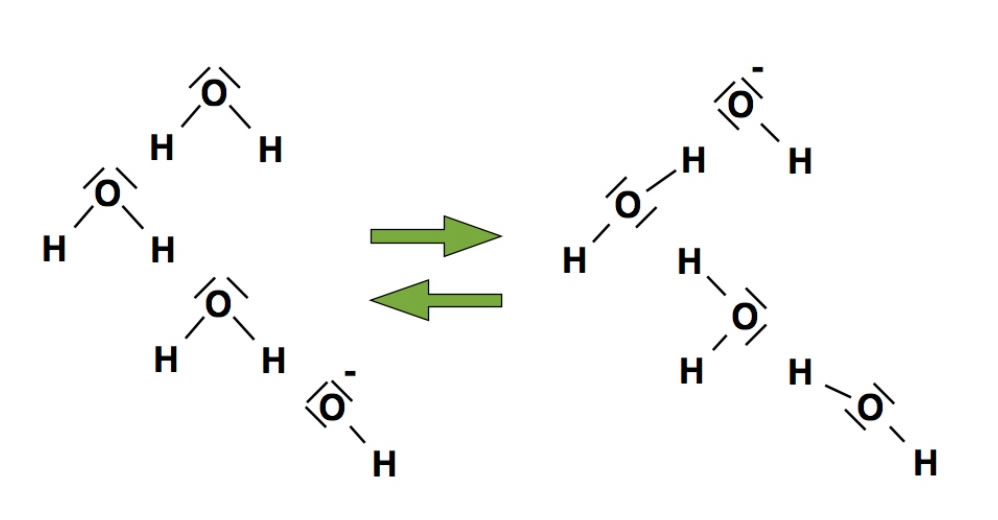
Drei Wasser-Moleküle und ein Hydroxid-Ion OH-
Dieses Bild zeigt auf der linken Seite drei Wasser-Moleküle und unten ein Hydroxid-Ion. Auf der rechten Seite sind dagegen ein Hydroxid-Ion (oben) und drei Wasser-Moleküle zu sehen. Die beiden Pfeile deuten an, dass ein Wechsel zwischen diesen beiden Zuständen möglich ist.
Wie unterscheiden sich aber die beiden Zustände voneinander?
Die Wasser-Moleküle befinden sich links und rechts in der gleichen Position, sie haben ihre Lage nicht verändert. Das Einzige, was sich verändert hat, ist die Zuordnung der H-Atome zu den O-Atomen.
Betrachten wir einmal das obere O-Atom in der Zeichnung. Links gehört es zu einem Wasser-Molekül. Nach der Zustandsänderung gehört es rechts zu einem Hydroxid-Ion.
Schauen wir uns nun das linke H-Atom des oberen Wasser-Moleküls an. In dem Zustand links gehört es zu dem oberen Molekül, in dem Zustand rechts aber zu dem zweitoberen Molekül. Das H-Atom hat also seine Molekül-Zugehörigkeit geändert, selbst aber hat es seine Position nicht verlagert.
Erklärung mit Hilfe des Kugelwolkenmodells
Mit dem Kugelwolkenmodell kann man diese "Verlagerung" der Elektronenpaarbindungen leicht erklären.
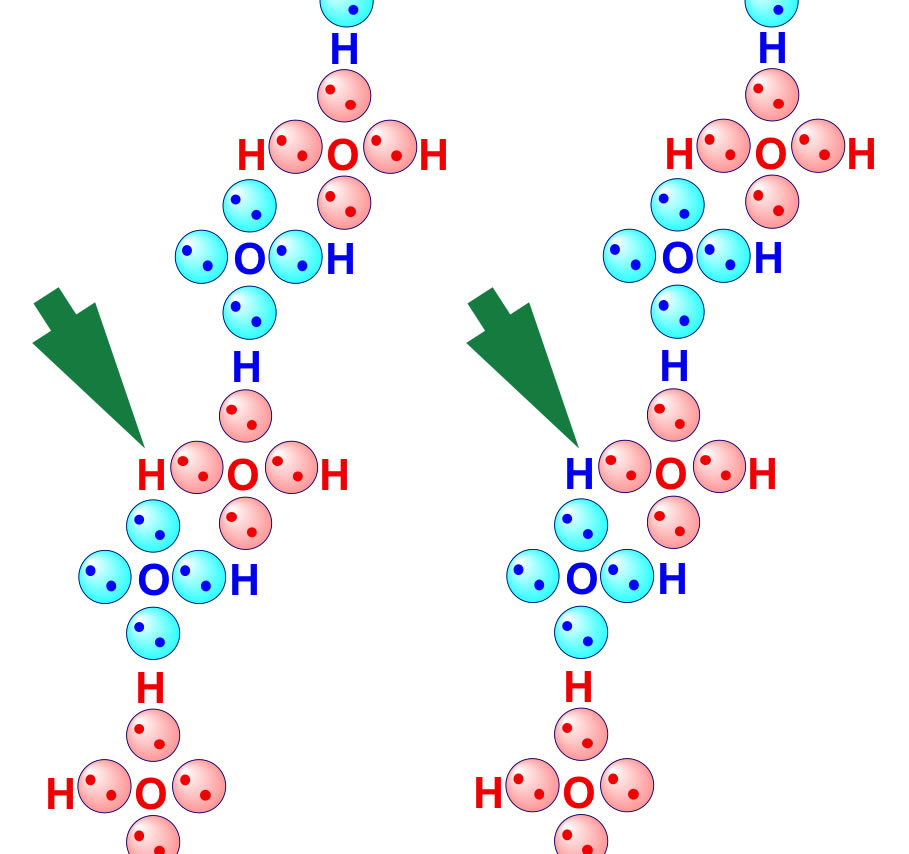
Erklärung mit Hilfe des Kugelwolkenmodells
Achten Sie bei der obigen Zeichnung auf das markierte H-Atom (grüner Pfeil). Links gehört es zu dem rot gezeichneten Wasser-Molekül. Rechts dagegen gehört es zu dem blau gezeichneten Wasser-Molekül, ohne dass es seine Lage verändert hat. Die Kugelwolken der O-Atome und die gemeinsamen Kugelwolken der O-H-Bindungen sind hier in vereinfachter Weise zweidimensional gezeichnet worden. Das markierte H-Atom befindet sich immer zwischen zwei Kugelwolken. Es könnte also theoretisch gleichzeitig mit dem rot gezeichneten und mit dem blau gezeichneten Wasser-Molekül verbunden sein.
Und damit haben wir eigentlich schon definiert, was eine Wasserstoffbrücke ist, nämlich ein H-Atom, das "bindungstechnisch" gleichzeitig zu zwei Wasser-Molekülen gehört, also nicht eindeutig zuzuordnen ist. Mal ist das H-Atom an das eine Wasser-Molekül gebunden, mal an das andere. Es verbindet quasi die beiden Wasser-Moleküle, und genau diese Bindung wird als Wasserstoffbrücken-Bindung oder einfacher als H-Brückenbindung bezeichnet, manchmal sogar nur als H-Brücke.
H-Brücken sind übrigens nicht nur zwischen Wasser-Molekülen möglich, sondern auch zwischen vielen anderen Molekülen, zum Beispiel zwischen Methanol- oder Ethanol-Molekülen. Weitere Einzelheiten zum Thema Wasserstoffbrücken-Bindungen finden sich in dem entsprechenden Lexikon-Eintrag "Wasserstoffbrücken-Bindungen".
Seitenanfang -
Kugelwolkenmodell -
Elektronenpaarbindung -
Molekülstrukturen -
Polare Bindungen -
Elektronegativität -
H-Brücken