Bei der polaren kovalenten Bindung, wie sie z.B. im Wassermolekül vorkommt, hatten wir gesagt, dass eines der beiden Atome die Elektronen der Bindung etwas stärker anzieht als das andere Atom. Ein Maß für diese Fähigkeit, Bindungselektronen anzuziehen, ist die Elektronegativität. Hierbei handelt es sich um ein recht willkürliches Maß. Man hat einfach das Element genommen, dessen Atome die Bindungselektronen am stärksten anziehen, und dann den Elektronegativitätswert dieses Elementes auf 4 festgesetzt. Es handelt sich um das Element Fluor. Genau so gut hätte man diesen Maximalwert aber auch auf 1,00 oder auf 100 setzen können.
Später hat man die EN-Werte mit verbesserten Verfahren neu gemessen, und dann festgestellt, dass Fluor nur noch einen Wert von 3,98 hat.
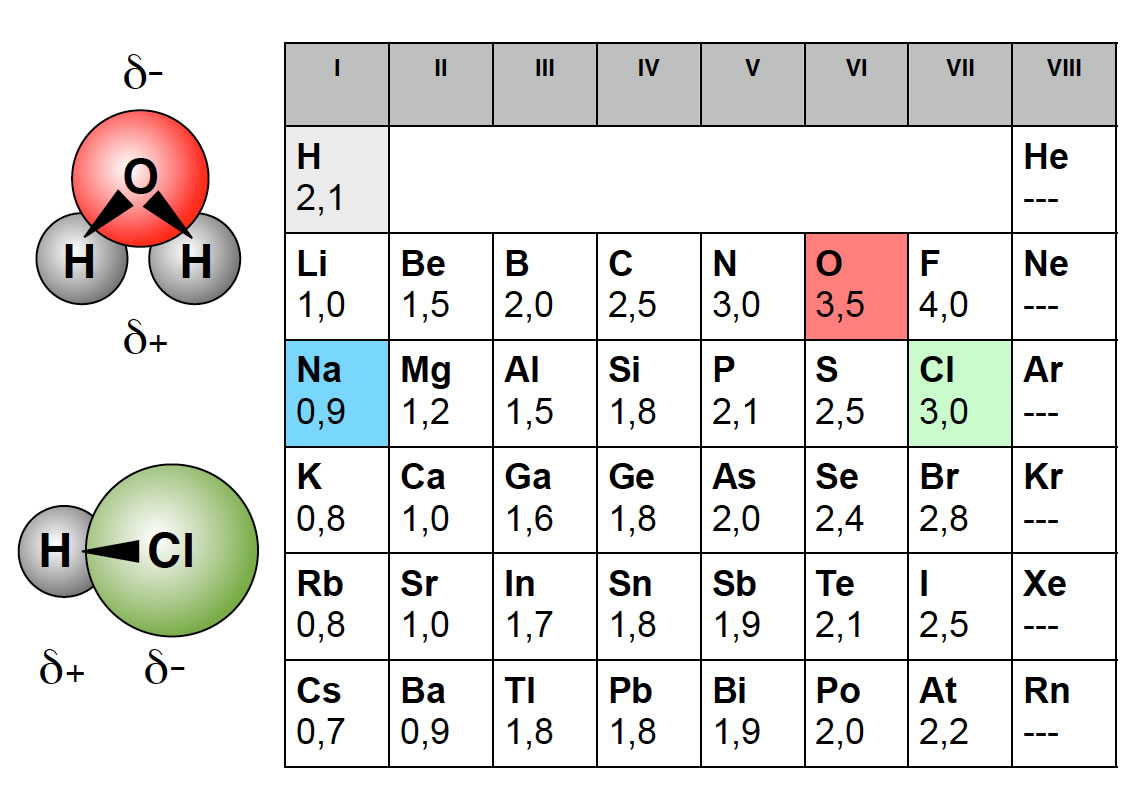
Tabelle: EN-Werte der Hauptgruppen-Elemente
Die Elektronegativität eines Elementes hängt - genau wie die Ionisierungsenergie - von zwei Faktoren ab:
- Je größer die Kernladung, desto höher der EN-Wert. Eine starke Kernladung zieht die Bindungselektronen (und überhaupt alle Elektronen) stark an.
- Je größer der Atomradius, desto geringer der EN-Wert. Ein sehr weit entfernter (oder durch innere Elektronen gut abgeschirmter) Atomkern zieht die Bindungselektronen (und überhaupt alle Außenelektronen) weniger stark an.
Moleküle und Ionen
Es wird Zeit zu einer kleinen Rekapitulation. Im Chemieunterricht haben wir bisher zwei Arten der chemischen Bindung kennengelernt. Die Ionenbindung, z.B. beim Kochsalz NaCl, und die Elektronenpaarbindung, z.B. beim Ammoniak NH3. Die Frage ist nun doch, wer oder was entscheidet eigentlich darüber, ob es bei einer Reaktion zwischen zwei Elementen zu einer Ionenbindung oder zu einer Elektronenpaarbindung kommt. Dazu betrachten wir einfach das nächste Bild:
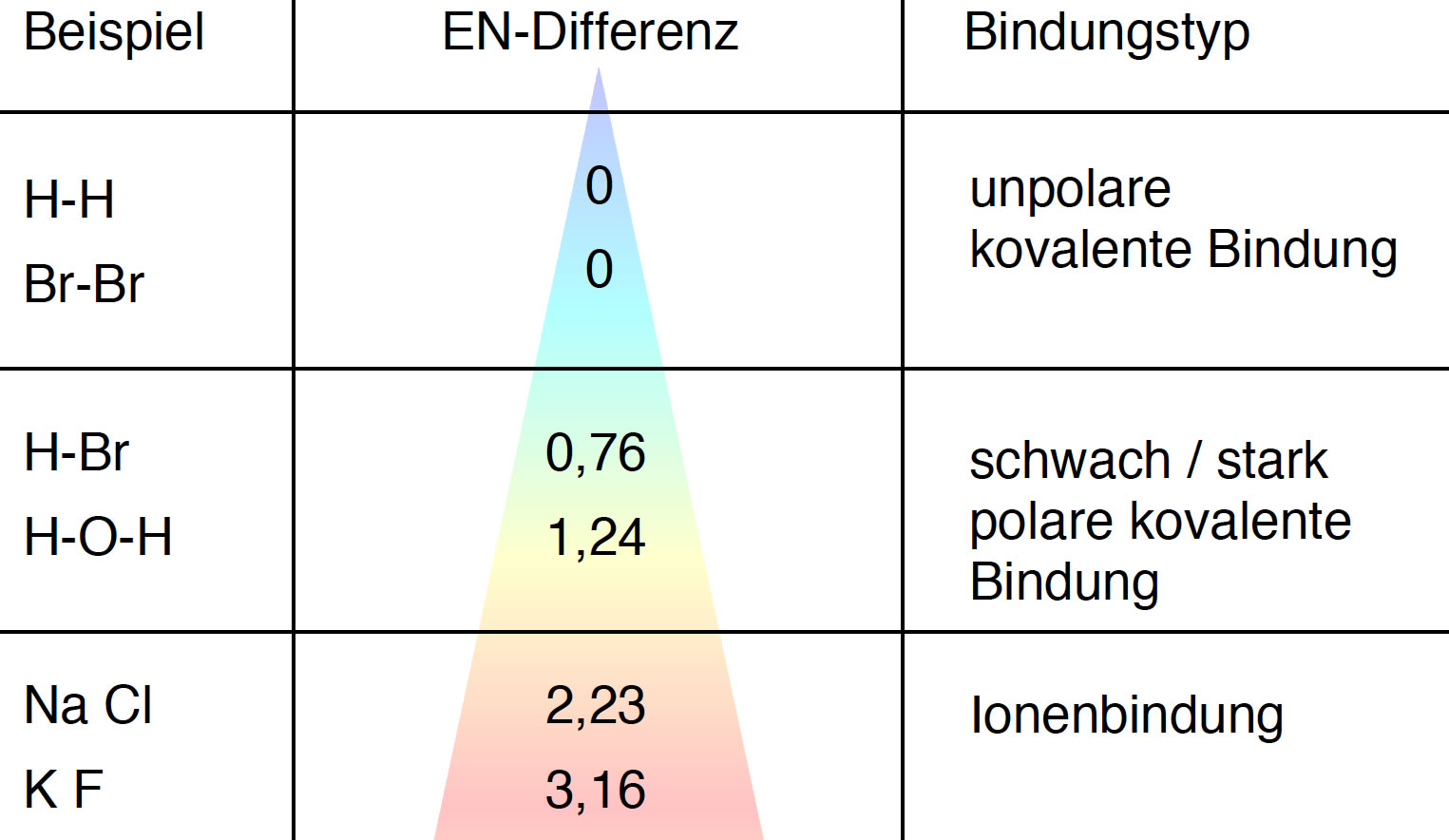
Abhängigkeit der chemischen Bindung von dem EN-Unterschied der Atome
Damit scheint die Sache klar zu sein. je nachdem, wie groß der EN-Unterschied zwischen den beiden Atomen sind, haben wir
- eine völlig unpolare Bindung, zum Beispiel im H2-, im O2- oder im Cl2-Molekül
- eine leicht polare Bindung, zum Beispiel im CH4-Molekül
- eine stark polare Bindung, zum Beispiel im HBr- oder im H2O-Molekül
- eine Ionenbindung, zum Beispiel im NaCl- oder KF-Kristall
Die aus dem Unterricht bekannte "Ionenbindung" sowie die "Elektronenpaarbindung" sind also nur zwei Extreme einer an sich kontinuierlichen Skala von verschiedenen Bindungen.
Exkurs Aluminiumbromid
Wenn du von deinem Lehrer den Auftrag bekommst, die Bindungsverhältnisse in dem Salz Aluminiumbromid AlBr3 zu beschreiben, dann würdest du sicherlich vermuten, dass es sich um eine Ionenbindung handelt. Aluminium hat drei Außenelektronen, dem Brom fehlt ein Außenelektron. Also gibt das Al-Atom seine drei Außenelektronen ab und wird zum Al3+-Ion, und drei Brom-Atome übernehmen diese und werden zu drei Bromid-Ionen.
Wenn wir dann mal etwas im Internet recherchieren, finden wir aber zum Beispiel in der Wikipedia folgende interessante Information:
"Im festen Zustand bildet Aluminiumbromid Al2Br6-Moleküle...".
Während "richtige" Ionenverbindungen wie NaCl (Kochsalz) oder FeO (Eisenoxid) nicht in organischen Lösemitteln löslich sind, kann man Aluminiumbromid in Benzol oder Toluol lösen. Das ist sehr ungewöhnlich für ein Salz.
Dieses Beispiel sollte noch einmal verdeutlichen, dass die Grenzen zwischen Ionenbindung und kovalenter Bindung fließend sind. AlBr3 müsste theoretisch Ionenbindungen besitzen, hat aber offensichtlich stattdessen kovalente Bindungen. Diese sind allerdings sehr polar, wenn man den EN-Unterschied zwischen Al-Atomen und Br-Atomen betrachtet: Al = 1,5; Br = 2,8.
Seitenanfang -
weiter mit Dipolen und Keesom-Kräften