Musterbeispiel Hexokinase
Ein Musterbeispiel für das Zustandekommen der Substratspezifität ist die Interaktion des Enzyms Hexokinase (katalysiert den ersten Schritt der Glycolyse) mit dem Substrat Glucose und dem Cosubstrat bzw. Coenzym ATP.
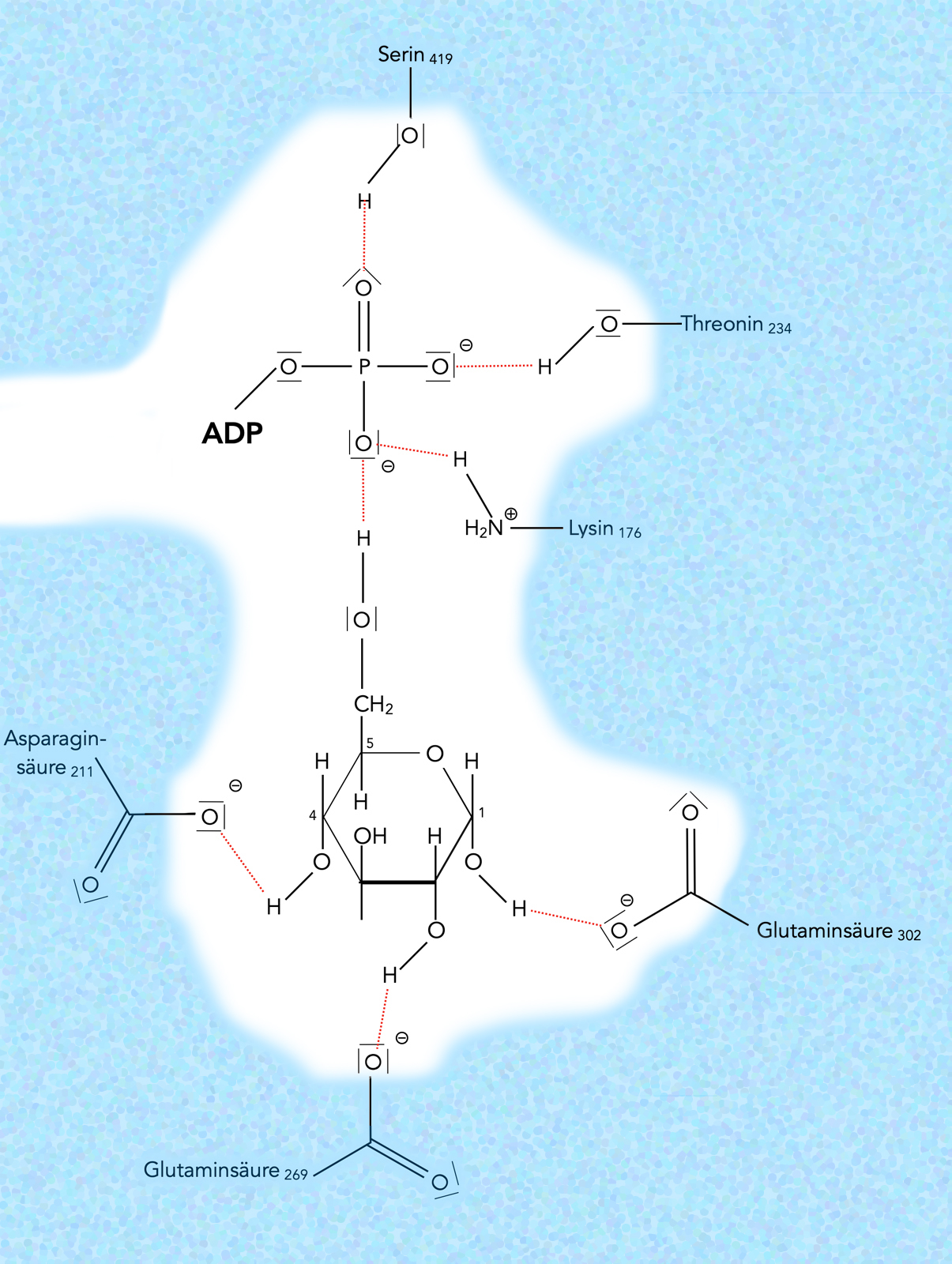
Glucose und ATP im aktiven Zentrum der Hexokinase
Autor: Ulrich Helmich 06/2023 nach einem Bild im Markl Biologie Oberstufe (2023), Lizenz: Public domain
Das ATP-Molekül wird durch drei weit entfernte Aminosäuren fixiert, das Glucose-Molekül ebenfalls. Die ausgebildeten Wasserstoffbrücken-Bindungen zwischen den Seitenketten dieser Aminosäuren und den O-Atomen der endständigen Phosphatgruppe bzw. den OH-Gruppen der Glucose sind pH-abhängig:
In einem sauren Medium werden wegen des Überschusses an Protonen H+ die negativ geladenen O-Atome zu OH-Gruppen protoniert. Das hat zur Folge, dass ein Teil der H-Brücken entfällt. Auch elektrostatische Anziehungen zwischen negativ geladenen O-Atomen und positiv geladenen Stellen im Produkt fallen weg, wenn die O-Atome protoniert werden. Die Folge ist dann, dass die Substrate nicht mehr so stark festgehalten werde. Sie können dann aus dem aktiven Zentrum heraus diffundieren. Dies erklärt auch die pH-Abhängigkeit der Hexokinase, die am besten bei einem pH-Wert von 7 arbeitet.
Interessant an diesem Beispiel ist auch die Tatsache, dass die relevanten Aminosäuren, die die beiden Substrate binden, in der Primärstruktur des Enzyms weit auseinander liegen. Durch Faltungen der Tertiärstruktur finden sie im aktiven Zentrum aber zusammen.
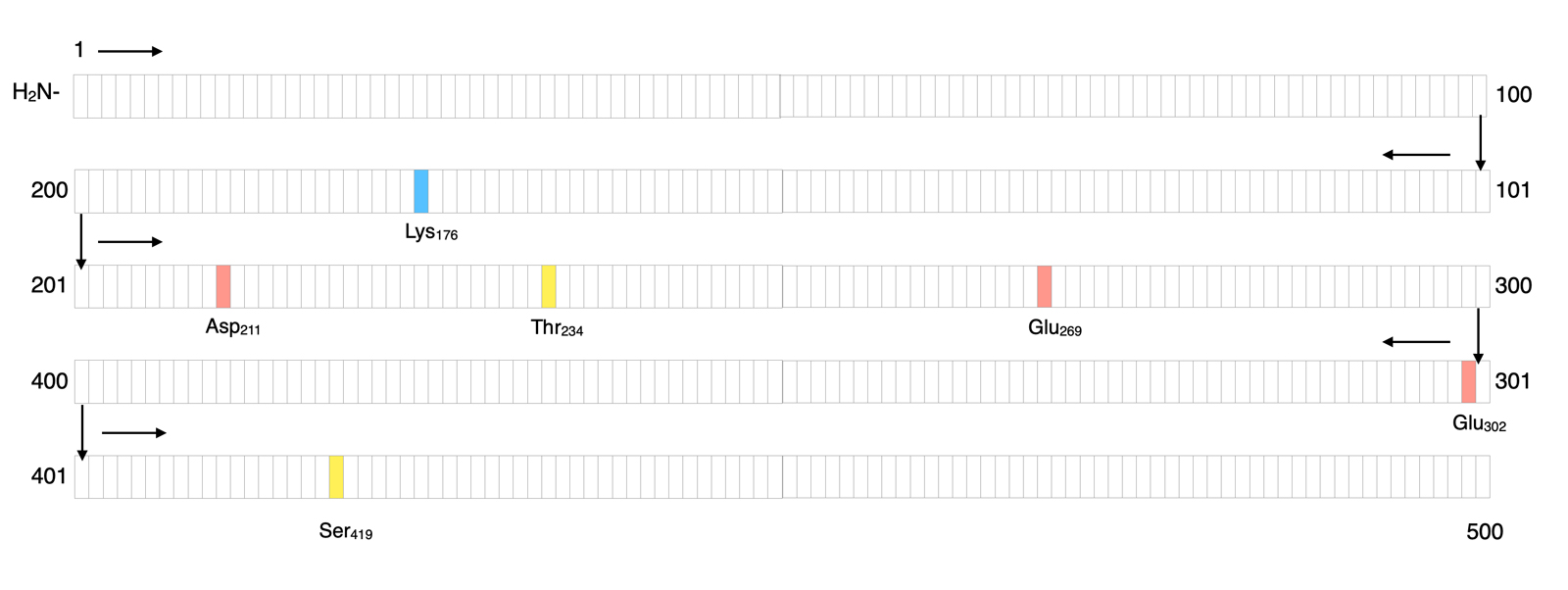
Die Lage der bindenden Aminosäuren in der Primärstruktur der Hexokinase
Autor: Ulrich Helmich 06/2023, Lizenz: Public domain
Substratspezifität und Gruppenspezifität
Die meisten Enzyme sind allerdings nicht 100%ig substratspezifisch. Sehr ähnlich aussehende chemische Verbindungen passen ebenfalls in das aktive Zentrum hinein. Allerdings ist die Enzymaktivität, also die Geschwindigkeit, mit der das Enzym arbeitet, dann nicht so hoch.
Die meisten Enzyme haben ein recht kleines aktives Zentrum, in das nicht das ganze Substrat hineinpasst, wie man den ganzen Abbildungen gut sehen kann. Nur ein kleiner Teil des Substrats befindet sich im aktiven Zentrum. Der Rest des Substrats, der sich nicht im aktiven Zentrum befindet, kann ohne Weiteres eine andere Struktur haben, ohne dass dies die enzymatische Aktivität beeinträchtigt.
Stellen wir uns ein Enzym vor, das Ethanol zu Acetaldehyd oxidiert, indem es dem Ethanol Wasserstoff entzieht.
Diese Alkoholdehydrogenase ist übrigens ein äußerst wichtiges Enzym des Menschen. Wenn wir Alkohol getrunken haben, kommt dieses Enzym zur Arbeit und macht aus dem Ethanol des Weins oder Biers Acetaldehyd, das Oxidationsprodukt des Ethanols, das dann für den Kater am nächsten Morgen verantwortlich ist.
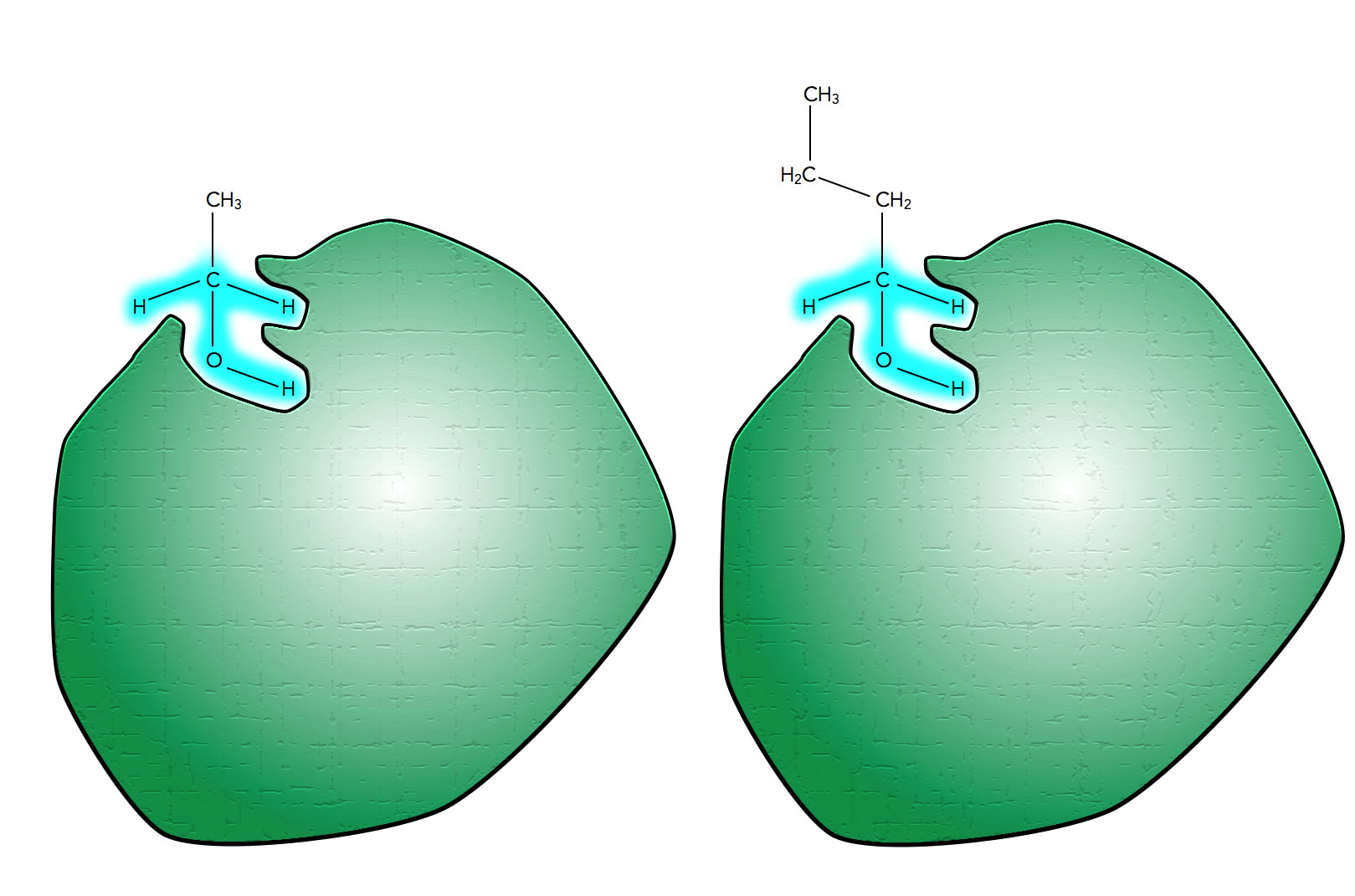
Das Ethanol-verarbeitende Enzym kann auch Butanol verarbeiten
Autor: Ulrich Helmich 2021, Lizenz: Public domain
Man kann sich nun aber leicht vorstellen, dass auch andere Alkohole mit einer ähnlichen Struktur wie Ethanol von dem Enzym verarbeitet werden. In der Abbildung ist beispielsweise ein Butanol-Molekül zu sehen, das ebenfalls gut in das aktive Zentrum des Enzyms passt, weil die entscheidenden Molekülbereiche (blau markiert) ja vollkommen mit denen des Ethanols übereinstimmen.
In der Tat sind viele Enzyme gruppenspezifisch, es gibt aber auch einige wenige Enzyme, die streng substratspezifisch sind, also tatsächlich nur ein spezielles Substrat verarbeiten können.
Stereospezifität
Es gibt Moleküle, die sich wie Bild und Spiegelbild verhalten. Das folgende Bild zeigt ein solches Molekül:
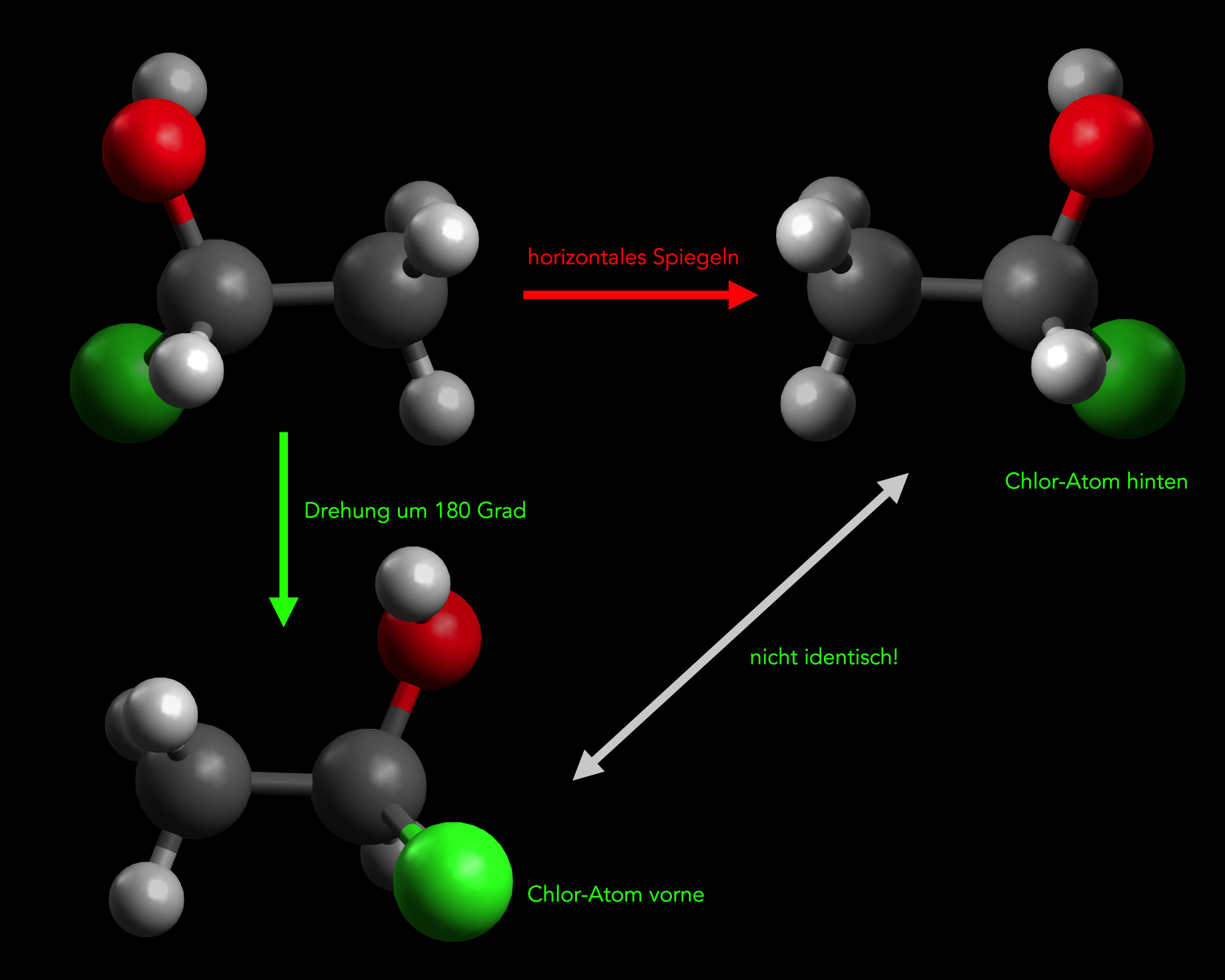
Ein 1-Chlor-ethan-1-ol-Molekül wird horizontal gespiegelt (obere Reihe) und um 180 º gedreht
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Die Abbildung zeigt ein organisches Molekül, nämlich Ethanol, bei dem ein Wasserstoff-Atom durch ein Chlor-Atom ersetzt wurde. Oben im Bild sehen wir die beiden Enantiomere (Spiegelbild-Isomere) dieser Verbindung.
Unten im Bild wird überprüft, ob man das linke Enantiomer durch einfaches Drehen um 180º in das rechte Enantiomer umwandeln kann. Wie man sieht, geht das nicht. Bei rechten Enantiomer befindet sich das Chlor-Atom hinter der Bild-Ebene, bei dem gedrehten linken Enantiomer liegt das Chlor-Atom dagegen vor der Bild-Ebene.
Enantiomerie oder Spiegelbildisomerie wird auf der Seite des Chemie-Lexikons näher erklärt.
Die chemischen und physikalischen Eigenschaften solcher Enantiomere sind völlig identisch, aber Enzyme können die beiden Formen leicht voneinander unterscheiden. Genau so wenig, wie man seine linke Hand in einen rechten Handschuh hinein bekommt, kann sich das Spiegelbild eines Substrats in das aktive Zentrum eines Enzyms setzen.

Das Spiegelbild des Substrats passt nicht mehr in das aktive Zentrum hinein
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Enzyme sind also stereospezifisch.
Das Contergan-Beispiel
Contergan ist ein Medikament gegen Übelkeit mit dem Wirkstoff Thalidomid, das 1954 im Labor der deutschen Firma Grünenthal entwickelt wurde. Als Frauen das Medikament im ersten Drittel einer Schwangerschaft einnahmen, führte das bei vielen der geborenen Kindern zu schweren Missbildungen, zum Beispiel verstümmelte Arme oder Beine. Diese Babys sind dann als "Contergan-Kinder" bekannt geworden. Die ganze Geschichte um den Contergan-Skandal lässt sich auf der Webseite der Firma Grünenthal sehr gut nachlesen.
Thalidomid ist ein chirales Molekül mit folgender Struktur:
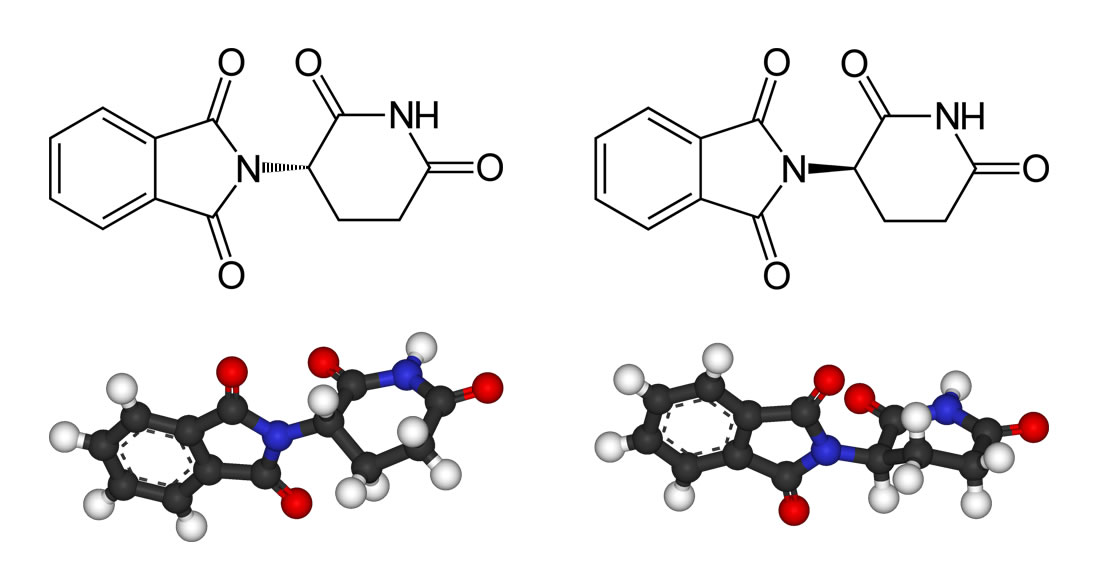
Die beiden Enantiomere des Thalidomids: Links (S)-Thalidomid, rechts (R)-Thalidomid.
Autor: Benjah-bmm27, Lizenz: public domain.
Im Contergan liegt das Thalidomid als Racemat vor, das heißt, beide Stereoisomere, sowohl die S-Form wie auch die R-Form, sind in ungefähr gleichen Anteilen vorhanden. Das (R)-Enantiomer hat eine beruhigende Wirkung und ist an sich harmlos, während das spiegelbildlich aufgebaute (S)-Enantiomer die schweren fruchtschädigenden Folgen hat.
Dieses berühmte und berüchtigte Beispiel zeigt die Wichtigkeit des Schlüssel-Schloss-Prinzips bei Enzymen, denn auch die Thalodomid-Wirkung ist ja über eine ganze Reihe von Enzymen im Körper der Schwangeren und der Kinder abgelaufen.
Auch die Rückreaktion wird katalysiert!
Betrachten wir ein Enzym, das Ethanol zu Ethanal oxidiert. Im menschlichen Körper existieren insgesamt fünf dieser Alkoholdehydrogenasen. Jede dieser Alkoholdehydrogenasen katalysiert folgende Reaktion:
$R-CH_2-OH + NAD^{+} \rightleftharpoons R-CHO + NADH/H^{+}$
Schauen Sie sich diese Reaktionsgleichung genau an. Ja, richtig gesehen, es handelt sich um eine Gleichgewichtsreaktion. Das Enzym katalysiert nicht nur die Hinreaktion, sondern auch die Rückreaktion, also die Bildung von Ethanol aus Ethanal und dem Coenzym NADH/H+, das hier als Wasserstoff-Spender auftritt.
Enzyme katalysieren sowohl die Hinreaktion wie auch die Rückreaktion einer biochemischen Umsetzung.
Wenn wir Alkohol getrunken haben, baut die Alkoholdehydrogenase den Blutalkohol zu Acetaldehyd bzw. Ethanal ab. Ethanal ist eine äußerst giftige Substanz und die Ursache für den "Kater", den man hat, wenn man mal zu viel Alkohol getrunken hat.
Nun könnte man doch denken, dass der Alkohol gar nicht richtig abgebaut wird. Denn sobald eine hinreichende Menge von Ethanal entstanden ist, müsste dieser doch wieder zu Ethanol zurück reagieren. Offensichtlich ist das aber nicht der Fall. Der Alkoholspiegel im Blut sinkt Stunde für Stunde.
Wenn Sie im Chemieunterricht das Thema "chemisches Gleichgewicht" hatten, dann ahnen Sie sicherlich schon, wie der Körper es regelt, dass der Alkohol komplett abgebaut wird. Er wandelt nämlich mit Hilfe eines weiteren Enzyms das Reaktionsprodukt Ethanal in Essigsäure um, so dass Ethanal quasi "aus dem Verkehr" gezogen wird. Wenn das Ethanal sofort nach seiner Bildung wieder verbraucht wird, kann es nicht mehr zu Ethanol zurück reagieren.
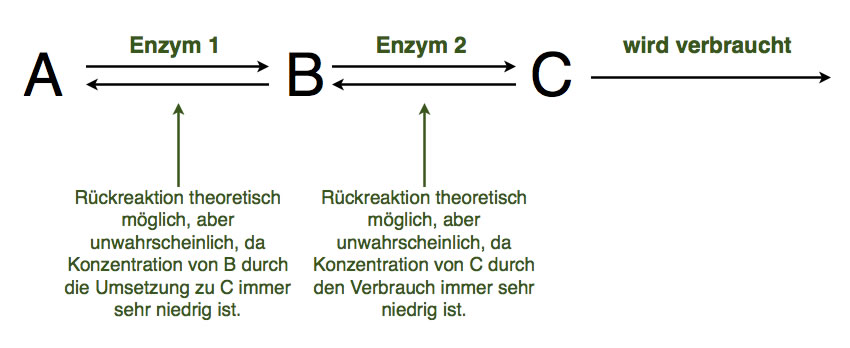
Eine enzymatische Wirkkette und das Prinzip des kleinsten Zwangs
Autor: Ulrich Helmich 2021, Lizenz: Public domain.
Hier sehen wir sogar eine noch etwas komplexere Stoffwechselkette als die des Alkohol-Abbaus, allerdings sehen wir hier nur eine allgemeine abstrakte Version.
Das Enzym 1 katalysiert die Reaktion von A nach B und umgekehrt. Allerdings gibt es ein Enzym 2, das die Reaktion von B nach C katalysiert. Dadurch wird die Konzentration von B stets gering gehalten, und eine Rückreaktion nach A wird unwahrscheinlicher.
Damit aber nicht genug. Die Verbindung C wird ständig verbraucht, vielleicht durch ein drittes Enzym, das hier nicht mehr eingezeichnet ist. Oder C wird irgendwie ausgeschieden, zum Beispiel als Kohlendioxid, Wasser oder Harnstoff. Dann wird auch die Wahrscheinlichkeit, dass C zu B zurück reagiert, sehr klein bis unmöglich.
Das alles wird unter den Begriffen "Chemisches Gleichgewicht" und "Prinzip des kleinsten Zwangs" im Chemie-Unterricht behandelt.
➥Prinzip des kleinsten Zwanges
Auf dieser Seite der Chemie-Abteilung meiner Homepage wird das Le-Chateliersche Prinzip des kleinsten Zwanges erklärt. Die Seite ist für Schüler(innen) der Stufe EF geschrieben, also sollten Sie eigentlich keine Probleme haben, alles zu verstehen.
Das chemische Gleichgewicht spielt eine sehr wichtige Rolle bei biochemischen Umsetzungen, vor allem bei Stoffwechselvorgängen. Wenn Sie dazu mehr wissen möchten, gehen Sie bitte auf die entsprechende Abteilung auf meinen Chemie-Seiten.
Enzymklassen
Nach [1] gibt es sieben EC-Klassen von Enzymen, je nach den Substratgruppen, die sie umsetzen. Das Kürzel "EC" steht für "Enzyme Commission" und nicht für "Enzyme class". Eine komplette Liste (englisch) der Enzymklassen und -unterklassen gibt es in dem Wikipedia-Artikel "List of enzymes" (ausgedruckt über 20 A4-Seiten!).
EC 1. Oxidoreduktasen
Das sind Enzyme, die Redoxreaktionen katalysieren. Ein Beispiel aus der Glycolyse ist das Enzym Glycerinaldehyd-3-phosphat-Dehydrogenase, das Glycerinaldehyd-phosphat oxidiert, in dem es Wasserstoff auf das Coenzym NAD+ überträgt. Andere Oxidoreduktasen übertragen einfach nur Elektronen von einer Verbindung A auf eine Verbindung B.
EC 2. Transferasen
Das sind Enzyme, die eine funktionelle Gruppe X von einem Donator auf einen Akzeptor übertragen. Ein Beispiel aus der Glycolyse ist das Enzym Hexokinase, das eine Phosphatgruppe von dem Cosubstrat ATP auf das Substrat Glucose überträgt, so dass Glucose-6-Phosphat entsteht.
EC 3. Hydrolasen
Wie der Name schon andeutet, sind das Enzyme, die eine chemische Bindung reversibel hydrolysieren, also durch Einbau von Wasser auflösen. Eine bekannte Hydrolase ist die Amylase, die Stärke in Maltose spaltet.
EC 4. Lyasen
Lyasen sind Enzyme, die ein Molekül ohne Zufuhr von Wasser spalten können, also nicht-hydrolytisch. Ein Beispiel aus der Glycolyse ist das Enzym Aldolase, das Fructose-1,6-bisphosphat in Glycerinaldehyd-phosphat und Dihydroxyaceton-phoshat spaltet.
EC 5. Isomerasen
Isomere sind Moleküle mit der gleichen Summenformel, aber einer anderen Strukturformel. Isomerasen katalysieren die Umwandlung des einen Isomers in ein anderes Isomer. Ein Beispiel aus der Glycolyse ist das Enzym Glucose-6-Phosphat-Isomerase, das Glucose-6-Phosphat in Fructose-6-Phosphat umwandelt.
EC 6. Ligasen
Ligasen verknüpfen zwei Moleküle zu einem neuen, wobei Energie zum Beispiel in Form von ATP benötigt wird. Die DNA-Ligase ist das bekannteste Beispiel für eine Ligase. Sie spielt eine wichtige Rolle bei der Reparatur von beschädigter DNA.
EC 7. Translocasen
Das sind komplex aufgebaute Transportproteine, die in der Lage sind, Verbindungen quer durch eine Membran zu transportieren. Einfache liganden- oder spannungsgesteuerte Ionenkanäle oder Carrierproteine gehören nicht zu den Translocasen und werden eigentlich auch nicht als Enzyme bezeichnet.
Eine deutlich genauere Auflistung der sieben Enzymklassen finden Sie auf dieser Seite im Biologie-Lexikon meiner Homepage.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Wikipedia, Artikel "Thalidomid".
Seitenanfang -
Weiter mit Enzymkinetik...