 |
 |
 |
|
| Brandfördernd | Ätzend | Reizend |
1. Einführung
Propan-1-ol C3H7-OH ist das dritte Glied in der homologen Reihe der Alkanole nach Methanol und Ethanol.
2. Strukturdaten
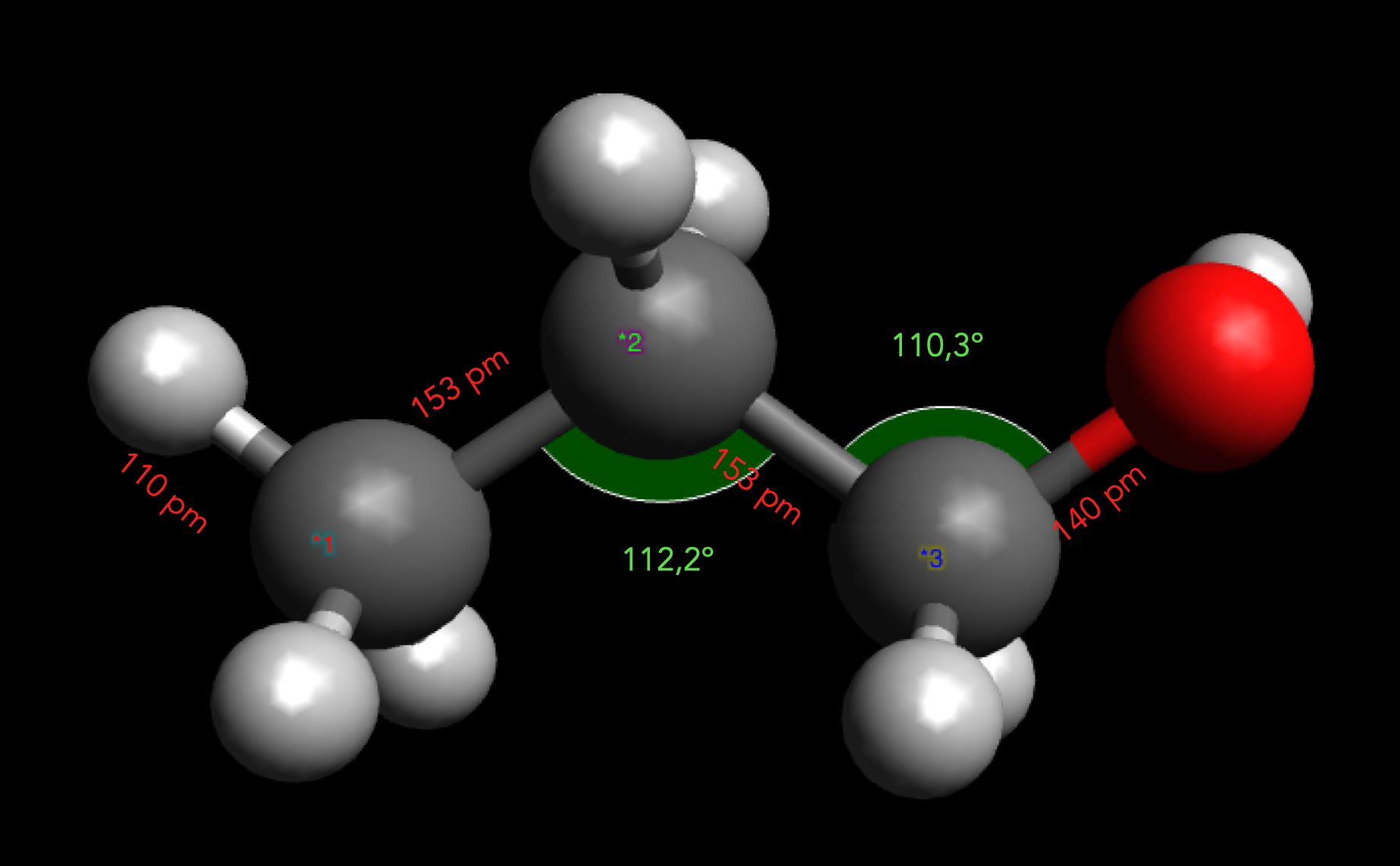
Das Propan-1-ol-Molekül
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Die Bindungswinkel und Bindungslängen wurden mit der Messfunktion der Software Avogadro ermittelt, nachdem zuvor die energetisch günstigste Konformation erzeugt wurde.
Die zwei relevanten Bindungswinkel C-C-C und C-C-O weichen mit 112,2º und 110,3º etwas vom Tetraederwinkel 109,5º ab, was auf die gegenseitige Abstoßung der Elektronenwolken zurückgeht.
Die Bindungslängen zwischen den C-Atomen betragen 153 pm, die Bindungslänge der O-H-Bindung liegt bei nur 140 pm.
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedepunkte
Der Schmelzpunkt von Propan-1-ol liegt bei -129 ºC, der Siedepunkt bei 97 ºC. Wie bei allen Alkanolen sind die Werte für die Siedetemperaturen verhältnismäßig hoch, da die Moleküle nicht nur Dipoleigenschaften besitzen (Dipolmoment nur 1,68 D), sondern zudem auch noch H-Brücken untereinander ausbilden können, da die OH-Gruppe sowohl H-Brücken-Donator wie auch H-Brücken-Akzeptor ist.
| Verbindung | Siedetemperatur in ºC |
| Butan | -0,5 |
| Propan-1-ol | 97,2 |
| Propan-2-ol | 82,3 |
| Ethansäure | 118 |
Die Ethansäure (ähnliche molare Masse wie die Propanole) hat einen noch höheren Siedepunkt als die Propanole, da sie mit der COOH-Gruppe über zwei H-Brücken-Akzeptoren verfügt.
3.2 Löslichkeitsverhalten
Die Wasserlöslichkeit ist sehr groß, Propan-1-ol lässt sich in jedem Verhältnis mit Wasser mischen.
3.3 Weitere Eigenschaften
Propan-1-ol ist bei Zimmertemperatur eine farblose und klare Flüssigkeit mit einer Dichte von 0,80 g/cm3. Der Alkohol riecht leicht nach Ethanol. Propan-1-ol ist wie alle niederen Alkanole brennbar. Der Flammpunkt liegt bei 22 ºC, die Zündtemperatur beträgt 385 ºC.
4. Gewinnung und Synthese
Rein theoretisch kann Propan-1-ol auf mehrere Weisen hergestellt werden. Die bekanntesten Methoden dürften die Hydratisierung von Propen sowie die Reduktion von Propanal sein, und natürlich dürfte auch die Substitution des Cl-Atoms von 1-Chlorpropan, das man durch Chlorierung von Propan gewinnen kann, eine Möglichkeit sein, Propan-1-ol herzustellen.
4.1 Reduktion von Propanal
In der Industrie wird Propan-1-ol fast ausschließlich durch die Hydrierung von Propanal hergestellt. Das geschieht mit Hilfe von Metall-Katalysatoren bei Temperaturen von 110 bis 150 ºC sowie Drücken von 1,5 bis 10 bar.
$CH_3 CH_2 CHO + H_2 \to CH_3 CH_2 CH_2 OH$
Bei diesem Verfahren ist die Ausbeute sehr hoch, über 99%. Daher hat sich auch so gut wie kein anderes Verfahren in der Industrie durchgesetzt.
4.2 Hydratisierung von Propen
In einer elektrophilen Addition kann Wasser an die C=C-Doppelbindung von Propen addiert werden. Nach Markownikow würde sich zunächst ein Proton an das äußere C1-Atom setzen, so dass ein sekundäres Carbenium-Ion entsteht. Die OH-Gruppe würde sich dann an das mittlere C-Atom setzen. Die Ausbeute an Propan-1-ol wäre dabei sehr niedrig. Dies ist einer der Gründe, warum sich dieses Verfahren weder in der Industrie noch im Labor durchgesetzt hat.
4.3 Nucleophile Substitution von 1-Chlorpropan
Auch diese Reaktion ist theoretisch zwar möglich, wird aber so gut wie nie durchgeführt. Zumindest findet man in der Fachliteratur keine Erwähnung, dass diese Reaktion tatsächlich praktisch durchgeführt wird.
5. Reaktionen
5.1 Oxidation, Verbrennung
Wie alle Alkanole ist auch Propan-1-ol leicht oxidierbar. Bei der Verbrennung entstehen Kohlendioxid und Wasser, bei der Oxidation mit Oxidationsmitteln wie Kupferoxid, Kaliumpermanganat etc. bildet sich die Verbindung Propanal, ein Aldehyd.
Die Verbrennung von Propan-1-ol spielt eine Rolle, wenn die Verbindung als Treibstoff für Ottomotoren eingesetzt wird. Wegen seiner hohen Klopffestigkeit (Oktanzahl 118 nach ROZ) eignet sich Propan-1-ol im Prinzip sehr gut als Treibstoff. Allerdings ist die volumetrische Energiedichte mit rund 24MJ/l etwa 28 % geringer als jene von Benzin.
Die Oxidation von Propan-1-ol und Propan-2-ol spielt eine wichtige Rolle im Chemie-Unterricht. Beide Alkohole reagieren mit Kupfer(II)oxid. Taucht man ein heißes angeschwärztes Kupferblech in jeden dieser beiden Alkohole, so wird das schwarze Kupferblech sofort wieder blank. Aus dem Propan-1-ol entsteht der Aldehyd Propanal, aus dem Propan-2-ol das Keton Propanon bzw. Aceton.
5.2 Dehydratisierung
Durch Entzug von Wasser (Eliminierung) kann Propan-1-ol zu dem zweiteinfachsten Alken reagieren, nämlich Propen. In der Schule werden solche Versuche gelegentlich durchgeführt (siehe "Dehydratisierung eines Alkohols"), in der Industrie spielt die Dehydratisierung jedoch so gut wie keine Rolle. Allerdings haben Forscher des Fraunhofer-Instituts ein Verfahren zur Herstellung von Propen aus Propanol entwickelt.
5.3 Substitution
Wenn die OH-Gruppe von Propan-1-ol protoniert wird, kann sie leicht als Wasser-Molekül abgespalten werden, wobei ein primäres Carbenium-Ion zurückbleibt. Dieses kann dann ein neues Nucleophil aufnehmen, was zu einer Nucleophilen Substitution führt. Alternativ kann das Carbenium-Ion ein Proton abgeben, was zur Bildung von Propen führt. Im Endeffekt ist dies dann auch eine Dehydratisierung.
Verwendung
Neben seiner Verwendung als Ausgangsstoff für chemische Synthesen findet Propan-1-ol vor allem Anwendung als Lösemittel, zum Beispiel bei der Herstellung von Farbstoffen.
Die Verbindung wird auch in Reinigungs- und Desinfektionsmitteln eingesetzt, da Propan-1-ol Bakterien und Pilze, seltener auch Viren abtötet.
Propan-1-ol dient weiterhin als Edukt für die Synthese von Insektiziden, Herbiziden und Arzneimitteln.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia-Artikel "1-Propanol"