 |
 |
 |
|
| Brandfördernd | Ätzend | Reizend |
1. Einführung
Propanal C2H5-CHO das dritte Glied in der homologen Reihe der Alkanale nach Methanal und Ethanal.
2. Strukturdaten
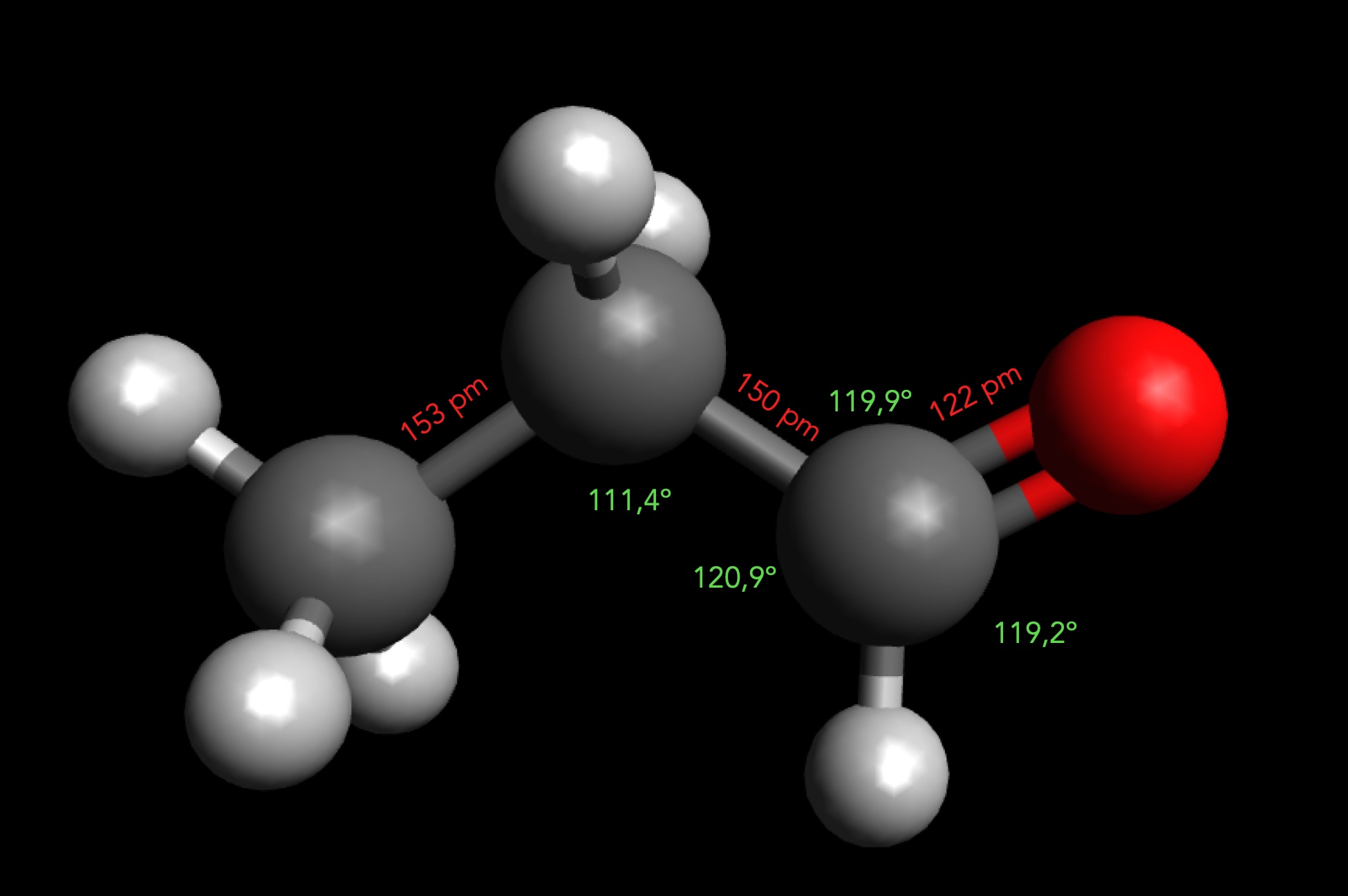
Das Propanal-Molekül
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Die Bindungswinkel und Bindungslängen wurden mit der Messfunktion der Software Avogadro ermittelt, nachdem zuvor die energetisch günstigste Konformation erzeugt wurde.
- Bindungswinkel C1-C2-C3: 111,4º
- Bindungswinkel C2-C3-H: 120,9º
- Bindungswinkel C2-C3-O: 119,9º
- Bindungswinkel C3-O-H: 119,2º
- Bindungslänge C3-C2: 153 pm (normaler Wert)
- Bindungslänge C2-C1: 150 pm (kürzer, da C1 sp2-hybridisiert ist)
- Bindungslänge C1=O: 122 pm (Doppelbindung)
Ob diese Daten den tatsächlichen Werten entsprechen, kann ich leider nicht überprüfen, die Fachliteratur und das Internet sind da nicht sehr mitteilsam.
3. Physikalische Eigenschaften
Überblick
| Molare Masse | 58,08 g/mol |
| Schmelztemperatur | -81 ºC |
| Siedetemperatur | 49 ºC |
| Dichte | 0,81 g/cm3 |
| Farbe | farblos |
| Geruch | stechend |
| Wasserlöslichkeit | 679 g/l |
| Dipolmoment | 2,520 D [3] |
| Brennbarkeit/Zündtemperatur | 190 ºC |
| Sonstiges | Die Dämpfe bilden mit Luft explosive Gemische |
3.1 Schmelz- und Siedepunkte
Der Schmelzpunkt von Propanal liegt bei -81 ºC und ist damit deutlich höher als die -129 ºC des entsprechenden Alkohols Propan-1-ol. An sich sollte man denken, dass Propan-1-ol eine höhere Schmelztemperatur hat als Propanal, weil Propan-1-ol H-Brücken bilden kann und Propanal nicht. Offensichtlich ist aber die Packungsdichte im Propanal-Kristall höher als die von Propan-1-ol.
Die Siedepunkt von Propanal beträgt 49 ºC und ist damit deutlich niedriger als der von Propan-1-ol mit 97 ºC. Dieses Tatsache kann leicht auf die fehlenden H-Brücken zurückgeführt werden.
| Verbindung | Siedetemperatur in ºC |
| Butan | -0,5 |
| Propan-1-ol | 97,2 |
| Propan-2-ol | 82,3 |
| Propanal | 49 |
Andererseits ist der Siedepunkt deutlich höher als der eines vergleichbaren Alkans (Butan). Dies ist auf das recht hohe Dipolmoment von 2,5 D zurückzuführen.
3.2 Löslichkeitsverhalten
Die Wasserlöslichkeit ist sehr groß, Propanal kann H-Brücken mit Wasser-Molekülen bilden. Mit Ethanol und Diethylether ist Propanal beliebig mischbar.
4. Gewinnung und Synthese
Wenn man im Chemieunterricht der Sek. II gut aufgepasst hat, werden einem wahrscheinlich sofort zwei mögliche Verfahren zur Synthese von Propanal einfallen:
- Oxidation von Propan-1-ol
- Reduktion von Propansäure
Recherchiert man in der Fachliteratur und im Internet, stößt man jedoch auf viele weitere Verfahren, nur die Reduktion der Propansäure wird nirgends genannt. Theoretisch ist diese Reaktion möglich, aber in der Praxis wird sie aus verschiedenen Gründen nicht angewendet.
Im Vollhardt/Schore werden vier Reaktionen vorgestellt, die zu Aldehyden und Ketonen führen, zur Herstellung von Propanal sind sie nur zum Teil geeignet:
- Oxidation von primären Alkoholen
- Ozonolyse von Alkenen
- Hydratisierung von Alkinen
- Friedel-Crafts-Acylierung
In der Wikipedia stößt man dann auf weitere Reaktionen, die sich zur Propanal-Synthese eignen:
- Hydroformylierung von Ethen
- Isomerisierung von Propylenoxid
- Katalytische Hydrierung von Acrolein
- Grignard-Reaktion von Ethylmagnesiumbromid mit Ameisensäureethylester
Wir wollen nun die einzelnen Reaktionen kurz vorstellen - aber wirklich nur kurz, weil das sonst den Rahmen dieser Seite sprengen würde.
4.1 Oxidation von Propan-1-ol
Dieses Verfahren wird durchaus angewandt (eher im Labor als in der Industrie). Die Oxidation kann mit Kaliumpermanganat/Schwefelsäure [1], mit Chrom(IV)-Reagenzien [4] oder mit Luftsauerstoff in Gegenwart der Katalysatoren Kupfer oder Platin erfolgen [1,4].
Laut [4] ist Luft das umweltfreundlichste Oxidationsmittel, an dieser "grünen" Methode wird zur Zeit intensiv geforscht.
4.2 Ozonolyse von But-2-en
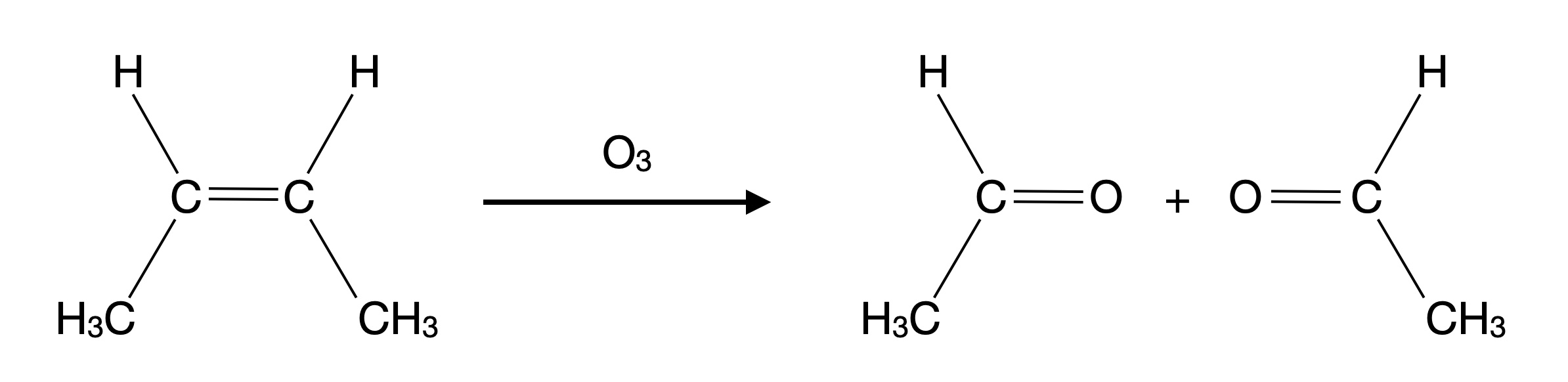
Ozonolyse von cis-But-2-en
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Die Ozonolyse bewirkt die Spaltung von Alkenen durch die Reaktion der C-C-Doppelbindung mit Ozon. Dabei können verschiedene Endprodukte erhalten werden: Alkohole, Aldehyde, Ketone oder sogar Carbonsäuren, je nach Reaktionsbedingungen [5].
4.3 Hydratisierung von Alkinen
Diese Reaktion eignet sich nicht zur Synthese eines Aldehyds. Die "Hydratisierung von Alkinen unter Katalyse mit Quecksilber-Ionen ergibt Ketone", ist in [4] zu lesen.
4.4 Friedel-Crafts-Acylierung
Auch diese Methode scheidet aus, wenn Propanal hergestellt werden soll. Bei der Friedel-Crafts-Acylierung wird - vereinfacht gesprochen - eine -CHO-Gruppe an einen Benzolring addiert.
4.5 Hydroformylierung von Ethen
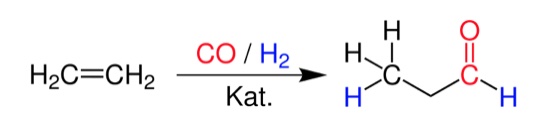
Quelle: Wikipedia
Dieses Bild zeigt die Hydroformylierung des Alkens Ethen.
Hydroformylierung
Text aus der Wikipedia, Hervorhebungen von mir.
Die Hydroformylierung (auch: Oxosynthese, seltener Roelen-Synthese oder Roelen-Reaktion) ist eine technisch bedeutende, homogen katalysierte Reaktion von Olefinen mit Kohlenstoffmonoxid und Wasserstoff. Die primären Produkte der Hydroformylierung sind Aldehyde mit einem Kohlenstoffatom mehr als das Olefinsubstrat. Diese Aldehyde werden zur Herstellung einer Vielzahl nützlicher Folgeprodukte verwendet, die Aldehyde selbst haben eine geringe Verwendbarkeit.
4.6 Isomerisierung von Propylenoxid
4.7 Katalytische Hydrierung von Acrolein
4.8 Grignard-Reaktion von Ethylmagnesiumbromid mit Ameisensäureethylester
Diese Methoden eignen sich ebenfalls zur Synthese von Propanal. Einzelheiten siehe den Abschnitt "Gewinnung und Darstellung" in dem entsprechenden Wikipedia-Artikel.
5. Reaktionen
5.1 Oxidation, Verbrennung
Wie alle Alkanale ist auch Propanal leicht oxidierbar. Bei der Verbrennung entstehen Kohlendioxid und Wasser, bei der Oxidation mit Oxidationsmitteln wie Kupferoxid, Kaliumpermanganat etc. bildet sich die Verbindung Propansäure, eine Carbonsäure.
5.2 Nucleophile Addition
Als Aldehyd kann Propanal nucleophile Additionsreaktionen eingehen.

Addition von Blausäure an Ethanal
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Hier sehen wir die Addition von Blausäure an Ethanal; die Reaktion mit Propanal müsste genau so verlaufen. Eine vergleichbare Reaktion läuft bei der Plexiglas-Synthese ab; hier wird Blausäure an das Keton Aceton addiert.
Im ersten und langsamen Schritt setzt sich das Cyanid-Ion -CN (mit der negativen Ladung am C-Atom!) an das positiv polarisierte C-Atom des Aldehyds, und die negative Ladung, die das Cyanid-Ion mitbringt, wird auf das elektronegative O-Atom übertragen. Im zweiten und schnellen Schritt setzt sich ein Proton der Blausäure HCN an dieses nunmehr negativ geladene O-Atom, und fertig ist das sogenannte Cyanhydrin.
Die wesentliche Bedeutung der Cyanhydrin-Bildung liegt darin, dass die -CN-Gruppe leicht in eine COOH-Gruppe überführt werden kann. Auf diese Weise kann man ein Aldehyd in eine Hydroxy-Carbonsäure überführen. Aus Acetaldehyd würde sich dann 2-Hydroxy-propansäure bilden, aus Propanal entsprechend 2-Hydroxy-butansäure.
Weitere wichtige nucleophile Additionsreaktionen sind
- die Addition von Wasser
- die Addition von Alkoholen
- die Addition von Aminen
- die Aldolkondensation
- die Grignard-Reaktion
All diese Reaktionstypen werden auf den Seiten zur Nucleophilen Addition in der Abteilung "Studienvorbereitung Organik" auf dieser Homepage näher beschrieben.
Natürliches Vorkommen
Propanal kommt in den Knollen von Allium cepa (Zwiebel), in den Samen von Avena sativa (Hafer), in der Frucht von Cucumis sativus (Gurke) sowie in den Pflanzen von Glycine max (Sojabohne), Medicago sativa (Luzerne) und Oryza sativa (Reis) vor [6].
Verwendung
In der chemischen Industrie
Propanal ist ein wichtiger Ausgangsstoff und Zwischenprodukt für die Herstellung von Kunststoffen, Weichmachern, Aroma- und Duftstoffen, Schädlingsbekämpfungsmitteln und Medikamenten.
Bekannte Verbindungen, die aus Propanal industriell hergestellt werden sind:
- 1-Propanol
- 1-Propylamin
- Propansäure
Außerdem wird Propanal mit Acetaldehyd zu Copolymeren umgesetzt.
Ferner ist Propanal ein wichtiger Ausgangsstoff zur Produktion von Heterocyclen wie Imidazol oder 3-Methylindol.
Schließlich wir Propanal bei Acetalisierungen, Iminbildungen, Olefinierungen und Aldolreaktionen verwendet.
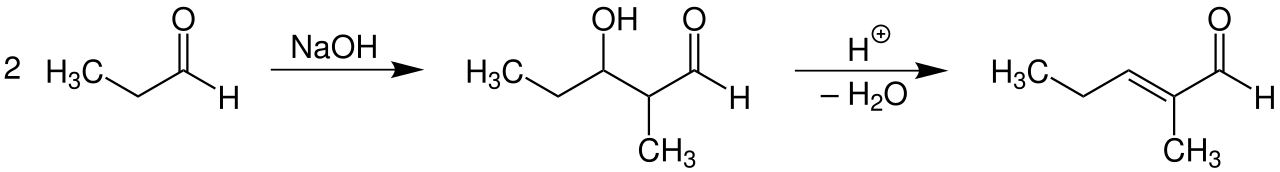
Aldolkondensation mit Propanal
Renate90, Public domain, via Wikimedia Commons
Dieses Bild zeigt die Aldolkondensation am Beispiel des Propanals.
Im Alltag
Propanal wird als Duftstoff in der Parfümindustrie verwendet, da es einen scharfen, fruchtigen Geruch hat. Es findet auch Anwendung als Aromastoff in der Lebensmittelindustrie.
Quellen:
- Wikipedia, Artikel "Propionaldehyd"
- Römpp Chemie-Lexikon, 9. Auflage 1992
- "Experimental data for CH3CH2CHO (Propanal)" auf cccbdb.nist.gov.
- K. P. C. VollhardT, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- "Ozonolyse, Criegee-Mechanismus" auf Organische-Chemie.de
- "Propanal" in Dr. Duke's Phytochemical and Ethnobotanical Databases.