 |
 |
 |
|
| Brandfördernd | Gas unter Druck | Ernste Gesundheitsgefahr |
1. Einführung
Ethansäure oder Essigsäure CH3-COOH, ist die zweiteinfachste Carbonsäure, nach
Methansäure das zweite Glied in der
2. Strukturdaten
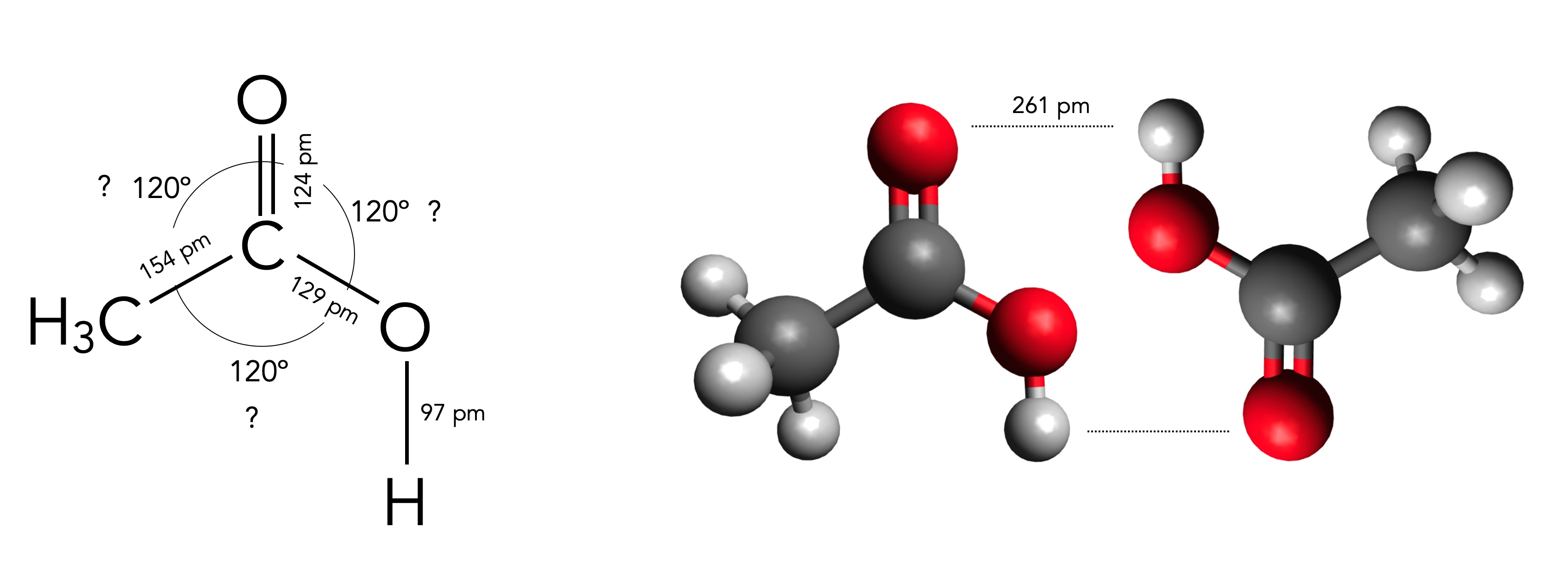
Strukturdaten des Ethansäure-Moleküls sowie des Ethansäure-Dimers
Autor: Ulrich Helmich 11/2024, Lizenz: Public domain
Das Ethansäure-Molekül ist im Prinzip genau so aufgebaut wie das Methansäure-Molekül, nur ist das H-Atom durch eine Methyl-Gruppe ersetzt worden.
Die im Bild zu sehenden Bindungslängen wurden dem Wikipedia-Artikel zur Essigsäure entnommen. In diesem Artikel wird auch behauptet, dass alle drei Bindungswinkel am sp2-hybridisierten C-Atom den Wert 120 Grad besitzen. Dies kommt mir allerdings etwas unwahrscheinlich vor, daher die Fragezeichen an den drei Zahlen.
Bei der Methansäure finden sich in der Fachliteratur exaktere Strukturdaten, die ich hier zum Vergleich noch einmal präsentiere:

Strukturdaten des Methansäure-Moleküls - zum Vergleich
Autor: Ulrich Helmich 10/2024, Lizenz: Public domain
Beim Methansäure-Molekül "drücken" die vier Bindungselektronen sowie die vier freien Elektronen des O-Atoms die C-H-Bindung und die C-O-Bindung ziemlich stark auseinander, so dass der H-C-O-Bindungswinkel nur noch 111 Grad beträgt statt der idealen 120 Grad. Entsprechend groß dann der H-C=O- und der O=C-O-Winkel (124 bzw 125 Grad).
Warum das jetzt beim Ethansäure-Molekül anders sein soll, erschließt sich mir nicht. Ich lasse mich aber gern von aufmerksamen Lesern oder Leserinnen korrigieren!
Wie man in der Abbildung 1 auch noch sehen kann, bilden die Ethansäure-Moleküle Dimere, die durch zwei H-Brücken zusammengehalten werden - ähnlich wie bei der Methansäure.
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedepunkt
Der Schmelzpunkt von Ethansäure beträgt 17 ºC, der Siedepunkt liegt bei 118 ºC . Diese Werte sind etwas größer als bei der vergleichbaren Methansäure, was sich durch etwas stärkere London-Kräfte erklärt. Das Dipolmoment der Essigsäure hat den Wert 1,70 D und ist damit etwas größer als bei der Ameisensäure (1,41 D). Daher sind auch die Keesom-Kräfte etwas größer als bei der Ameisensäure, was die beiden Werte ebenfalls nach oben treibt.
Den stärksten Einfluss auf den Schmelz- und Siedepunkt haben aber die Wasserstoffbrücken-Bindungen. Die Carboxy-Gruppe hat ein O-Atom, das H-Brücken-Akzeptor ist und eine OH-Gruppe, die gleichzeitig H-Brücken-Akzeptor und -Donator ist. Ein Ethansäure-Molekül kann daher H-Brücken zu zwei anderen Molekülen gleichzeitig ausbilden oder alternativ ein Dimer mit einem anderen Molekül bilden, das durch zwei H-Brücken gebunden ist.

Zwei Methansäure-Moleküle bilden ein Dimer
Autor: Ulrich Helmich 10/2024, Lizenz: Public domain
Dieses Bild zeigt ein Methansäure-Dimer. Ethansäure-Dimere sind ähnlich aufgebaut.
3.2 Löslichkeitsverhalten
Die extrem große Wasserlöslichkeit der Ethansäure - sie ist in jedem Verhältnis mit Wasser mischbar - wird dadurch erklärt, dass Ethansäure-Molekül H-Brücken mit Wasser-Molekülen bilden kann. Aber auch mit anderen Alkoholen (Ethanol, Propanol) ist Ethansäure gut mischbar, ebenso mit Diethylether. Das O-Atom des Ethers kann als H-Brücken-Akzeptor wirken.
In unpolaren Flüssigkeiten wie beispielsweise Hexan ist Ethansäure nur schlecht löslich. Ähnlich wie Wasser bilden die Moleküle der Ethansäure "lieber" untereinander Aggregate, die durch H-Brücken zusammengehalten werden. Eingeschobene Hexan-Moleküle würden diese energetisch günstige Struktur nur stören und müssen daher unter sich bleiben (hydrophober Effekt).
3.3 Weitere Eigenschaften
Ethansäure ist eine farblose und leicht flüchtige Flüssigkeit, die einen stechenden Geruch nach Essig hat. Die Dichte von Essigsäure beträgt 1,05 g/cm3 und liegt damit unter der Dichte der Ameisensäure (1,22 g/cm3) - was ungewöhnlich ist.
4. Gewinnung und Synthese
4.1 Industrielle Synthese von Ethansäure
4.1.1 Biotechnische Herstellung
Essigsäure wird heute weitgehend biotechnisch hergestellt, und zwar durch Vergärung von Ethanol (der ebenfalls biotechnisch hergestellt wird). Die Essigsäurebakterien Acetobacter und Gluconobacter wandeln Ethanol aerob (also mit Hilfe von Luftsauerstoff) zunächst in Ethanal um, dann - wieder mit O2 - in Ethansäure:
$CH_3 CH_2 OH + \frac{1}{2} O_2 \to CH_3CHO + H_2O$
$CH_3CHO + \frac{1}{2} O_2 \to CH_3COOH$
Der Ausgangsstoff für diese Synthese muss kein reiner Ethanol sein, sondern auch Wein, Bier oder Malz können für dieses Verfahren verwendet werden. Es muss nur für eine ausreichende Sauerstoffversorgung gesorgt werden, weil die Bakterien da sehr empfindlich sind.
Es gibt auch Bakterien (zum Beispiel Clostridium), die das Monosaccharid Glucose direkt in Essigsäure umwandeln können:
$C_6H_{12}O_6 \to 3 \ CH_3COOH$
Allerdings sind diese Bakterien sehr empfindlich gegen die von ihnen selbst gebildete Säure, so dass der Prozess schon bei recht geringen Säurekonzentrationen zum Stillstand kommt. Die Essigsäure muss dann durch Destillation vom Gemisch abgetrennt werden, was das Verfahren verteuert.
4.1.2 Oxidation von Butan
Die Oxidation von Butan führt nicht nur zur Bildung von Butanolen, Butanal, Butanon und Butansäure, sondern kann auch Essigsäure liefern:
$C_4H_{10} + \frac{5}{2} O_2 \to 2 \ CH_3COOH + H_2O$
Seit den 50er Jahren des letzten Jahrhunderts gibt es viele großtechnische Anlagen, in denen Butan bei Temperaturen von 170 bis 200 ºC und hohen Drücken zu Essigsäure umgesetzt wird. Allerdings fallen bei diesem Prozess viele Nebenprodukte an, so dass das Verfahren heute als unwirtschaftlich gilt.
4.1.3 Oxidation von Ethen
Eine weitere Möglichkeit zur Synthese von Essigsäure geht vom Ethen aus. Die Reaktion verläuft in mehreren recht komplexen Einzelschritten, bei denen Palladium(II)-chlorid als Katalysator wirkt. Als Zwischenprodukt entsteht durch Addition von H2O und anschließende Oxidation zunächst Ethanal:
$C_2H_4 + \frac{1}{2} O_2 \to CH_3CHO$
Dieses Zwischenprodukt reagiert dann mit Sauerstoff zu Ethansäure:
$2 \ CH_3 CHO + O_2 \to 2 \ CH_3COOH$
Mehr zu diesem Verfahren können Sie auf dieser Wikipedia-Seite nachlesen.
4.1.4 Oxidation von Methanol
Ein etwas neueres Verfahren zur Herstellung von Essigsäure ist die direkte Oxidation von Methanol mit Kohlenmonoxid:
$CH_3 OH + CO \to CH_3 COOH$
Diese Reaktion erfolgt unter hohem Druck und bei Temperaturen zwischen 150 und 200 ºC. Dazu wird ein Rhodium-Katalysator eingesetzt. Die Ausbeute ist sehr gut und liegt bei über 99%.
Mehr zu diesem Verfahren können Sie auf dieser Wikipedia-Seite nachlesen.
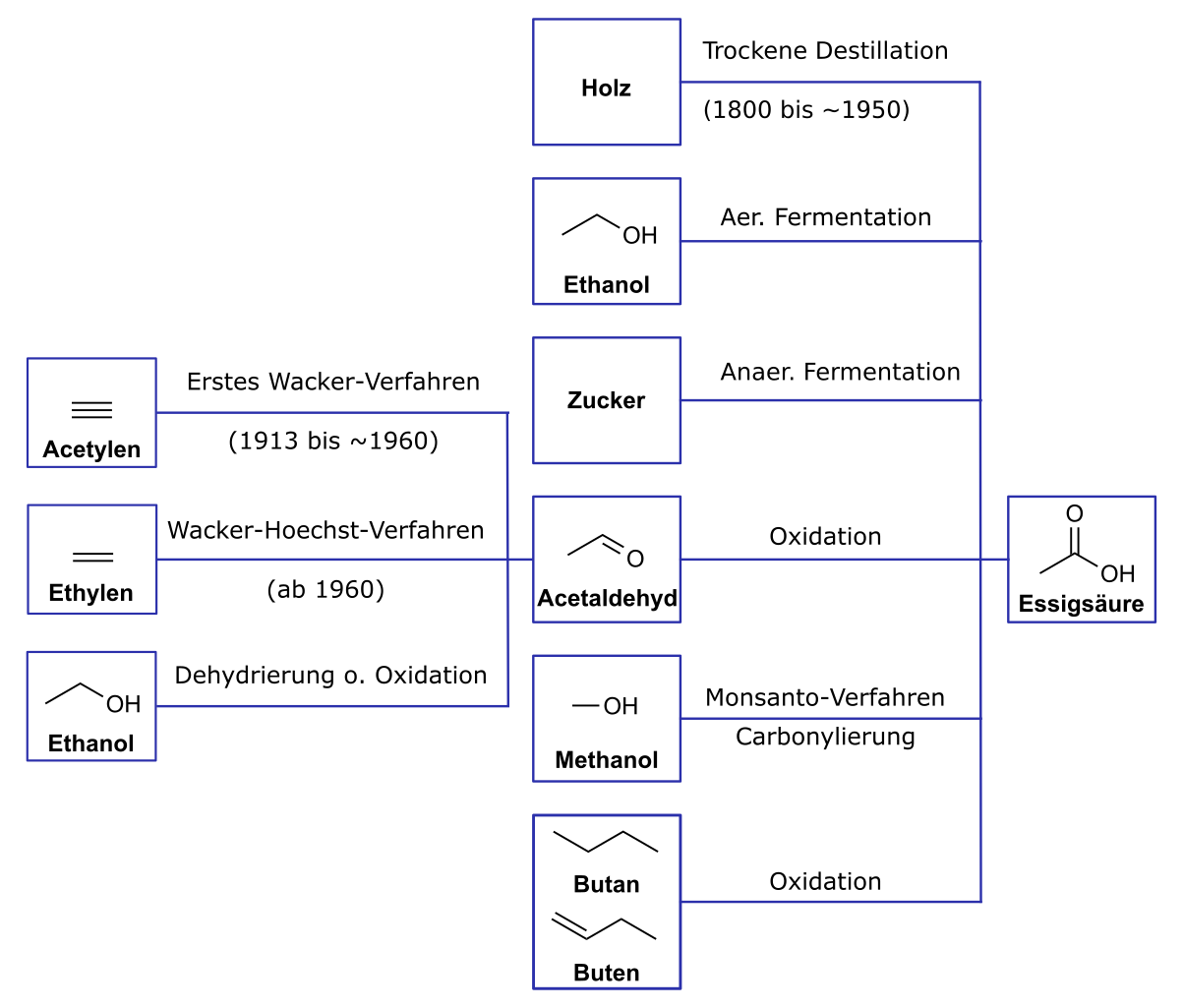
Synthesewege der Essigsäure
Original: ZdBdLaLaLa Vector: Volker-Morath, Public domain, via Wikimedia Commons
4.2 Laborsynthesen
In der Fachliteratur lassen sich vor allem zwei Methoden zur Darstellung von Essigsäure finden. Beide Methoden werden unter Punkt 7 etwas näher erläutert.
In dem ersten Schulversuch wird Essigsäure durch Oxidation von Ethanol hergestellt, bei dem zweiten Versuch durch Reaktion von Schwefelsäure mit Natriumacetat - frei nach dem Motto "starke Säure verdrängt schwache Säure aus ihren Salzen".
5. Reaktionen
5.1 Zersetzung
Essigsäure ist eine recht stabile Verbindung, die an der Luft aber vollständig zu Kohlendioxid und Wasser oxidiert werden kann:
$H_3C \mbox{-} COOH + 2 \ O_2 \to 2 \ CO_2 + 2 \ H_2O$
Bei Zimmertemperatur läuft diese exotherme Reaktion aber extrem langsam ab.
5.2 Reaktion mit Metallen
Essigsäure ist eine recht starke Carbonsäure - im Vergleich zu anorganischen Säuren wie beispielsweise Schwefelsäure ist Essigsäure natürlich sehr schwach. Aber dennoch reagiert Essigsäure mit vielen Metallen zu Acetaten.
$H_3C \mbox{-} COOH + Na \to H_3C \mbox{-} COONa + \frac{1}{2} H_2$
Vor allem mit unedlen Metallen wie Alkalimetallen, Erdalkalimetallen, aber auch mit Eisen oder Zink reagiert Essigsäure bei Zimmertemperatur recht schnell (natürlich kein Vergleich mit der entsprechenden Reaktion von Salz- oder Schwefelsäure). Sogar mit dem Edelmetall Kupfer findet bei erhöhter Temperatur eine Reaktion statt, es bildet sich dann Kupferacetat, das besser als Grünspan bekannt ist.
Laut der Gefahrstoffordnung für Schulen in NRW darf 90%ige Ameisensäure in der Sek. I verwendet werden (S-Stufe 2), sogar für Schülerversuche ("SI = Schülerversuche in den Jahrgangsstufen 5-13 möglich").
5.3 Reaktion mit anorganischen Salzen
Bekannt ist die Reaktion von Essigsäure mit Calciumcarbonat ("Kalk"). Dies macht man sich bei der Verwendung von Essigsäure in Haushaltsreinigern zum Entkalken von Gegenständen zu Nutze:
$2 \ H_3C \mbox{-} COOH + CaCO_3 \to (H_3C \mbox{-} COO)_2Ca + CO_2 + H_2O$
5.4 Substitutionsreaktionen
Wie die meisten Carbonsäuren kann auch Essigsäure Ester mit ein-, zwei- oder dreiwertigen Alkoholen bilden.
Auch mit Ammoniak und Aminen kann Essigsäure ähnliche wie andere Carbonsäuren reagieren, es entstehen dann Amide.
Allgemein gehören diese Reaktionen zu den Substitutionsreaktionen. Die OH-Gruppe der Carboxy-Gruppe wird gegen eine andere Gruppierung ausgetauscht. Bei der Bildung eines Esters gegen einen Alkohol-Rest, bei der Bildung von Amiden gegen den Rest eines Amins (Ammoniak-Derivate mit einem oder zwei Alkylresten). Auch die Bildung von Anhydriden (Austausch der OH-Gruppe gegen einen anderen Säurerest) und Säurechloriden (OH-Gruppe wird durch ein Chlor-Atom ersetzt) gehört zu den Substitutionsreaktionen der Carboxy-Gruppe.
Auf dieser Seite aus der "Studienvorbereitung Organik" werden die hier nur kurz angerissenen Reaktionen ausführlich von mir besprochen.
Wer noch tiefer in die Materie einsteigen will, sollte auf diese Vertiefungsseiten in der "Studienvorbereitung Organik" gehen.
5.5 Reduktion zu Ethanal und Ethanol
Wie alle Carbonsäuren kann auch Essigsäure durch den Einsatz spezieller Reduktionsmittel reduziert werden. Die Reduktion um eine Stufe (+ 2 Elektronen) führt zum Aldehyd Ethanal, die Reduktion um zwei Stufen (+ 4 Elektronen) zum Alkohol Ethanol. Das beliebteste Reduktionsmittel, mit dem man aus einer Carbonsäure einen primären Alkohol herstellen kann, ist das Lithiumaluminiumhydrid LiAlH4 [8,9].
5.6 Reaktionen am α-C-Atom
Typisch für Carbonsäuren sind auch Reaktionen am α-C-Atom, also an dem C-Atom, das der COOH-Gruppe direkt benachbart ist. Ethansäure hat an seiner Methyl-Gruppe das α-C-Atom, daher kommen auch solche Reaktionen für Essigsäure in Frage.
5.7 Decarboxylierung
Eine weitere für Carbonsäuren typische Reaktion, die Decarboxylierung, ist für Essigsäure ebenfalls möglich. Wenn CH3-COOH die COOH-Gruppe abgibt, sollten sich Methan CH4 und CO2 bilden.
6. Vorkommen und Verwendung
6.1 Vorkommen
6.1.1 Freie Essigsäure
Essigsäure in mehr oder weniger reiner Form kommt in vielen Pflanzensäften und -ölen vor. Essigsäurebakterien können Ethanol zu Essigsäure oxidieren. Diese Essigsäurebakterien kommen überall dort vor, wo Hefepilze Glucose oder andere Monosaccharide zu Ethanol vergären.
6.1.2 Acetyl-CoA
Acetyl-Coenzym A ist die "beladene" Form des Coenzym A.
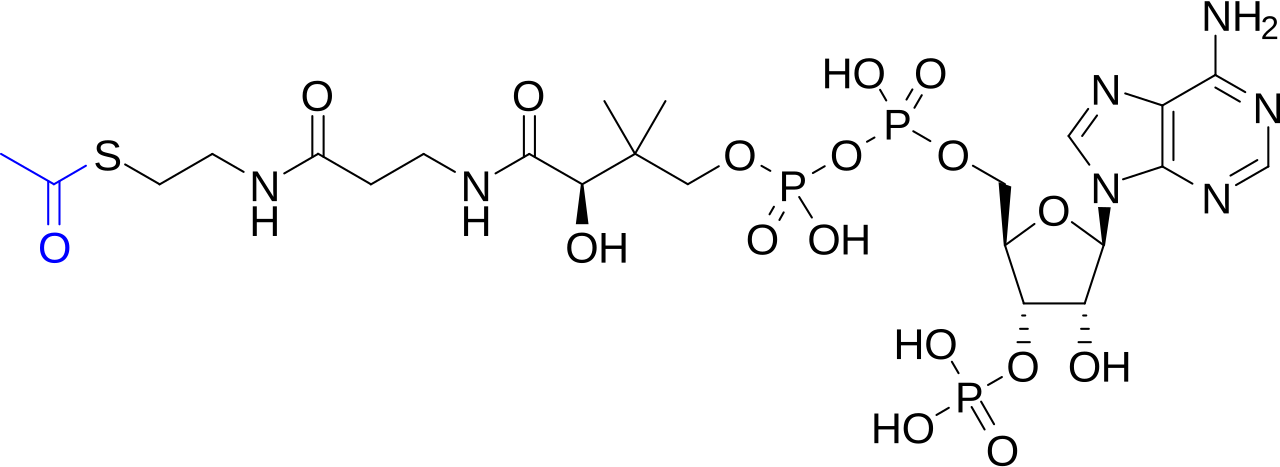
Acetyl-CoA
User:Bryan Derksen (original) and DMacks (talk) (color-change), Public domain, via Wikimedia Commons
Dieses Coenzym kommt in vielen Stoffwechselreaktionen der Tiere, Pflanzen und anderer Lebewesen vor, man denke nur an den Übergang von der Glycolyse zum Citratzyklus, wo das Endprodukt der Glycolyse, der C3-Körper Pyruvat, ein C-Atom als CO2 abgibt. Der übrig bleibende C2-Körper ist nichts anderes als ein Acetyl-Rest (Essigsäure-Rest), der an das Coenzym A gebunden wird, wobei Acetyl-Coenzym A entsteht. Oft wird Acetyl-CoA auch als "aktivierte Essigsäure" bezeichnet.
Das Acetyl-CoA fließt dann in den Citratzyklus ein und überträgt den Essigsäure-Rest auf Oxalacetat (ein C4-Körper), der dadurch zum C6-Körper Citrat wird.
Auf dieser Seite in der Biologie-Abteilung dieser Homepage wird der Anfangsschritt des Citratzyklus, der eben im Text nur kurz angerissen wurde, ausführlich mit Reaktionsschemata erläutert.
6.1.3 Acetylcholin
Diese Verbindung ist ein wichtiger Neurotransmitter, der nicht nur in der Skelettmuskulatur eine entscheidende Rolle spielt, sondern auch bei den Synapsen des Gehirns.
Weitere Informationen zu diesem Neurotransmitter finden Sie auf dieser Seite im Biologie-Lexikon dieser Homepage.
6.1.4 Chitin
Dieses Bio-Polymer ist neben Cellulose das am weitesten auf der Erde verbreitete Bio-Molekül. Es kommt in der Zellwand von Pilzen vor und auch in der Cuticula von Insekten und anderen Gliedertieren (Spinnen, Krebse etc.).
Ähnlich wie Cellulose ist Chitin ein Polymer aus Monosacchariden, also ein Polysaccharid. Allerdings ist ein Großteil der Chitin-Monomere mit einer zusätzlichen Acetamid-Gruppe ausgestattet, also einem Acetyl-Rest, der an einem Stickstoff-Atom hängt:
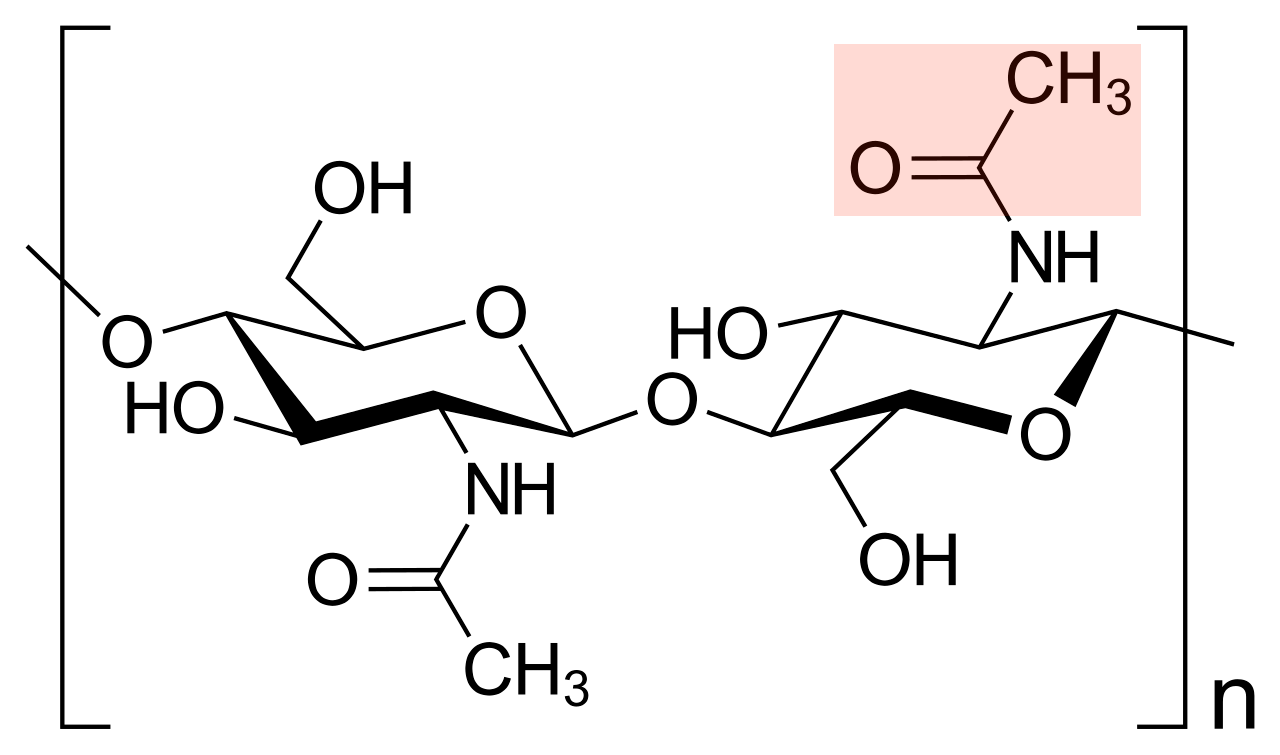
Baueinheit des Chitin-Polymers
Dschanz, Public domain, via Wikimedia Commons. Farbliche Hervorhebung des Acetyl-Restes: Ulrich Helmich 11/2024
6.1.5 Rolle von Essigsäure in der Epigenetik
Die Acetylierung von Histonen spielt eine wichtige Rolle bei der epigenetischen Regulation der Genaktivität. Und zwar wird hierbei das N-Atom der Lysin-Reste in bestimmten Histonen mit einer Acetyl-Gruppe versehen. Derart acetylierte Histone verändern die Struktur der aufgewickelten DNA ein wenig, was wiederum zur Folge hat, dass die DNA-Polymerase die entsprechenden Gene leichter ablesen kann.
"Histonacetylierung führt zu einer Öffnung der Chromatinstruktur und dient somit der Hochregulation, indem das Binden von Transkriptionsfaktoren samt Transkriptionsmaschinerie begünstigt wird." [7].
6.2 Verwendung
6.2.1 Geschmacksstoff
Nicht nur die Essigsäure selbst (zum Beispiel in Form von Haushalts-Essig = 5-prozentige Lösung von Essigsäure), sondern auch einige der Essigsäure-Salze werden als Geschmacksstoff bei der Lebensmittelzubereitung verwendet. Einzelheiten dazu siehe den Wikipedia-Artikel "Essigsäure", Abschnitt "Verwendung".
6.2.2 Herstellung von Milchprodukten
Bestimmte Milchprodukte werden mit Hilfe von Essigsäure hergestellt. Die Wikipedia nennt hier die Käsesorten Mascarpone und Ziger.
6.2.3 Konservierungsmittel
Essigsäure verlangsamt durch ihren niedrigen pH-Wert bestimmte physiologische Prozesse, die in Bakterien ablaufen. Daher wird frisches Fleisch mit Essigsäure abgewaschen oder sogar in Essigsäure zum Haltbarmachen eingelegt. Auch Gurken und andere Lebensmittel werden in Essigsäure eingelegt.
6.2.4 Technische / industrielle Verwendung
Mehr als 65% der weltweit hergestellten Essigsäure wird für die Produktion von Polymeren auf der Basis von Vinylacetat eingesetzt.
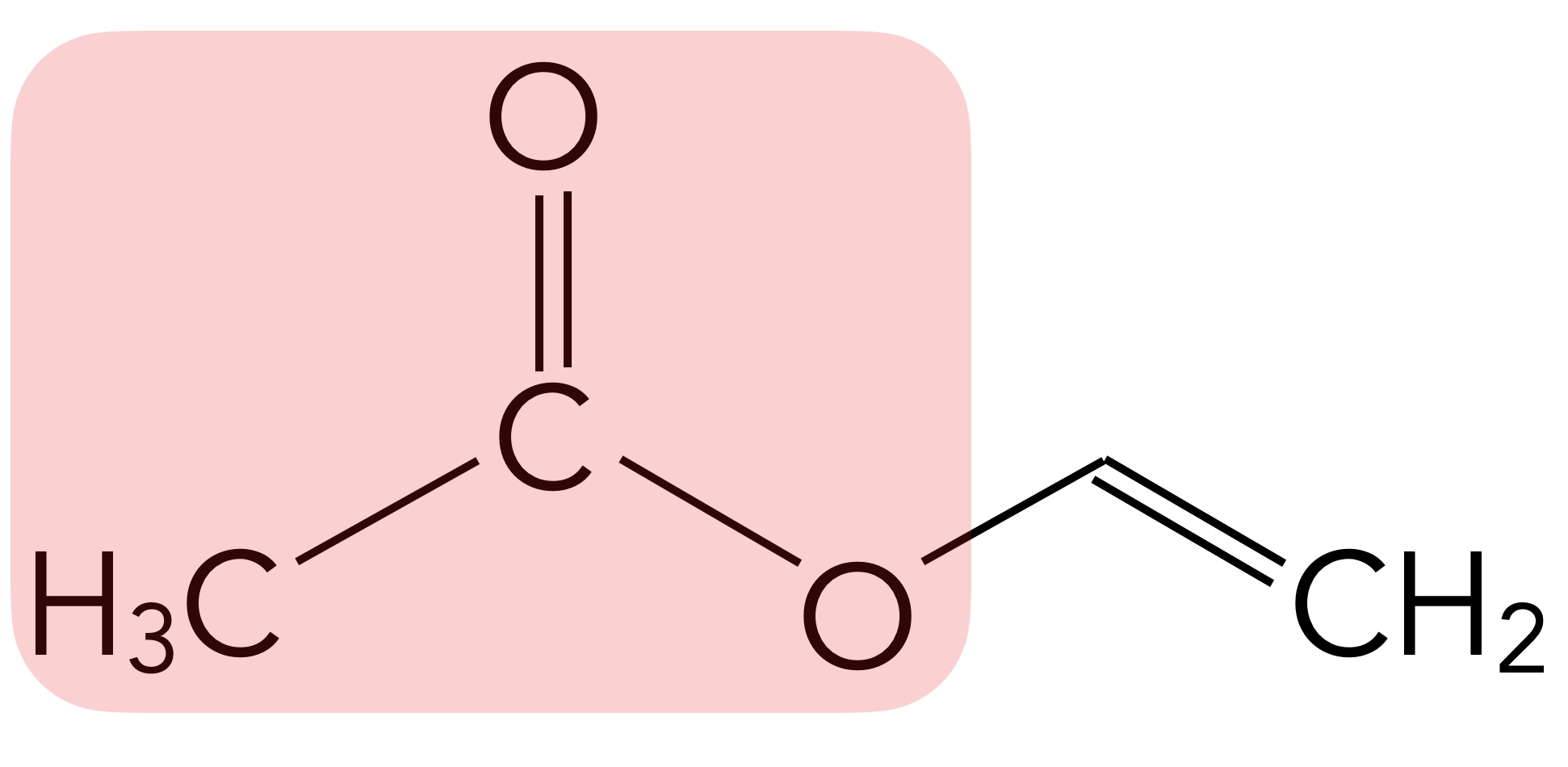
Vinylacetat, der Acyl-Rest ist rot hervorgehoben
Autor: Ulrich Helmich 11/2024, Lizenz: Public domain
Polyvinylacetat (PVAc) wird in Farben und Klebstoffen verwendet. Ein anderes Polymer, das unter Verwendung von Essigsäure hergestellt wird, ist Celluloseacetat. In der Industrie wird Essigsäure auch als Lösungsmittel eingesetzt, sowie zur Herstellung verschiedener Ester, von Essigsäure-Anhydrid, Acetanilid, Essigsäurechlorid oder Ammoniumacetat.
Medizinische Verwendung
(aus der Wikipedia)
Die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation führt Essigsäure als ein für die Behandlung von HNO-Erkrankungen des Kindesalters angewandtes Mittel.
Essigsäure wird beim Screening für die Erkennung von Gebärmutterhalskrebs in Subsahara-Afrika angewendet. Die Essigsäure wird dazu auf den Gebärmutterhals aufgetragen. Färbt sich der Bereich nach etwa einer Minute weiß, gilt der Test als positiv.
Essigsäure wird zum Ansäuern von Hygiene- und Kosmetikprodukten verwendet, etwa zum Peeling. Die Essigsäure lässt die obere Schicht abgestorbener Hautzellen abblättern und hinterlässt eine glattere Oberfläche. Der Effekt wurde schon von der ägyptischen Herrscherin Kleopatra genutzt, deren Milchbäder ebenfalls hautglättende Essigsäure enthielten.
7. Schulversuche mit Essigsäure
7.1 Darstellung
7.1.1 aus Ethanol
Ein Gemisch von Ethanol und 40-prozentiger Schwefelsäure wird zusammen mit einer Lösung Natriumdichromat (Oxidationsmittel) in einem Rundkolben erhitzt. Die entstandene Essigsäure kann dann zusammen mit dem Wasser abdestilliert werden, man erhält verdünnte Essigsäure, die aber durch Nebenprodukte verunreinigt ist [6].
$2 \ NaCr_2O_7 + 8 \ H_2SO_4 + 3 \ C_2H_5OH \to 2 \ Na_2SO_4 + 2 \ Cr_2(SO_4)_3 + 3 \ CH_3COOH + 11 H_2O$
7.1.2 aus Natriumacetat
Dieses Verfahren ist weniger aufwendig als das vorherige. In einem Rundkolben wird einfach ein Gemisch aus entwässerten Natriumacetat und konz. Schwefelsäure erwärmt. Die gebildete Essigsäure kann abdestilliert werden, in dem Kühler kondensiert dann konz. Essigsäure.
7.2 Eigenschaften von Essigsäure
7.2.1 Reaktion mit Metallen
In vier Reagenzgläser gibt man Magnesiumspäne, Zinkpulver, Eisenspäne und Kupferpulver oder -späne. Dann füllte man ein paar Milliliter 10-prozentige Essigsäure in die Reagenzgläser und beobachtet. Je unedler das Metall, desto stärker die Blasenbildung (Wasserstoff). Das Kupfer reagiert bei Zimmertemperatur nicht. Beim vorsichtigen Erwärmen sollte sich aber eine Reaktion einstellen.
Beim Magnesium sollte die Reaktion so heftig verlaufen, dass man das entstehende Gas mit einem anderen Reagenzglas auffangen kann. Anschließend wird die Knallgasprobe durchgeführt.
Statt mit Kupfer kann man die Reaktion auch mit schwarzem Kupferoxid bei Zimmertemperatur durchführen. Es dauert dann allerdings ein paar Tage, bis sich eine deutliche Menge von grünem Kupferacetat gebildet hat.
7.2.2 Reaktion mit Calciumcarbonat
Ein Reagenzglas wird mit etwas Calciumcarbonat gefüllt und dann mit verd. Essigsäure überschüttet. Es setzt eine heftige Reaktion ein mit einer deutlichen Erwärmung und Gasbildung. Hält man einen brennenden Holzspan in das Reagenzglas, so erlischt dieser, weil sich Kohlendioxid gebildet hat.
Diesen Versuch kann man auch abwandeln, um beispielsweise verkalkte Haushaltsgegenstände mit Essig zu reinigen.
7.2.3 Oxidierbarkeit
Man gibt etwas konz. Essigsäure mit der doppelten Menge ca. 30-prozentiger Schwefelsäure in ein Gefäß und fügt ca. 1 ml 6-prozentige Kaliumpermanganat-Lösung dazu.
Den gleiche Versuch führt man mit konz. Ameisensäure durch.
Nach einiger Zeit hat sich die Lösung mit der Ameisensäure vollständig entfärbt, während sich die Lösung mit der Essigsäure nicht verändert hat oder höchstens etwas blasser geworden ist.
Ameisensäure lässt sich sehr leicht oxidieren und kann daher als Reduktionsmittel eingesetzt werden, Essigsäure (und die höheren Carbonsäuren) dagegen können nicht mehr so einfach oxidiert werden. Dafür sind stärkere Oxidationsmittel nötig als Kaliumpermanganat.
7.2.4 Brennbarkeit
In einem Verbrennungslöffel wird etwas konz. Essigsäure zum Sieden erhitzt. Die entstehenden Dämpfe kann man dann leicht entzünden.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Felixberger: Chemie für Einsteiger, Springer Nature 2017
- Schirmeister, Schmuck, Wich: Beyer/Walter Organische Chemie, 25. Auflage 2015.
- Wikipedia, Artikel "Essigsäure"
- Thomas Seilnacht, Artikel "Essigsäure"
- Just, Hradetzky, Chemische Schulexperimente Band 4, Frankfurt/M. 1978.
- DocCheck Flexikon, Artikel "Epigenetik"