1. Einführung
In der petrochemischen Industrie hat Propen eine sehr wichtige Bedeutung. Gleich nach Ethen ist Propen der wichtigste Ausgangsstoff für Synthesen, zumindest behauptet das die englische Wikipedia. Der deutsche Wikipedia-Eintrag ist relativ kurz, so dass man kaum etwas mit ihm anfangen kann.
2. Struktur und Strukturdaten
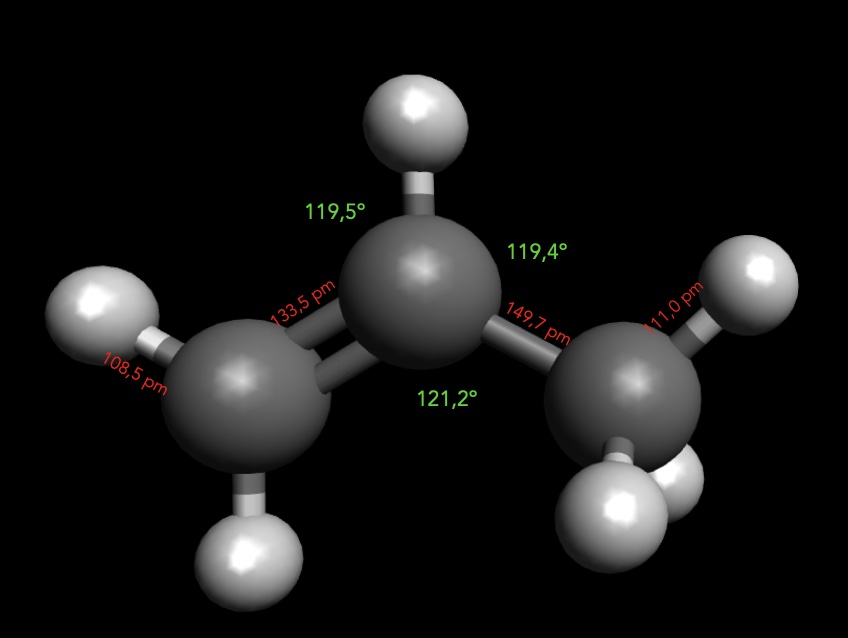
Strukturdaten des Propen-Moleküls
Autor: Ulrich Helmich 2025, Lizenz: Public domain.
Die beiden C-Atome der C=C-Doppelbindung sind sp2-hybridisiert, während das nicht an der Doppelbindung beteiligte C-Atom sp3-hybridisiert ist. Daher sind die C-H-Bindungen an den C-Atomen der Doppelbindung mit ca. 108 pm auch kürzer als die C-H-Bindungen der Methyl-Gruppe mit ca. 110 pm. Der C=C-C-Bindungswinkel beträgt 121,2 ºC und liegt damit nahe am Ideal von 120 ºC für sp2-hybridisierte Atome.
3. Physikalische Eigenschaften
Die physikalischen Eigenschaften des Propens sind vergleichbar mit denen des Ethens.
| Eigenschaft | Ethen | Propen |
| Schmelzpunkt | -169,2 ºC | -185,3 ºC |
| Siedepunkt | -103,8 ºC | -47,7 ºC |
| Dichte | 1,178 kg/m3 | 1,91 kg/m3 |
| Wasserlöslichkeit | 130 mg/l | 384 mg/l |
| Dipolmoment | 0,0 D | 0,366 D |
Etwas ungewöhnlich ist der niedrigere Schmelzpunkt des Propens, eigentlich sollte man einen höheren Schmelzpunkt als beim Ethen erwarten, zumal auch das Dipolmoment deutlich größer ist. Offensichtlich sind die Propen-Moleküle so "ungünstig" geformt, dass die Kristallbildung erschwert wird, so dass die Packungsdichte im festen Zustand kleiner ist als beim Ethen.
Dass der Siedepunkt des Propens höher ist als der des Ethens, ist zu erwarten und mit den stärkeren London-Kräften aufgrund der größeren Kontaktfläche zu erklären. Entsprechend ist auch die Dichte etwas größer als die des Ethens.
Die deutlich höhere (aber immer noch sehr geringe) Wasserlöslichkeit des Propens lässt sich mit dem vorhandenen Dipolmoment des Propen-Moleküls erklären, das sich auf die sp2-Hybridisierung der beiden C-Atome zurückführen lässt.
Die Elektronen in sp2-Orbitalen befinden sich etwas näher am Kern als die Elektronen der sp3-Orbitale. Darum ist hier die Elektronendichte etwas höher, was zu einer leicht polaren C-C-Einfachbindung führt und damit zu einem kleinen Dipolmoment.
4. Gewinnung und Synthese
4.1 Steamcracking
Propen lässt sich durch Steamcracking von längerkettigen Alkanen gewinnen. Dabei werden die Alkan-Moleküle durch die Hitzeeinwirkung gespalten. Bei dem beiden Spaltprodukten werden dann beiden die CH2-Gruppen an der "Bruchkante" durch je eine CH3-Gruppe ersetzt. Dazu sind zwei H-Atome erforderlich, deren "Entnahme" dann zu einer C=C-Doppelbindung in einem der beiden Bruchstücke führt.
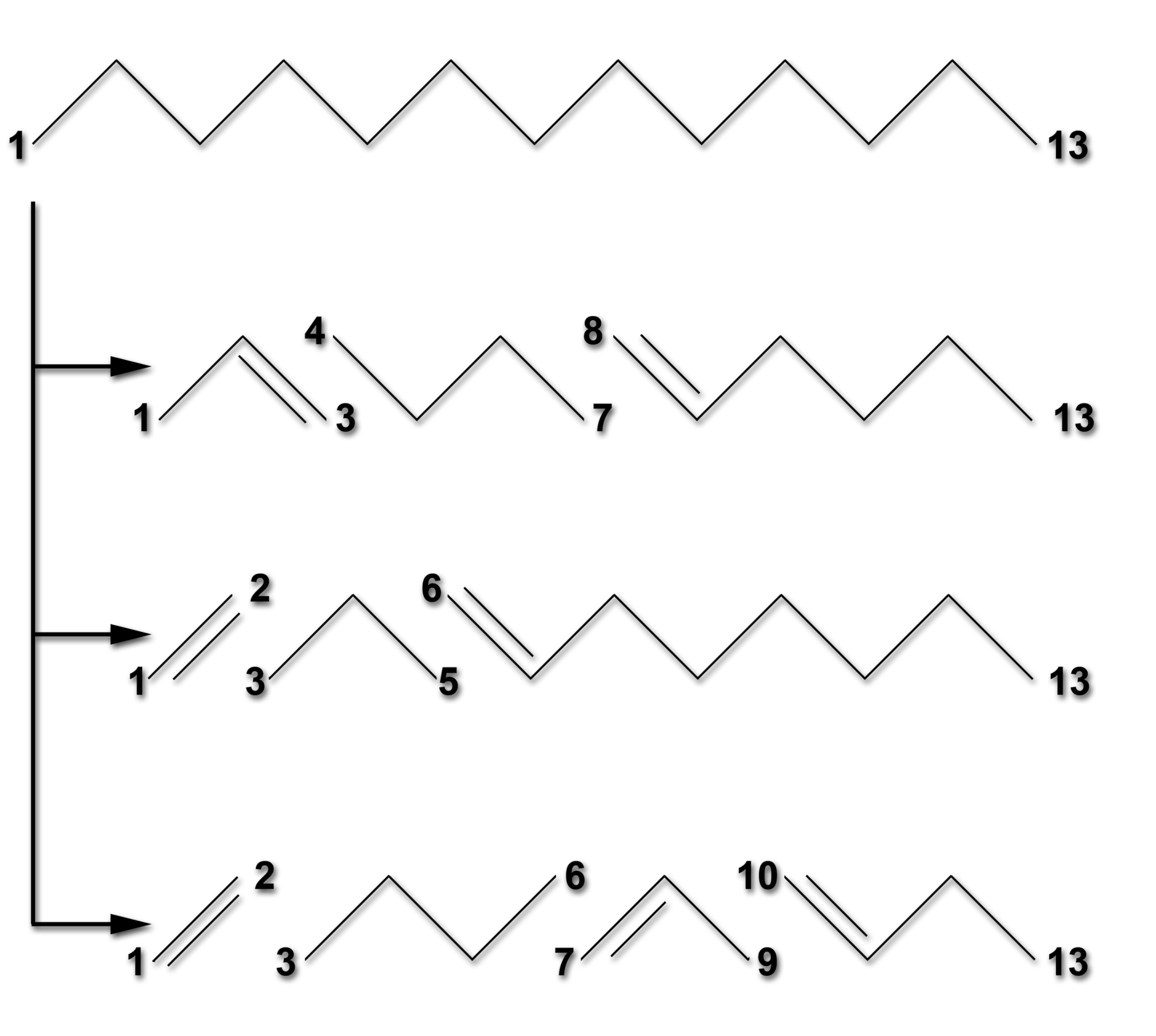
Cracken von Tridecan
Autor: Ulrich Helmich 2025, Lizenz: Public domain
Dieses Bild zeigt wie ein langes Alkan mit 13 C-Atomen (Tridecan) durch Einwirkung von Hitze (800 bis 900 ºC ) in kleinere Alkane und Alkene gespalten werden kann. Im ersten Beispiel entstehen aus dem Tridecan die Verbindungen Propen, Butan und Hex-1-en.
Der Druck muss beim Steamcracking nicht hoch sein, sondern im Gegenteil eher gering. Wenn aus einem Molekül mehrere Moleküle gebildet werden, führt eine Verringerung des Drucks zu einer Gleichgewichts-Verschiebung auf die Produktseite.
5. Reaktionen
5.1 Oxidation
Wie alle Alkane und Alkene ist auch das zweiteinfachste Alken, das Propen, sehr leicht brennbar. In der Industrie wird es für das Brennschneiden verwendet. Brennschneiden ist ein Prozess, bei dem mit einer heißen Flamme ein Metallblech zerschnitten wird - quasi das Gegenteil von Schweißen.
5.2 Elektrophile Addition
Für den Chemieunterricht viel wichtiger als die Oxidation ist die Addition elektrophiler Stoffe an die C=C-Doppelbindung. Auf dieses Thema wird auf den Seiten zur elektrophilen Addition ausführlich eingegangen. Neben der elektrophilen Addition spielt aber auch die radikalische Addition an die C=C-Doppelbindung eine gewisse Rolle, bei der Herstellung von Kunststoffen sogar eine wichtige Rolle (siehe Polymerisation).
Propen ist für die Behandlung der elektrophilen Addition besonders interessant, weil bei der Aufnahme eines Protons zwei verschiedene Carbenium-Ionen entstehen können, ein stabileres sekundäres Carbenium-Ion und ein weniger stabiles primäres Carbenium-Ion. Bei der Hydrobromierung (Addition von HBr) entsteht daher hauptsächlich das 2-Brom-propan und so gut wie kein 1-Brom-propan. Nach der Regel von Markownikow bildet sich immer das stabilere Carbenium-Ion, also wenn möglich ein sekundäres oder sogar ein tertiäres.
Bei der Bromierung lagert sich das Proton an das C1-Atom des Propens an, so dass ein sekundäres Carbenium-Ion mit der positiven Ladung am C2-Atom entsteht.
Wichtige Additionsprodukte des Propens sind Propan (Addition von H2) und Propan-2-ol (Addition von H2O).
5.3 Radikalische Addition
Die radikalische Addition , die nach einem Anti-Markownikow-Mechanismus abläuft, ermöglicht weitere Produkte wie Propan-1-ol, vor allem aber den wichtigen Kunststoff Polypropylen (Polypropen).
Polypropen
Über 60% des heute hergestellten Propens werden für die Polypropen-Synthese eingesetzt.
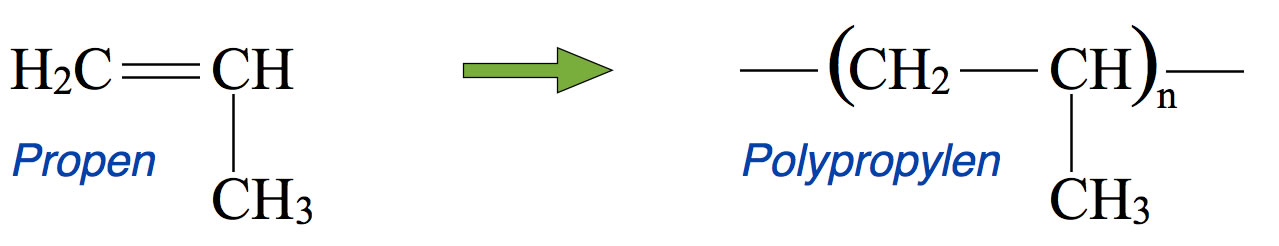
Aus Propen wird Polypropylen
Autor: Ulrich Helmich 2016, Lizenz: Public domain
Es gibt mehrere Verfahren zur Polypropen-Synthese. Früher wurde das Propen-Gas unter hohem Druck auf bis zu 90 Grad Celsius erhitzt. Das radikalische Verfahren führte allerdings zu teilweise verzweigten Polymeren, weil auch aus den Methylgruppen an den Ethen-Einheiten H-Atome abstrahiert werden können.
5.4 Weitere Produkte
In der Wikipedia findet man noch viele weitere Verbindungen, die direkt oder über Zwischenprodukt aus Propan synthetisiert werden können, unter anderem Aceton, Acrolein, Acrylnitril, Acrylsäure, Butanal, Butan-1-ol, Polypropylen, Propylenoxid, Propan-1,2-diol und Propan-1,3-diol.
6. Vorkommen und Bedeutung
In der Natur kommt Propen nur in sehr geringen Mengen vor (im Gegensatz zu Ethen, das als Pflanzenhormon bekannt ist). Kleine Mengen von Propen können bei manchen Abbaureaktionen entstehen, die von Mikroorganismen durchgeführt werden. Auch bei der unvollständigen Verbrennung von Biomasse (zum Beispiel bei Waldbränden) können geringe Mengen von Propen freigesetzt werden, und vulkanische Gase können ebenfalls geringe Mengen dieses Alkens enthalten.
In der Industrie spielt Propen dagegen eine recht wichtige Rolle als Grundchemikalie, wie bereits bei Punkt 5 erwähnt wurde.