 |
 |
 |
|
| Brandfördernd | Giftig! | Ernste Gesundheitsgefahr |
1. Einführung
Methanol oder Methylalkohol CH3OH, ist der einfachste Alkohol, das erste Glied in der
2. Strukturdaten
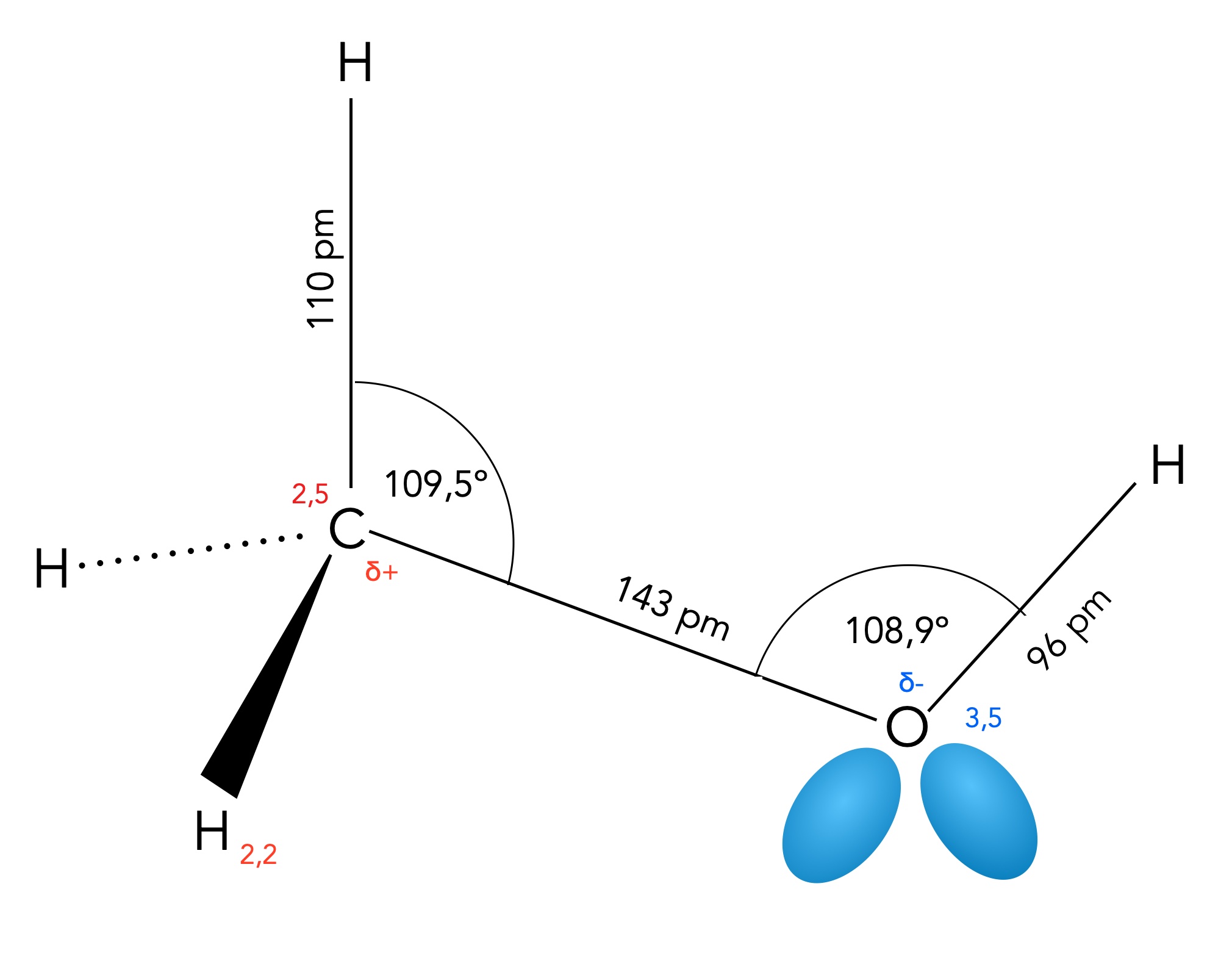
Strukturdaten des Methanol-Moleküls
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Im Prinzip ist das Methanol-Molekül genau so aufgebaut wie das Methan-Molekül, eines der vier H-Atome ist allerdings durch eine OH-Gruppe ersetzt worden. Die B
Die Bindungswinkel H-C-H betragen also jeweils 109,5º, und die C-H-Bindungslängen liegen bei 110 pm, das ist fast der gleiche Wert wie im Methan-Molekül.
Die C-O-Bindung ist deutlich länger als die drei C-H-Bindungen, was an der Art der Orbitale liegt, die hier miteinander verbunden sind. Bei den C-H-Bindungen haben wir eine sp3-s-Überlappung, und da die 1s-Orbitale des H-Atoms recht klein sind, ist auch die kovalente C-H-Bindung relativ kurz.
Bei der C-O-Bindung haben wir es dagegen mit einer sp3-sp3-Überlappung zu tun, und da sp3-Orbitale größer sind als s-Orbitale, ist die C-O-Bindung entsprechend länger als die C-H-Bindung.
Die O-H-Bindung ist wegen der hohen Elektronegativität des O-Atoms recht kurz, nämlich nur 96 pm. Durch die hohe EN sind die sp3-Orbitale des O-Atome kleiner als beispielsweise beim C-Atom, die Elektronen der O-H-Bindung halten sich mit höherer Wahrscheinlichkeit am O-Atom auf.
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedepunkt
Der Schmelzpunkt von Methanol beträgt -98 ºC, der Siedepunkt liegt bei 65 ºC .
Die Methanol-Moleküle werden nicht durch durch die schwachen London-Kräfte zusammengehalten wie zum Beispiel die Moleküle des Methans, sondern auch noch durch Keesom-Kräfte (auch als Dipol-Dipol-Kräfte bezeichnet) und vor allem durch Wasserstoffbrücken-Bindungen. Dies erklärt die im Vergleich zu Methan und Ethan hohen Schmelz- und Siedetemperaturen.
3.2 Löslichkeitsverhalten
Die extrem große Wasserlöslichkeit des Methanols - Methanol ist in jedem Verhältnis mit Wasser mischbar - wird dadurch erklärt, dass das Methanol-Molekül H-Brücken mit Wasser-Molekülen bilden kann. Aber auch mit anderen Alkoholen (Ethanol, Propanol) ist Methanol gut mischbar, ebenso mit Diethylether. Das O-Atom des Ethers kann als H-Brücken-Akzeptor wirken. Aber auch mit unpolaren Verbindungen wie Benzol lässt sich Methanol gut mischen.
Volumenkontraktion
Eine interessante Eigenschaft des Methanols (und des Ethanols) ist die Volumenkontraktion beim Mischen mit Wasser. Im Chemieunterricht wird der entsprechende Versuch meistens durchgeführt, wenn man in der 7. Klasse "beweisen" will, dass die "kleinsten Teilchen" von Wasser und Alkohol unterschiedlich groß sind und sich dann ähnlich verhalten wie Erbsen und Senfkörner, die man in einem Glas mischt.
Die Ursache für diese Volumenkontraktion ist allerdings nicht die, dass H2O-Moleküle kleiner sind als CH3OH-Moleküle und sich dann in die Lücken setzen, die zwischen den Alkohol-Molekülen bestehen. So wird es aber meistens in der Schule erklärt. Die eigentliche Ursache besteht darin, dass sich neue H-Brücken zwischen den H2O- und den Alkohol-Molekülen ausbilden und dadurch die Moleküle näher zusammenrücken.
3.3 Weitere Eigenschaften
Methanol ist eine farblose brennbare Flüssigkeit, die stark nach Alkohol riecht und einen brennenden Geschmack hat. Methanol ist darüber hinaus ein starkes Gift, geringe Dosen können zur Blindheit führen, stärkere Dosen sind tödlich.
Der Flammpunkt von Methanol liegt bei 11 ºC und der Zündpunkt bei 454 ºC. Die Dichte hat einen Wert von 0,79 g/cm3.
4. Gewinnung und Synthese
4.1 Industrielle Synthese von Methan
4.1.1 Aus Synthesegas
Methanol kann technisch durch die direkte Umsetzung von Kohlenstoff und Wasserstoff erzeugt werden. Dieses sogenannte Synthesegas wird je nach Zusammensetzung als Wassergas (CO + H2), Synthesegas (CO + 2 H2) oder Spaltgas (CO + 3 H2) bezeichnet [6].
Die beiden Edukte Kohlenmonoxid und Wasserstoff werden wiederum aus Erdgas gewonnen, zum Beispiel nach der folgenden Reaktion:
$CH_4 + H_2O \rightleftharpoons CO_2 + H_2; \ \ \Delta H = 206 kJ/mol$
Zwar ist diese Reaktion stark endotherm, das macht aber nichts, weil die anschließenden Umsetzungen stark exotherm sind:
$CO + H_2O \rightleftharpoons CO_2 + H_2; \ \ \Delta H = -41,2 kJ/mol$
$2 \ CO \rightleftharpoons CO_2 + C; \ \ \Delta H = -172,6 kJ/mol$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Es gibt noch weitere Verfahren und Reaktionen zur Gewinnung der Edukte für die Methanol-Synthese, diese sind auf der Wikipedia-Seite zur Methanolherstellung näher erläutert. Für die Bildung von Methanol aus Kohlenstoffmonoxid, Kohlenstoffdioxid und Wasserstoff können die folgenden Gleichungen formuliert werden:
$CO + 2 \ H_2 \rightleftharpoons CH_3OH; \ \ \Delta H = -90,8 kJ/mol$
$CO + 3 \ H_2 \rightleftharpoons CH_3OH + H_2O; \ \ \Delta H = -49,6,8 kJ/mol$
Dieses Verfahren ist weltweit führend, Anfang des 20. Jahrhunderts wurde der Großteil des Methanols noch durch die Destillation von Holz gewonnen, aber seit 1930 betrug der Anteil des synthetisch gewonnenen Methanols schon 50%, und heute wird Methanol fast ausschließlich nach diesem Verfahren gewonnen. Entwickelt wurde das Verfahren von Chemikern der BASF um 1913. Die Methanolproduktion betrug 2012 weltweit 60 Millionen Tonnen.
Zum genauen Ablauf der einzelnen Verfahren siehe den entsprechenden und sehr ausführlichen Wikipedia-Artikel.
4.1.2 Direkt aus Methan
Im Bild der Wissenschaft vom September 2017 können wir nachlesen, dass Forscher ein Verfahren entwickeln, mit dem man Methanol direkt aus Methan herstellen kann. Allerdings ist dieses Verfahren noch in Entwicklung.
Bei diesem Verfahren reagiert Methan mit Sauerstoff und Wasserstoffperoxid, als Katalysator werden dabei Nanopartikel aus einer Gold-Palladium-Verbindung eingesetzt.
"Bei ihren Versuchen konnten die Wissenschaftler demonstrieren, dass das Methan in einer flüssigen Lösung unter Anwesenheit dieser drei Stoffe zu einem großen Anteil in Methanol überführt wird. Demnach oxidierten rund 92 Prozent des Ausgangsprodukts zu der gewünschten Verbindung und es entstand kaum Kohlenstoffdioxid. Doch der eigentliche Clou: Die Reaktion läuft bei äußerst niedrigen Temperaturen von 50 Grad Celsius ab und funktioniert sogar noch bei Raumtemperatur, wenn dann auch deutlich weniger effizient" [7].
4.3 Laborsynthesen
Wegen der allgemeinen Verfügbarkeit besteht in der Regel keine Notwendigkeit, Methanol aufwändig im Labor herzustellen. Aber in Chemievorlesungen beschäftigt man sich schon mit diesem Problem - aus didaktischen Gründen. Die zwei am meisten vorgeschlagenen Verfahren sind dann:
- Reduktion von Methanal oder Methansäure
- Reaktion von Chlormethan oder Brommethan mit NaOH oder KOH (SN2-Reaktion)
Wenn man in die Fachliteratur schaut, beispielsweise in den alten Morrison/Boyd, dann werden folgende Verfahren zur Synthese von Alkoholen vorgestellt:
Hydroxymercurierung-Reduktion
Alkene reagieren bei dieser Reaktion mit Quecksilber(II)-acetat in Anwesenheit von Wasser zu Zwischenprodukten, die dann zum Alkohol hydrolysiert werden können. Methanol kann auf diese Weise allerdings nicht hergestellt werden, da das "kleinste" Alken Ethan mit zwei C-Atomen ist.
Hydroborierung-Oxidation
Hier wird ein Alken mit Diboran (BH3)2 umgesetzt, das Zwischenprodukt wird wieder zum Alkohol hydrolysiert. Auch diese Reaktion kann nicht für die Methanol-Synthese benutzt werden.
Grignard-Reaktion
Aus Formaldeyhd und einem Halogenalkan R-X kann über die Grignard-Verbindung R-Mg-X und anschließende Hydrolyse der Alkohol R-CH2-OH hergestellt werden. Da der Rest R aber eine Alkyl-Gruppe sein muss, kann man Methanol nicht auf diese Weise herstellen, der einfachste Alkohol, der sich so gewinnen lässt, ist wieder Ethanol.
Hydrolyse von Alkylhalogeniden
Dies ist die klassische Nucleophile Substitution eines Halogen-Atoms durch eine OH-Gruppe, die auch meisten von Schülern und Studenten als erste Möglichkeit vorgeschlagen wird. Aus Chlor- oder Brommethan und KOH oder NaOH könnte man so tatsächlich Methanol synthetisieren.
Reduktion von Carbonylverbindungen
Auch dies ist tatsächlich eine Möglichkeit zur Gewinnung von Methanol, beispielsweise aus Ameisensäure oder Formaldehyd. Auch aus Carbonsäure-Methanol-Estern könnte man Methanol freisetzen.
5. Reaktionen
Methanol ist ein wertvoller Ausgangsstoff für viele industrielle Synthesen, wie das folgende Tortendiagramm aus der Wikipedia zeigt:
Verwendung von Methanol in der Industrie 2009
Linksfuss at de.wikipedia, Public domain, via Wikimedia Commons
Die industriell wichtigste Reaktion von Methanol ist wohl die Oxidation zu Methanal bzw. Formaldehyd. Diese Reaktion machte 2009 ca. 61% aller industriellen Methanol-Reaktionen aus. Auf Platz zwei kommt die Synthese von Essigsäure (18%), auf Platz drei die Herstellung von Chlormethan bzw. Methylchlorid (7%). Weitere Produkte, die aus Methanol hergestellt werden können, sind Methylmethacrylat (5%), Methylamine (5%), Methylmercaptan bzw. Methanthiol (2%) und Dimethylterephthalat (2%).
5.1 Oxidation
Die industriell wichtigste Reaktion von Methanol ist die Oxidation zu Methanal bzw. Formaldehyd.
$CH_{3}OH + \frac{1}{2} \ O_{2} \to H_2CO + H_{2}O$
Bei dieser Reaktion wird ein Silber-Katalysator eingesetzt.
Eine weitere wichtige Oxidation ist die Reaktion von Methanol zu Essigsäure:
$CH_{3}OH + CO \to CH_3COOH$
Diese Reaktion läuft in mehreren Schritten ab, genauer gesagt, in sechs komplizierten Schritten, die auf der Wikipedia-Seite zum Monsanto-Prozess (so heißt dieses Verfahren) genauer erläutert sind. Interessant ist vielleicht noch, dass dieses wichtige technische Verfahren schon 1913 bei der BASF entwickelt wurde. 1925 wurde Methanol dann zum ersten Mal nach diesem Verfahren großtechnisch hergestellt, nachdem 1924 Methanol nach dem Mittasch-Verfahren synthetisiert werden konnte.6. Vorkommen und Bedeutung
Vorkommen
Nach Methan ist Methanol das zweithäufigste organische Gas in der Erdatmosphäre. Die Verbindung wird hauptsächlich von Pflanzen produziert, vor allem von Pflanzen in Feuchtgebieten und auf Gras- und Weideflächen. Man schätzt, dass jährlich über 100 Millionen Tonnen Methanol auf diese Weise freigesetzt werden.
Chemisch gebundenes Methanol, zum Beispiel in Form von Methylestern und Methylethern, kommt in vielen Pflanzen und Früchten vor, es ist eine Komponente von Lignin (Holzstoff) und auch ein Bestandteil der pflanzlichen Zellwand (chemisch gebunden in Form von Estern und Ethern).
Bedeutung
Neben seiner Bedeutung als Rohstoff für die industrielle Chemie (siehe oben) ist Methanol auch ein wichtiger Brennstoff und Kraftstoff.
Kraftstoff
Methanol kann direkt als Kraftstoff eingesetzt werden oder, beispielsweise für PKWs als Kraftstoffzusatz zum Benzin oder Diesel. Mehr als 3% Methanol im Benzin oder Diesel verkraften die PKW-Motoren allerdings nicht, daher ist dies die zugelassene Höchstgrenze.
Spezielle Benzin- oder Dieselmotoren vertragen auch höhere Methanolzusätze. Mercedes-Benz hat beispielsweise 1980 einige 280 SE-Fahrzeuge so umgerüstet, dass sie sogar mit 100% Methanol betrieben werden konnten. Da Methanol aber einen geringeren Heizwert hat als Benzin, mussten die Kraftstofftanks von 90 auf 136 Liter vergrößert werden, um die selbe Reichweite zu erzielen.
Methanol als Kraftstoff hat Vor- und Nachteile. Ein Vorteil ist, dass bei der Verbrennung von reinem Methanol keine Aromaten wie Benzol, Toluol etc. freigesetzt werden, außerdem hat Methanol geringes Ozonbildungspotential. Werden Dieselmotoren mit Methanol betrieben, werden keine Schwefelverbindungen mehr freigesetzt, und es wird auch viel weniger Ruß gebildet. Ein weiterer Vorteil: Wenn bei Unfällen Methanol austritt, ist das lange nicht so umweltschädlich wie wenn Benzin oder Diesel freigesetzt wird. Methanol ist nämlich biologisch abbaubar.
Ein Nachteil von Methanol als Kraftstoff ist, das mehr Formaldehyd freigesetzt wird, mit entsprechenden Katalysatoren kann dieses Problem aber stark begrenzt werden.
Biodiesel als Kraftstoff
Methanol kann auch zur Herstellung von Biodiesel eingesetzt werden. Bei der Produktion von Biodiesel geht man von flüssigen Neutralfetten (Ölen) aus. Ein solches Neutralfett besteht aus einem Glycerin-Molekül, das mit drei langen Fettsäuren verestert ist. Gibt man nun unter geeigneten Bedingungen einen Überschuss an Methanol zu solchen Pflanzenölen, so findet eine Umesterung statt. Die Fettsäuren lösen sich vom Glycerin und verbinden sich stattdessen mit dem Methanol. Es bilden sich also Methanolester. Diese werden dann von dem Rohstoff abgetrennt und können als Biodiesel eingesetzt werden.
Brennstoff
Methanol kann natürlich direkt verbrannt werden, der Heizwert ist ungefähr halb so groß wie der von Benzin oder Diesel. Wenn man Methanol heute aber als Brennstoff einsetzt, dann hauptsächlich in sogenannten Brennstoffzellen.

Eine Methanol-Brennstoffzelle
Autor: NASA, Lizenz: Public domain
An der Anode der Brennstoffzelle läuft diese Reaktion ab:
$2 \ CH_3 OH + 2 \ H_2O \to 2 \ CO_2 + 12 \ H^{+} + 12 \ e^{-}$
An der Kathode sieht die Umsetzung so aus:
$3 \ O_2 + 12 \ H^{+} + 12 \ e^{-} \to 6\ H_2O$
Fasst man die beiden Reaktionen zusammen, so erhält man die folgende Gesamtgleichung:
$2 \ CH_3 OH + 3 \ O_2 \to 2 \ CO_2 + 4\ H_2O$
Im Grunde wird Methanol also mit Hilfe von Sauerstoff zu Kohlendioxid und Wasser verbrannt. Genau so also, als würde man eine Schale mit Methanol entzünden. Nur das die bei der Oxidation vom Methanol freigesetzten Elektronen elektrische Arbeit leisten müssen, bevor sie sich mit den Sauerstoff-Molekülen vereinigen können.
Weitere Anwendungen in Alltag und Technik
aus dem Wikipedia-Artikel "Methanol"
Methanol findet weitere Anwendung in vielen Bereichen. So findet es als Lösungs- und Frostschutzmittel Einsatz. In Wärmerohren im mittleren Temperaturbereich bis 500 K dient Methanol als Übertrager-Fluid. Ebenso findet es Anwendung bei der Sensorreinigung von digitalen Spiegelreflexkameras, da es keine Schlieren hinterlässt und rückstandslos verdunstet.
Mono- und perdeuteriertes Methanol werden als Lösungsmittel in der Kernspinresonanzspektroskopie verwendet.
In Kläranlagen wird Methanol zur Unterstützung der Denitrifikation, der Umwandlung von Nitrat in gasförmigen Stickstoff, zum Abwasser gegeben. Die bakteriellen Stoffwechselvorgänge benötigen Methanol als zusätzlichen Energielieferanten.
In der Abfallaufbereitung wird Methanol zum solvolytischen Recycling von Polyethylenterephthalat genutzt. Dabei werden Ethylenglycol und Dimethylterephthalat zurückgewonnen.
Methanol wird zur Abscheidung von Polystyrol und Chloroprenkautschuk aus Polymermischungen, etwa zur Verkapselung anderer Polymere wie zum Beispiel Butadien-Kautschuk, verwendet.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Schirmeister, Schmuck, Wich: Beyer/Walter Organische Chemie, 25. Auflage 2015.
- Spektrum-Lexikon der Chemie, Artikel "Methanol"
- Wikipedia, Artikel "Methanol"
- Wikipedia, Artikel "Volumenkontraktion"
- Wikipedia, Artikel "Methanolherstellung"
- "Methan direkt zu Methanol", Bild der Wissenschaft, 8. September 2017