Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- dass die SN1-Reaktion in zwei Schritten verläuft,
- dass sich im ersten Schritt ein Carbenium-Ion bildet,
- dass sich im zweiten Schritt ein Nucleophil an das Carbenium-Ion anlagert,
- dass es bei einer SN1-Reaktion nicht zu einer Inversion kommt, sondern dass ein Racemat entsteht,
- wieso die Reaktionsgeschwindigkeit nur von der Konzentration des organischen Substrats abhängt und nicht von der Konzentration des Nucleophils.
Die beiden Reaktionsschritte
Schritt 1
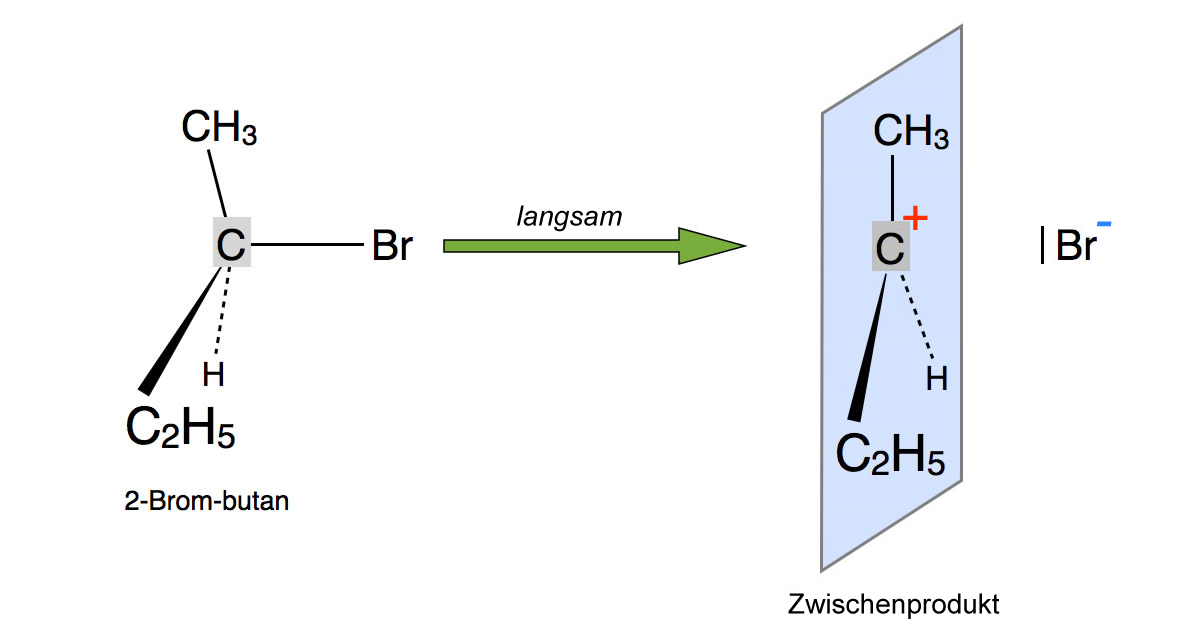
Der erste Schritt der SN1-Reaktion von 2-Brom-butan mit Iodid
Ein 2-Brombutan-Molekül zerfällt spontan in ein sekundäres Carbenium-Ion und ein Bromid-Anion. Da dieser Reaktionsschritt mit der Spaltung der kovalenten C-Br-Bindung verbunden ist, ist seine Aktivierungsenergie recht hoch, und entsprechend langsam verläuft dieser Schritt 1.
Ähnlich wie der Übergangszustand bei der SN2-Reaktion ist das Zwischenprodukt planar, was durch die blau eingezeichnete Ebene verdeutlicht werden soll.
Schritt 2
Das Zwischenprodukt ist ein planares Carbenium-Ion, ein Nucleophil kann das Carbenium-Ion also von zwei Seiten mit gleicher Wahrscheinlichkeit angreifen:
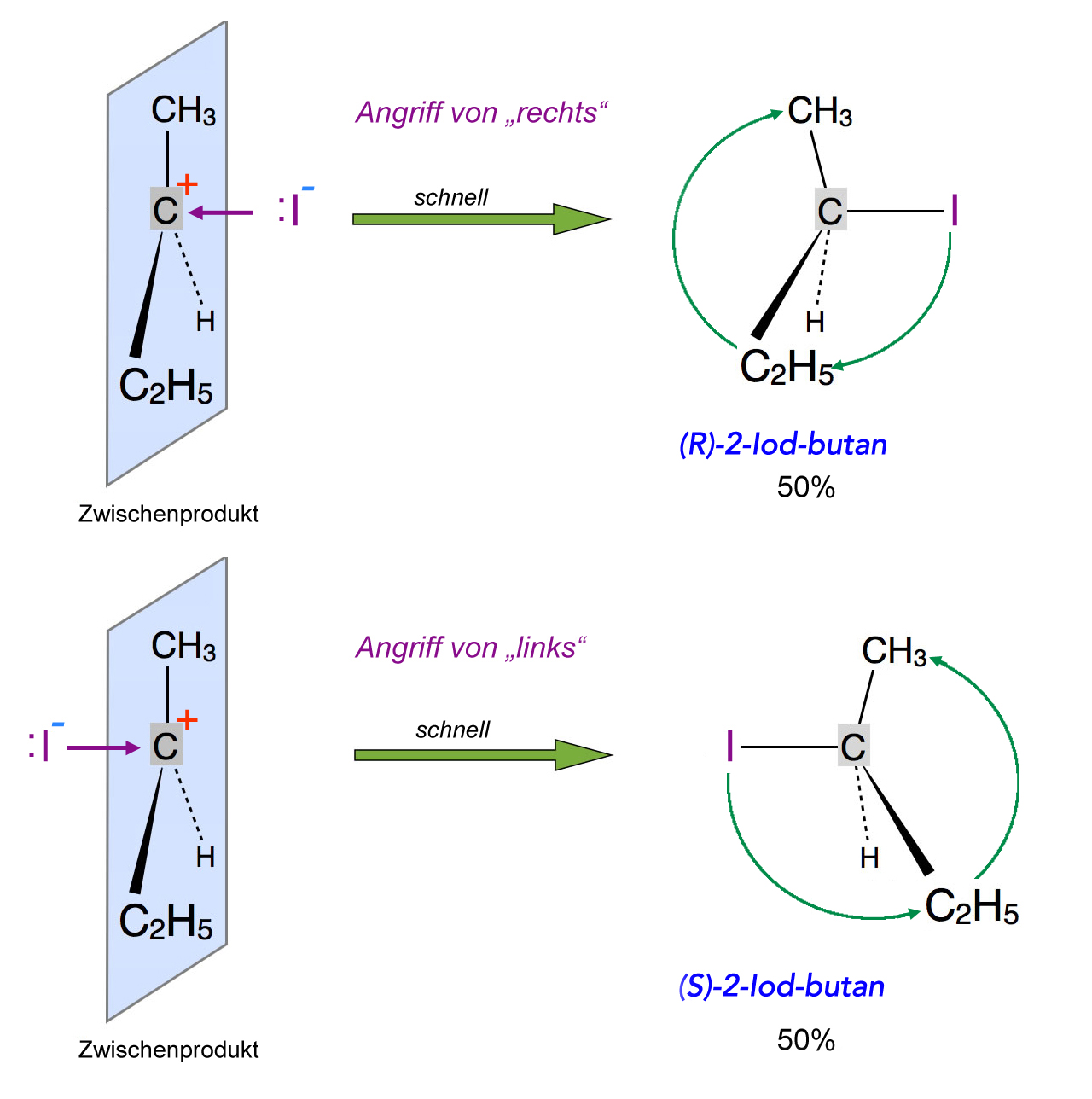
Angriff eines Nucleophils auf das Carbenium-Ion liefert ein 50:50 Racemat
Greift das Nucleophil - hier ein Iodid-Ion - zufällig von "rechts" an, so entsteht als Endprodukt das 2-Iodbutan in der sogenannten R-Konfiguration. Greift das Nucleophil dagegen von "links" an, bildet sich das 2-Iodbutan in der S-Konfiguration - das ist das Spiegelbild der R-Konfiguration. Da die Wahrscheinlichkeit eines Angriffs von links und rechts gleich groß ist, erhält man gleich viel von jeder Konfiguration, eine solche Mischung nennt man Racemat.
Dieser Schritt 2 besteht in der Bildung einer neuen kovalenten Bindung. Eine solche Bindungsbildung hat normalerweise eine recht niedrige Aktivierungsenergie und verläuft daher recht schnell. Außerdem ist die Bildung einer neuen Bindung exotherm, was der Reaktion durch die frei werdende Reaktionswärme einen "weiteren Schub" gibt.
Gesamtreaktion
Die SN1-Reaktion besteht aus zwei Reaktionsschritten. Bei einer mehrschrittigen Reaktion hängt die Geschwindigkeit der Gesamtreaktion immer von dem langsamsten Schritt ab. Dieser Schritt wird auch als der geschwindigkeitsbestimmende Schritt bezeichnet.
Bei der SN1-Reaktion ist der erste Schritt, die Bildung des Carbenium-Ions, der geschwindigkeitsbestimmende Schritt. Da dieser Schritt eine Reaktion 1. Ordnung ist, ist auch die Gesamtreaktion 1. Ordnung.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
Seitenanfang -
Weiter mit der Konkurrenz zwischen SN1 und SN2...