Unter Nucleophilie versteht man ein Maß für die Neigung einer Lewis-Base (elektronegatives Teilchen mit mindestens einem freien Elektronenpaar), mit Carbenium-Ionen oder positiv polarisierten C-Atomen anderer Moleküle eine kovalente Bindung zu bilden. Lewis-Basen mit dieser Eigenschaft werden auch als Nucleophile bezeichnet.
Messung der Nucleophilie
Den Grad der Nucleophilie kann man nicht direkt messen, Nucleophilie ist keine Größe wie Elektronegativität, Leitfähigkeit, Siedepunkt oder pH-Wert. Man kann nur die relative Nucleophilie im Vergleich zu einem Referenz-Nucleophil messen.
In der chemischen Praxis führt man dazu vergleichende Experimente durch, sogenannte Konkurrenzreaktionen. Man versetzt ein Substrat wie Chlorethan mit zwei verschiedenen Nucleophilen (zum Beispiel OH- und H2O) und verfolgt die Geschwindigkeit der beiden Reaktionen. Das stärkere Nucleophil reagiert dann schneller als das schwächere Nucleophil. So hat man beispielsweise herausgefunden, dass Hydroxid-Ionen sehr viel stärkere Nucleophile sind als Wasser-Moleküle:
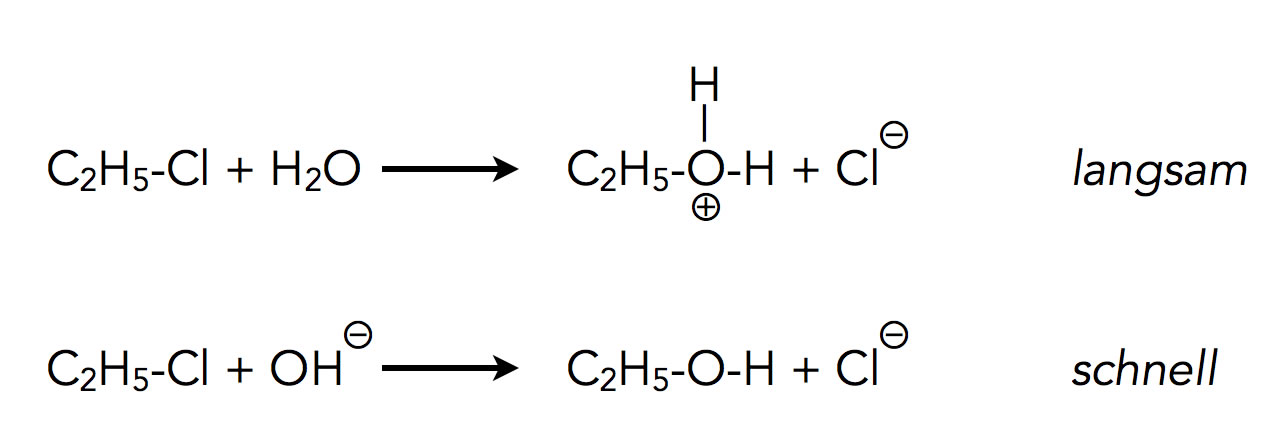
Vergleich zweier Nucleophile
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Lässt man Chlorethan mit Wasser als Nucleophil reagieren, bildet sich sehr langsam Ethanol (protoniert). Führt man die Reaktion dagegen mit der konjugierten Base OH- durch, erfolgt die Bildung von Ethanol recht schnell.
Auch bei der Umsetzung von Chlorethan mit Ammoniak NH3 und der konjugierten Base NH2- reagiert die konjugierte Base viel schneller mit dem Substrat als das neutrale Nucleophil, die konjugierte Säure.
In beiden Fällen, sowohl bei OH- wie auch bei NH2-, ist die negative Ladung des Nucleophils der Grund für die höhere Nucleophilie. Schließlich zieht ein positiv polarisiertes oder sogar vollständig positives C-Atom ein Anion besser bzw. schnelle an als ein neutrales Molekül wie H2O oder NH3.
Weitere solche Versuche bestätigen die Hypothese, dass anionische Nucleophile stärker sind als vergleichbare neutrale Nucleophile. Anders formuliert: Eine Base ist stärker nucleophil als ihre konjugierte Säure.
Abhängigkeit der Nucleophilie
Die Nucleophilie eines Teilchens hängt von mehreren Faktoren ab, die auf der Vertiefungsseite näher erläutert werden. Hier nur ein Beispiel:
- In wässriger Lösung ist das Iodid-Ion ein sehr starkes Nucleophil, während das Chlorid-Ion ein viel schwächeres Nucleophil ist.
- In dem Lösemittel Aceton sind die Verhältnisse genau umgekehrt. Hier ist das Chlorid-Ion ein stärkeres Nucleophil als das Iodid-Ion.
Für Leute aus dem Chemie-LK oder Studierende in den ersten Semestern habe ich noch eine weitergehende Vertiefungsseite zur Nucleophilie geschrieben.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.