Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie wissen
- dass nucleophile Substitutionen monomolekular oder bimolekular ablaufen können,
- dass man entsprechend zwischen SN1-Reaktionen und SN2-Reaktionen unterscheiden kann.
Beobachtet man bei einer nucleophilen Substitution, dass die Reaktion nach einer Kinetik 2. Ordnung abläuft, handelt es sich um eine SN2-Reaktion. Bei der Reaktion trifft also das Nucleophil :Y auf das Substrat und drückt im selben Reaktionsschritt die Abgangsgruppe X aus dem Substrat heraus.
Dadurch kommt es zu einer sogenannten Inversion der Raumstruktur des Substrats, wie das folgende Bild zeigt:
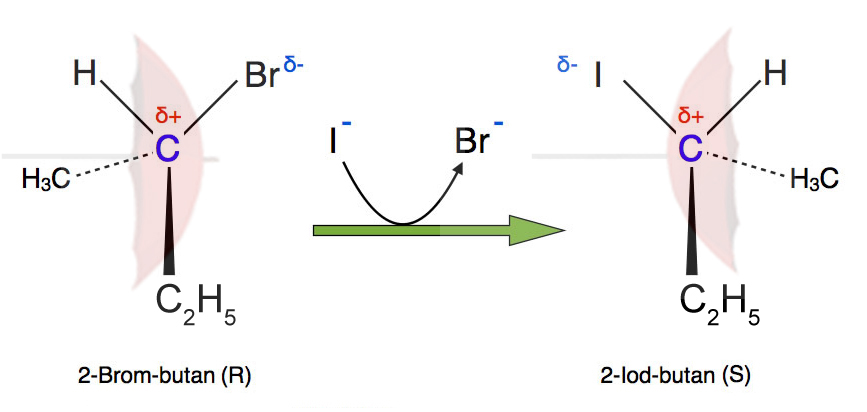
Reaktion von 2-Brom-butan zu 2-Iod-butan
Autor: Ulrich Helmich 2020, nach einer Tafelzeichnung von Prof. G. Dyker; Vorlesung "Organische Chemie" an der Ruhr-Universität Bochum 2012. Lizenz: siehe Seitenende.
Das Brom-Atom im organischen Substrat ist in der Abbildung nach rechts ausgerichtet, das Iod-Atom im Produkt aber nach links. Auch die Methylgruppe und das Wasserstoff-Atom haben ihre Position verändert. Das Produkt sieht fast so aus wie das Spiegelbild des Edukts.
Diese Inversion der Raumstruktur ist typisch für die SN2-Reaktion. Entdeckt hat sie Paul Walden (1863-1957), darum wird sie auch Walden-Inversion oder Walden-Umkehr genannt.
Quellen:
- Vorlesung Organische Chemie 1.17 von Prof. G. Dyker: "Nucleophile Substitution" (YouTube)
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Morrison/Boyd, Organic Chemistry, 7th Edition, 2011
- Carey/Sundberg, Organische Chemie - ein weiterführendes Lehrbuch, Weinheim 1995
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
Seitenanfang -
Weiter mit der SN1-Reaktion...