Unter einer Lewis-Base versteht man ein elektronegatives Teilchen mit einem freien Elektronenpaar, das eine kovalente Bindung mit einer Lewis-Säure eingehen kann, also einem Teilchen mit einem leeren Orbital bzw. einer leeren Kugelwolke.
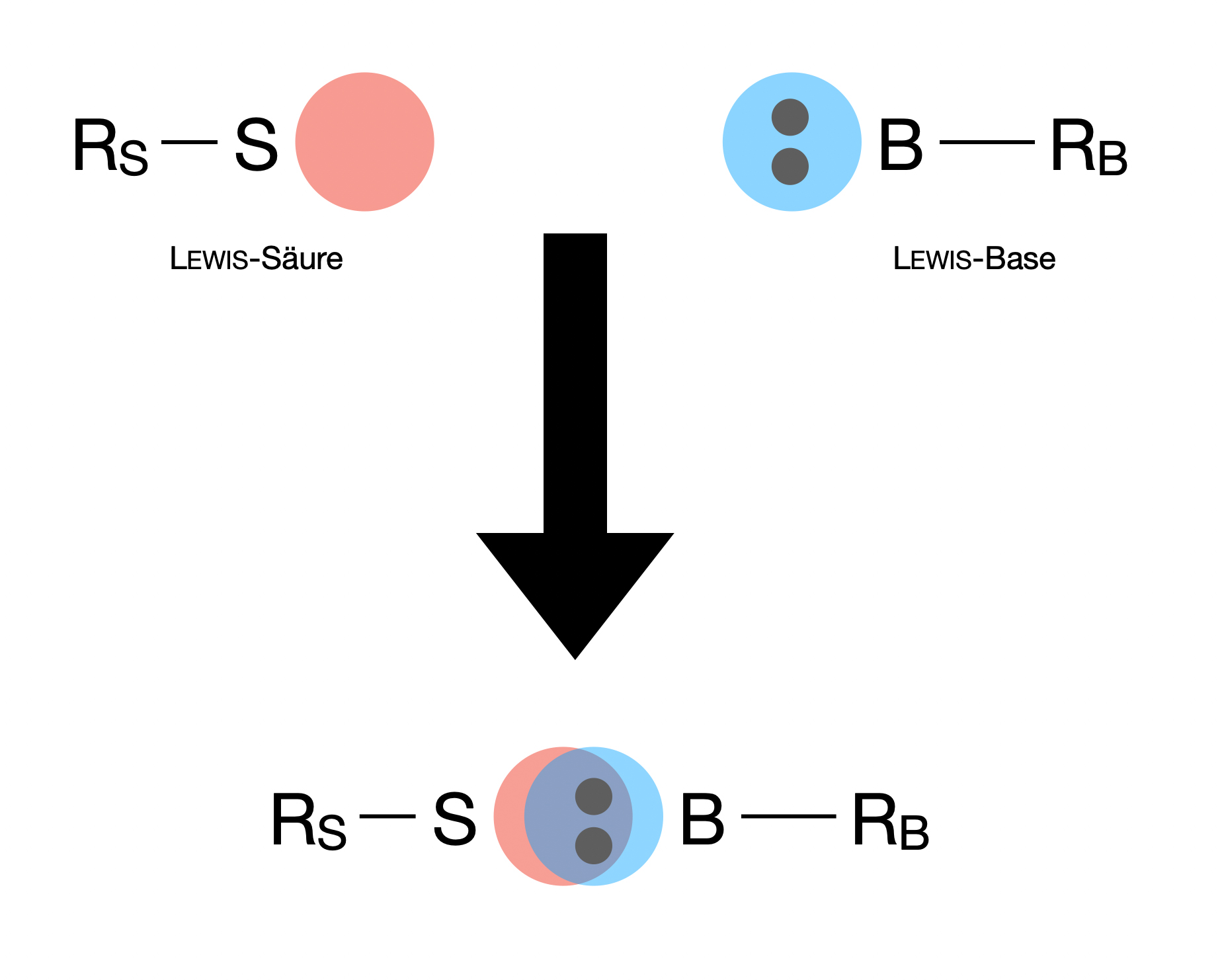
Reaktion einer Lewis-Säure mit einer Lewis-Base, allgemeines Schema.
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Beispiele für Lewis-Basen sind die bekannten Brönsted-Basen wie NH3, H2O, OH-, aber auch Stoffe wie F, O2 oder N2, die nicht als Brönsted-Basen auftreten.
Eine bekannte Lewis-Base ist auch das Brom-Molekül Br2. Bei der Bromierung von Benzol oder anderen Aromaten reagiert Br2 zunächst mit Aluminiumbromid AlBr3. Aluminiumbromid ist eine Lewis-Säure, das Al-Atom besitzt nämlich vier Kugelwolken, und eine davon ist leer, das Al-Atom hat ja nur drei Außenelektronen. Die Lewis-Säure AlBr3 verbindet sich nun mit der Lewis-Base Br2 zu dem Komplex Br-Br-AlBr3. Dieser Komplex dissoziiert dann in das Br+-Ion und das AlBr4--Anion.
Oft wird sogar die C=C-Doppelbindung zu den Lewis-Basen dazu gezählt, weil bei der elektrophilen Addition die pi-Elektronen der C=C-Doppelbindung ja mit dem leeren Orbital eines Protons überlappen.
Lewis-Basen werden in der Regel auch als Elektronenpaar-Donatoren bezeichnet, Lewis-Säuren sind dann entsprechend Elektronenpaar-Akzeptoren.
Lewis-Basen und Nucleophile
Diese beiden Begriffe sind nahezu identisch, aber nicht ganz!
Der Begriff Lewis-Base ist etwas allgemeiner, während sich der Begriff Nucleophil nur auf Lewis-Basen beschränkt, die mit einem positiv polarisierten C-Atom reagieren, das im Idealfall als Carbenium-Ion vorliegt, also ein leeres Orbital besitzt und demnach eine Lewis-Säure ist.
Weitere Lewis-Basen
(Liste direkt aus der Wikipedia übernommen)
- Hart: H2O; OH−; F−; Cl−; NH3; R3N; CH3COO−; CO32−; N2H4; PO43−; O2−; ClO4−; SO42−; NO3−; RO−; RNH2
- Grenzbereich: Br−; NO2−; SO32−; N3−; N2; C5H5N
- Weich: SCN−; R2S; R–SH; CN−; R3P; I−; S2−; H−; H2S; HS−; CO; S2O32−; C2H4; C6H6
➥Nucleophile Substitution
Auf diesen beiden Seiten werden Lewis-Basen, die als Nucleophile auftreten sowie der Reaktionsmechanismus der nucleophilen Substitution näher behandelt.
Wo es Lewis-Basen gibt, gibt es natürlich auch Lewis-Säuren, die auf dieser Seite näher dargestellt werden.
Das Säure-Base-Konzept von Lewis wurde 1963 von Pearson erweitert. Einzelheiten dazu finden Sie auf dieser Seite.