Die Markownikow-Regel (es gibt hier unterschiedliche Schreibweisen) ist eine einfach zu merkende Regel, die angibt, welches Reaktionsprodukt bei einer elektrophilen Addition (und auch bei einer radikalischen Addition) an die C=C-Doppelbindung bevorzugt entsteht.
Ursprünglich lautete die Regel ungefähr so:
Bei der Addition einer Verbindung HX an ein Alken setzt sich das H-Atom stets an das C-Atom der Doppelbindung, an dem sich bereits die meisten H-Atome befinden.
Dieses Phänomen könnte man auch mit dem Spruch "Wer schon hat, dem wird gegeben" beschreiben.
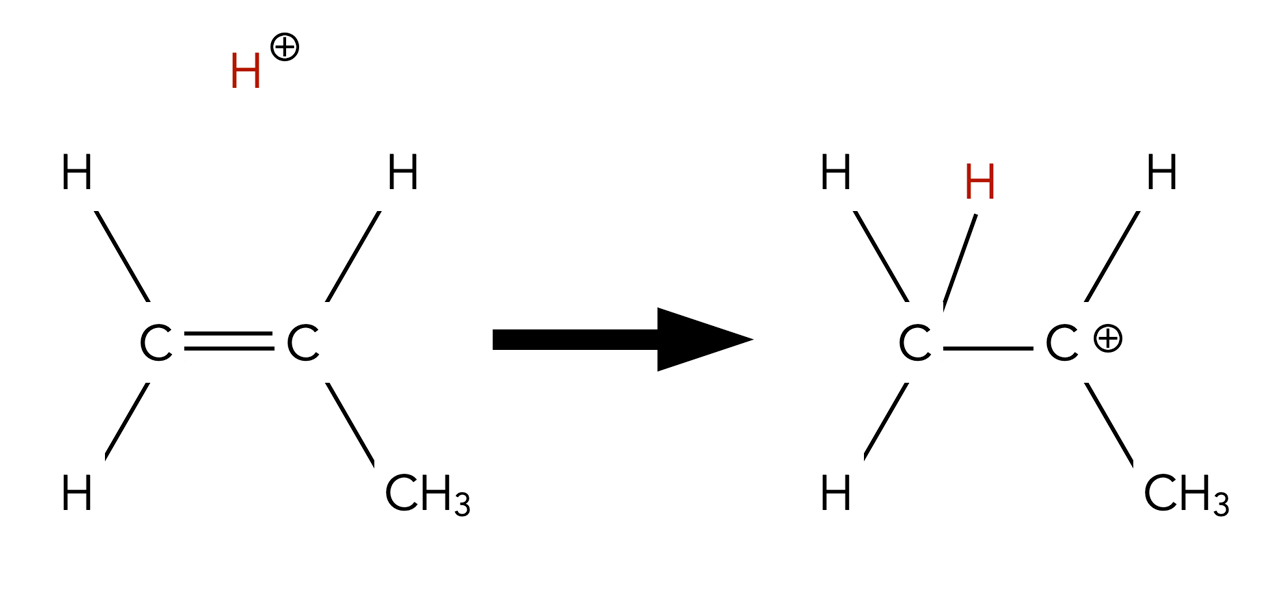
Das Proton setzt sich an das C-Atom mit den meisten H-Atomen
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Das linke C-Atom der Propen-Doppelbindung besitzt zwei H-Atome, das rechte C-Atom der Doppelbindung nur eins. Also setzt sich das Proton an das linke C-Atom.
Die alte Formulierung von MarkownikoW ist zwar korrekt, zeigt aber nicht die Gründe für dieses Verhalten auf. Schauen wir uns dazu folgendes Beispiel an [8]:
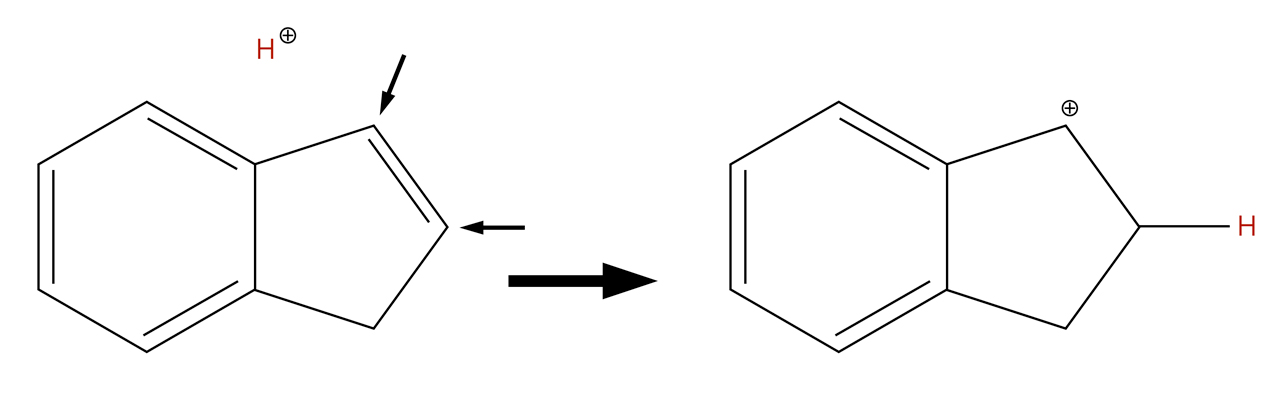
Addition eines Protons an ein Inden-Molekül
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Beide C-Atome der C=C-Doppelbindung besitzen genau ein H-Atom. Also sollte sich das Proton mit gleicher Wahrscheinlichkeit an jedes dieser beiden C-Atome setzen. Es entsteht aber hauptsächlich das im Bild rechts gezeigte Produkt. Dieser Befund widerspricht jedoch der alten Markownikow-Regel. Eigentlich müsste von jedem der beiden Carbenium-Ionen gleich viel entstehen.
MarkownikoW hatte noch keine Ahnung von Radikalen, Carbenium-Ionen, sp2-Hybridisierung und all den anderen Erkenntnissen der modernen Chemie. Heute formuliert man die Markownikow-Regel folgendermaßen:
Bei der Addition einer Verbindung HX an ein Alken setzt sich das H-Atom so an die Doppelbindung, dass das jeweils stabilste Carbenium-Ion als Zwischenprodukt entsteht.
Betrachten wir dazu das folgende Bild:
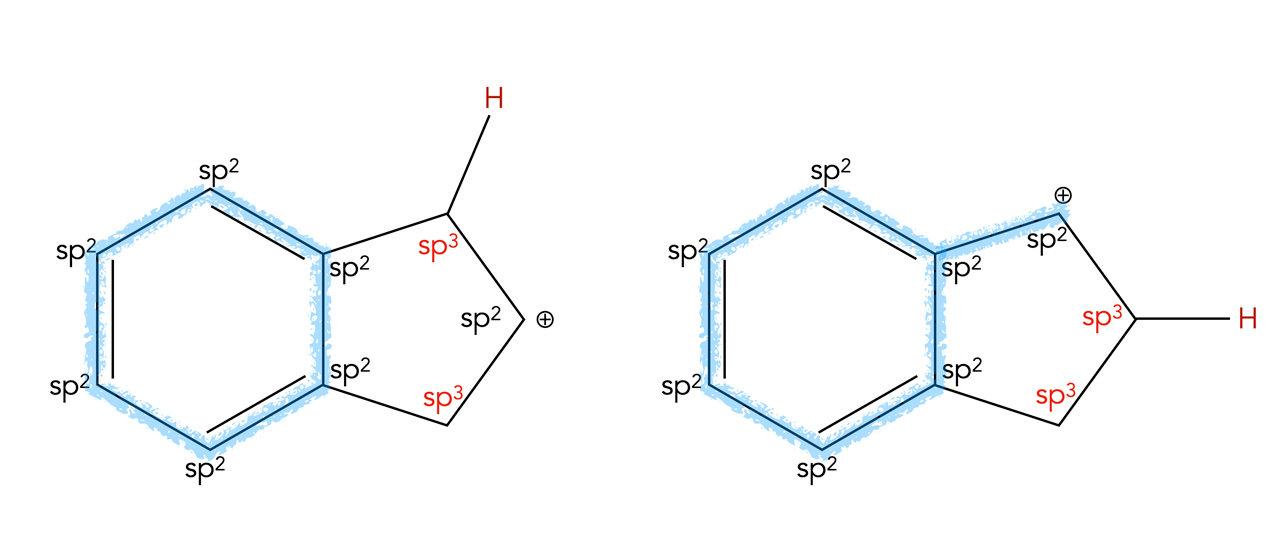
Das System delokalisierter pi-Elektronen in den beiden Varianten des Carbenium-Ions
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die beiden Carbenium-Ionen unterscheiden sich in der Position des dazu gekommenen Protons. Weil nun Carbenium-Ionen ein sp2-hybridisiertes C-Atom besitzen, ist die rechte Struktur energetisch günstiger als die linke. Das pz-Orbital des positiven C-Atoms kann nun mit den sechs pz-Orbitalen des Benzolringes überlappen, und die sechs pi-Elektronen können sich frei in diesem System aus sieben Orbitalen bewegen. Bei der links gezeigten Variante ist das nicht möglich, weil hier ein sp3-hybridisiertes C-Atom "im Wege" ist.
Man könnte die Markownikow-Regel sogar noch verallgemeinern:
Bei der Addition eines Teilchens an eine Doppelbindung wird das stabilste Zwischenprodukt bevorzugt.
Bei der radikalischen Addition einer Verbindung HX an die C=C-Doppelbindung entsteht zum Beispiel die stabilste radikalische Zwischenstufe.
Schreibweise von Markownikow
Die Eindeutschung russischer Namen ist immer ein Problem wegen des kyrillischen Alphabets. Man sieht daher mehrere verschiedene Schreibweisen bei den Namen von russischen Forschern, Komponisten und anderen Leuten. Das bekannte Lexikon der Chemie aus dem Spektrum-Verlag sowie der Römpp schreiben "Markownikoff". Alternative Schreibweisen sind "Markownikow", "Markovnikov", Markownikoff, Markovnikoff oder "Markovnikow".
Laut Google gibt es für Markownikoff 44.200 Ergebnisse, für Markownikow 26.900 Einträge und für Markovnikow 1.030 Ergebnisse. Interessanterweise liefert Markovnikov sogar 657.000 Ergebnisse; in der englischsprachigen Wikipedia ist auch von "Markovnikov's rule" die Rede.
Quellen und weiterführende Bücher und Artikel, die über allgemeines Schulbuchwissen hinausgehen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
- Dyker-Vorlesung "Organische Chemie 1", Folge 31 (auf Tib AV - Portal verfügbar).