Elektrophile Addition
Wie bereits bei der Behandlung des Ethens gesagt wurde, ist die Hauptreaktion aller Alkene die Elektrophile Addition. Der Mechanismus dieses Reaktionstyps wird an anderer Stelle ausführlich erläutert, ich möchte auf dieser Seite mehr auf die Reaktionsprodukte eingehen, die mit Hilfe einer solchen elektrophilen Addition synthetisiert werden können.
Hydrierung
Die Addition von Wasserstoff an ein Alken führt allgemein zu dem entsprechenden Alkan; aus Buten wird zum Beispiel Butan.
Die Hydrierung wird oft zu analytischen Zwecken eingesetzt; sie verläuft quantitativ (d.h. der eingesetzte Wasserstoff wird vollständig an die Doppelbindungen angelagert, es bleibt keine Doppelbindung verschont), daher kann man auf diese Weise leicht die Zahl der Doppelbindungen in einem organischen Molekül bestimmen. So kann man zum Beispiel herausbekommen, wie viele Doppelbindungen eine ungesättigte Fettsäure enthält.
Dazu muss man gar nicht das Volumen des verbrauchten Wasserstoffs ermitteln, sondern oft reicht es, wenn man die Hydrierungswärme misst. Ungefähr 126 kJ/mol werden pro hydrierter Doppelbindung freigesetzt, mal mehr, mal weniger. Allerdings kann das Alken nicht einfach mit gasförmigen Wasserstoff in Verbindung bringen, sondern es sind spezielle Katalysatoren notwendig, damit die Addition von H2 stattfinden kann. Das liegt einfach an der recht hohen Aktivierungsenergie der Hydrierung.
Wenn Sie mehr über dieses Thema erfahren wollen, sollten Sie sich die Seite ansehen, die ich speziell für die Abteilung "Studienvorbereitung Organische Chemie" geschrieben habe.
Halogenierung
Die Addition von Chlor oder Brom erfolgt bereits bei Zimmertemperatur. Der Mechanismus der Bromierung eines Alkens ist auf der entsprechenden Seite eingehend dargestellt. Die Bromierung wird im Schulunterricht gerne eingesetzt, um C=C-Doppelbindungen nachzuweisen, meistens wird dafür Hexen oder Cyclohexen genommen.
Ich selbst nehme im Anschluss daran gerne zwei verschiedene Pflanzenöle, eines mit wenigen ungesättigten Fettsäuren, und zum Vergleich eines mit einem hohen Anteil ungesättigter Fettsäuren. Dann zeige ich den S., dass man mit Bromwasser die Doppelbindungen in einem Pflanzenöl nachweisen kann. In guten Chemie-Kursen lasse ich die S. dann einen Versuch entwickeln, mit dem sie quantitativ (oder zumindest ansatzweise quantitativ) herausbekommen können, welches der beiden Pflanzenöle mehr ungesättigte Fettsäuren enthält.
Das Ergebnis der Halogenierung sind sogenannte vicinale Dihalogenalkane. Das Wort "vicinal" ( lat. vicinus = Nachbar) bedeutet dabei, dass die beiden Halogen-Atome an direkt benachbarten Kohlenstoff-Atomen sitzen. Bei der Bromierung von 2-Buten entsteht also stets 2,3-Dibrom-butan und nicht etwa 2,2-Dibrom-butan oder 1,3-Dibrom-butan.
Weitere Einzelheiten siehe "Bromierung von Alkenen" auf dieser Homepage.
Hydrohalogenierung
Setzt man zur Addition nicht elementares Brom oder Chlor ein, sondern stattdessen Bromwasserstoff oder Chlorwasserstoff, so erhält man Monobrom- bzw. Monochloralkane.
Der Mechanismus dieser Reaktion ist etwas einfacher als der der Bromierung oder Chlorierung, weil HBr bzw. HCl bereits Dipol-Moleküle sind, daher kann der Wasserstoff leicht als Proton abgespalten werden. Das Proton setzt sich dann an die C=C-Doppelbindung, wobei ein Carbenium-Ion entsteht.
Beim Ethen gibt es nur eine Möglichkeit zur Bildung eines Carbenium-Ions, weil die beiden C-Atome des Ethens gleichwertig sind (beides sind primäre C-Atome). Beim Propen allerdings ist eines der C-Atome primär, das andere jedoch sekundär. Da sekundäre Carbenium-Ionen stabiler sind als primäre, setzt sich das Proton meistens an das primäre C-Atom, dann entsteht nämlich ein sekundäres Carbenium-Ion (Regel von Markownikow).
Weitere Einzelheiten siehe "Hydrobromierung von Alkenen" auf dieser Homepage.
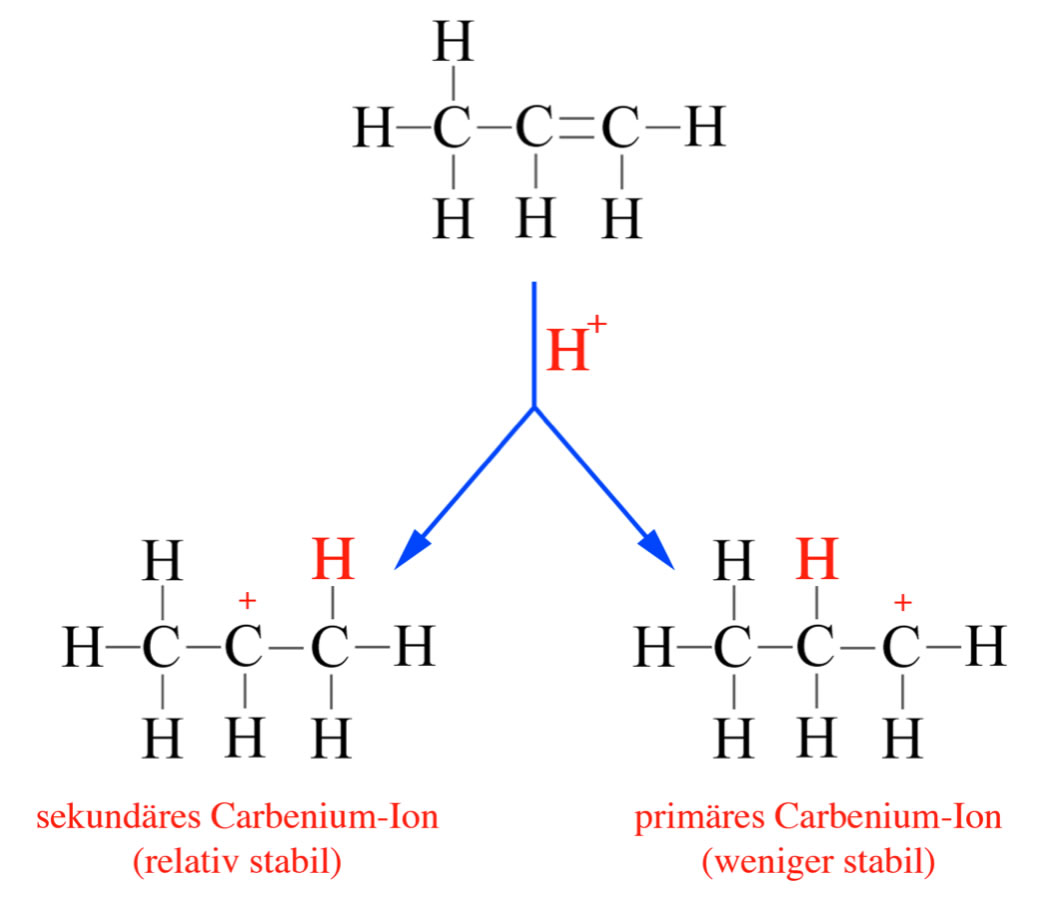
Bei der Addition eines Protons an eine C=C-Doppelbindung bildet sich stets das stabilere Carbenium-Ion, wenn es mehrere Möglichkeiten gibt.
Hydratisierung
Die Hydratisierung ist die Addition von Wasser an ein Alken. Auch hier lagert sich zunächst ein Proton an die C=C-Doppelbindung an, wobei wieder die Markownikow-Regel wirkt (siehe Abbildung 1). In der Industrie ist die direkte Addition von Wasser an Alkene ein Hauptverfahren zur Herstellung von Alkoholen. Alkene können leicht aus Erdgas oder Erdöl gewonnen werden, entweder durch direkte Isolierung aus den Rohstoffen, oder durch Cracken längerkettiger Alkane.
Addition von Schwefelsäure
Eine Reaktion, die im normalen Schulunterricht nicht besprochen wird, ist die Addition von Schwefelsäure an die C=C-Doppelbindung. Lässt man ein Alken mit kalter konzentrierter Schwefelsäure reagieren, entsteht ein Alkylhydrogensulfat. Flüssige Alkene werden einfach mit der Schwefelsäure vermischt, gasförmige Alkene werden durch die Schwefelsäure geleitet.
Zusammenfassung: Einfache Reaktion der Alkene
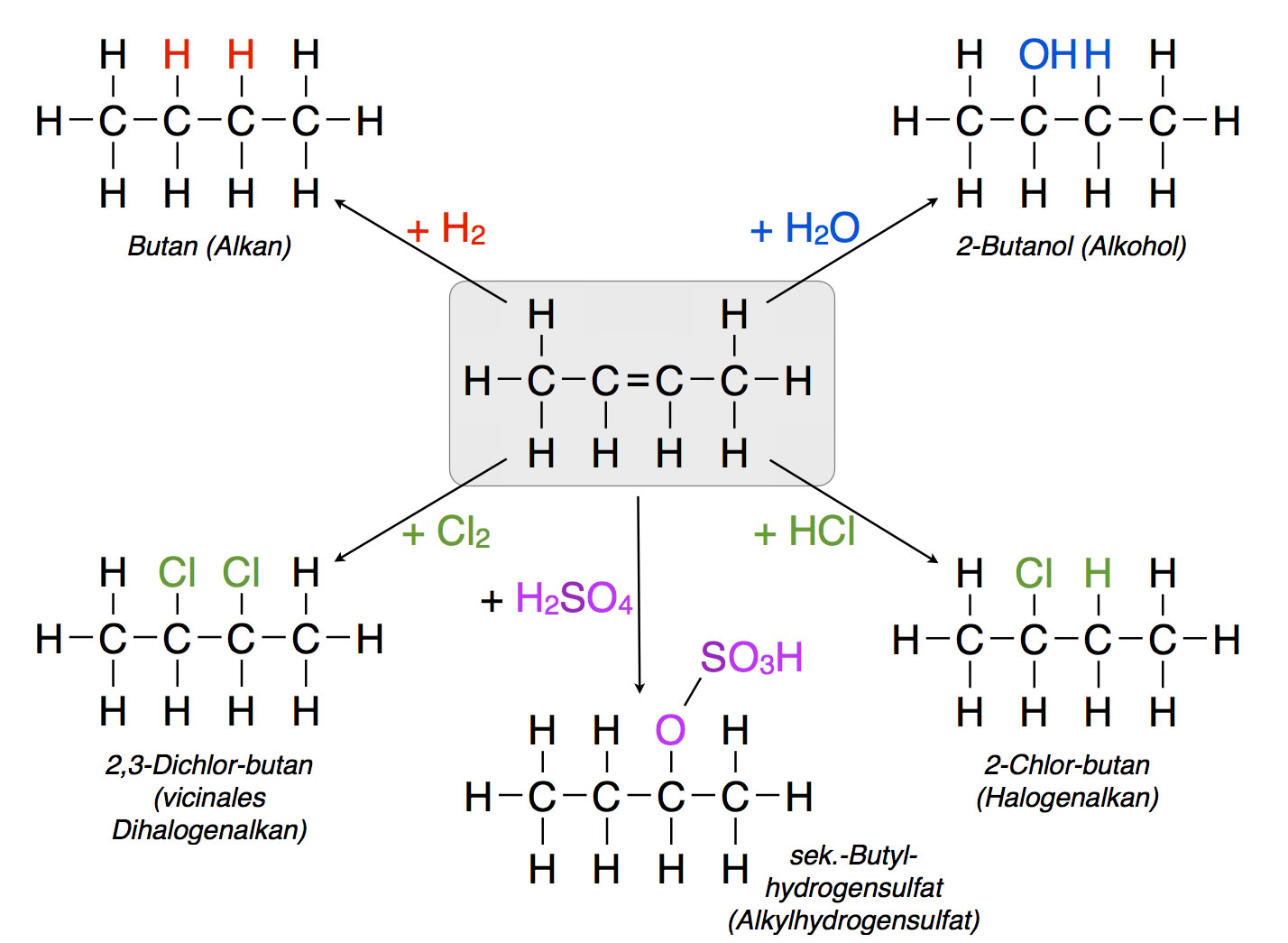
Die wichtigsten einfachen Reaktionen der Alkene
Auf diesem Bild sieht man noch einmal die fünf im Text erwähnten Additionsreaktionen der Alkene. Was auf dem Bild noch nicht berücksichtigt wurde, sind Dimerisierungen und Polymerisierungen der Alkene. Dazu habe ich zwei eigene Seiten erstellt, weil diese Prozesse recht wichtig für die industrielle chemische Industrie sind, zum Beispiel für die Herstellung von Kunststoffen.
Und weil Polymerisierungen von Alkenen zu wichtigen Kunststoffen führen und Kunststoffe ein abiturrelevantes Thema ist, sind auch die Alkene und ihre Reaktionen sehr wichtig für das Chemie-Abitur.