 |
 |
 |
|
| Brandfördernd | Gas unter Druck | Gesundheitsgefahr |
1. Einführung
Ethen ist das einfachste Alken, kennzeichnend ist die C=C-Doppelbindung.
Für den Chemie-Unterricht ist Ethen in mindestens fünffacher Hinsicht relevant.
- Einmal dient Ethen als Stellvertreter für die Stoffklasse der Alkene, am Beispiel Ethen kann der Mechanismus der elektrophilen Addition gut erklärt werden.
- Dann kann am Beispiel Ethen sehr gut die Struktur der C=C-Doppelbindung erklärt werden, wobei Kenntnisse des Orbitalmodells natürlich sehr helfen.
- Ethen ist drittens für das Thema "Polymere" wichtig, man denke etwa an Polyethylen und andere Kunststoffe, die durch Polymerisation von Alkenen und Alkenderivaten entstehen.
- Für die Behandlung des Themas "Benzol" sind Kenntnisse über Ethen und Alkene ebenfalls sehr wichtig, wird doch bei der Besprechung von Aromaten immer wieder auf die konjugierten C=C-Doppelbindungen eingegangen.
- Auch bei dem Thema "Farbstoffe" wird auf die Überlappung von p-Orbitalen eingegangen, wobei dann wieder auf Kenntnisse zum Thema "Ethen" und "C=C-Doppelbindung" zurückgegriffen wird.
2. Strukturdaten
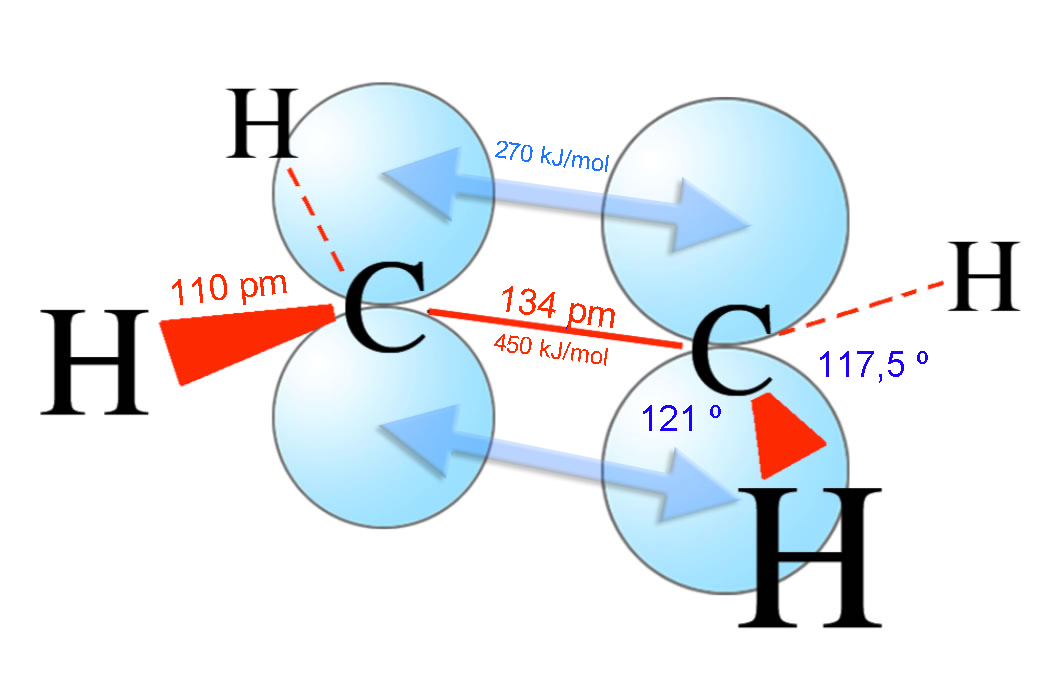
Strukturdaten des Ethen-Moleküls
Die beiden C-Atome des Ethen-Moleküls sind sp2-hybridisiert, die sp2-Hybridorbitale liegen in einer Ebene. Die C=C-Doppelbindung besteht aus zwei verschiedenen Bindungen, der stabileren Sigma-Bindung und der schwächeren Pi-Bindung.
σ-Bindung
Die Sigma-Bindung ergibt sich durch die Überlappung von zwei sp2-Hybridorbitalen der beiden C-Atome. Sie hat eine Länge von 134 pm und ist damit kürzer als die C-C-Einfachbindung im Ethan-Molekül (154 pm). Das liegt daran, dass die sp2-Hybridorbitale kleiner bzw. kürzer sind als die sp3-Hybridorbitale im Ethan-Molekül. Der s-Anteil in einem sp2-Hybridorbital ist größer als der in einem sp3-Hybridorbital, daher ist ein sp2-Orbital etwas kürzer als ein sp3-Orbital.
C-H-Bindungen
Dieser Unterschied wirkt sich auch auf die vier C-H-Bindungen im Ethen-Molekül aus. Die Bindungslänge beträgt hier 110 pm, und das ist auch etwas kürzer als die sechs C-H-Bindungen im Ethan-Molekül (108,7 pm). Allerdings ist hier der sp2/sp3-Unterschied nicht so gravierend wie bei der C-C-Bindung.
π-Bindung
Die beiden pz-Orbitale der beiden C-Atome des Ethens stehen parallel ausgerichtet zueinander, was die Möglichkeit zur Überlappung ergibt. Durch die leichte Überlappung dieser beiden Orbitale entsteht die Pi-Bindung. Diese ist deutlich schwächer als die Sigma-Bindung, zur Spaltung dieser Bindung werden lediglich 270 kJ/mol benötigt, während die Bindungsdissoziationsenergie der σ-Bindung bei 450 kJ/mol liegt.
3. Physikalische Eigenschaften
3.0 Allgemeines
Ethen hat ähnliche physikalische Eigenschaften wie Ethan: Es ist farblos, bei Zimmertemperatur gasförmig, hat sehr niedrige Schmelz- und Siedepunkte, eine geringe Dichte, so gut wie keine Wasserlöslichkeit und ist brennbar (wobei das aber schon eine chemische Eigenschaft ist).
Diese Eigenschaften liegen in der Struktur des Ethen-Moleküls begründet. Ähnlich wie Ethan sind die C=C-Doppelbindung und die C-H-Bindungen ziemlich unpolar, so dass die Moleküle in festem oder flüssigen Ethen nahezu ausschließlich durch die schwachen London-Kräfte zusammengehalten werden.
3.1 Schmelz- und Siedepunkte
Der Schmelzpunkt von Ethen liegt bei -169,18 ºC, der Siedepunkt bei -103,7 ºC . Zum Vergleich: Ethan hat einen Siedepunkt von -89 ºC, liegt also deutlich höher, was auf schwächere London-Kräfte beim Ethen schließen lässt.
Das könnte daran liegen, dass das Ethen-Molekül wegen seiner C=C-Doppelbindung relativ starr ist. Die planare Struktur des Ethen-Moleküls reduziert offensichtlich die Kontaktfläche zwischen den Molekülen, die ja ein entscheidender Faktor für das Zustandekommen der London-Kräfte ist. Ethan-Moleküle dagegen können wegen der freien Drehbarkeit der C-C-Einfachbindung kompaktere Aggregate mit größeren Kontaktflächen bilden.
Bildlich gesprochen, können sich zwei Ethan-Moleküle leichter ineinander "verhaken" als zwei Ethen-Moleküle. Daher die größere Kontaktfläche beim Ethan.
3.2 Löslichkeitsverhalten
Die Wasserlöslichkeit von Ethen ähnelt der von Ethan, sie ist mit 130 mg/l sehr schlecht, ist aber immerhin doppelt so hoch wie die Wasserlöslichkeit des Ethans (61 mg/l). Wie bei allen Alkanen und Alkenen ist die Löslichkeit in unpolaren organischen Lösemitteln sehr gut.
3.3 Weitere Eigenschaften
Ethen ist farblos, aber nicht geruchlos, das Gas hat einen leicht süßlichen, von vielen Menschen als unangenehm empfundenen Geruch. Die Dichte von Ethen beträgt 0,717 g/cm3. Der Flammpunkt beträgt -136 ºC, die Entzündungstemperatur 425 ºC.
4. Gewinnung und Synthese
4.1 Steamcracken
Ethan kommt im Erdgas in geringen Spuren vor, kann aber aus Erdgas und Erdöl durch Steamcracken gewonnen werden.

Thermische Spaltung von Alkanen, Rekombination und H-Abstraktion
Autor: Ulrich Helmich 2023, Lizenz: Public domain.
Die Abbildung zeigt die thermische Spaltung von Alkanen am BeispielHeptan. Bei dieser Pyrolyse werden Alkane unter Einwirkung eines Katalysators (Zeolith) erhitzt, dabei bilden sich kürzere Alkylradikale. Solche Alkylradikale haben zwei Möglichkeiten, miteinander zu reagieren. Zwei dieser Radikale können sich zu einem Alkan-Molekül zusammenschließen (Rekombination), oder das eine Radikal abstrahiert aus einem anderen Radikal ein H-Atom, so dass ein Alkan und ein Alken entstehen (H-Abstraktion). Wenn aus einem Ethyl-Radikal ein H-Atom abstrahiert wird, entsteht ein Ethen-Molekül.
4.2 Dehydratisierung von Ethanol
Da dieser Versuch gern im Chemieunterricht durchgeführt wird, könnte man denken, dass es sich um ein reines Laborverfahren handelt. Das Gegenteil ist aber der Fall. In Ländern, die viel Bioalkohol produzieren wie zum Beispiel Brasilien (dort aus Zuckerrohr), wird dieser Bioalkohol oft in das Alken Ethen umgewandelt. Als Nebenprodukt entsteht dabei Diethylether. Dadurch können diese Länder ihre Abhängigkeit vom Erdöl verringern.
4.3 Hydrierung von Ethin
Vor dem Aufkommen des Steamcracking stellte man Ethen durch Addition von Wasserstoff aus dem Alkin Ethin C2H2 her. Das Ethin gewann man dazu aus Calciumcarbid CaC2. In Deutschland wurde so die Hälfte des Ethen-Bedarfs hergestellt. Einzelheiten dazu siehe den entsprechenden Abschnitt im Wikipedia-Artikel "Ethen".
4.4 Dehydrierung von Ethan
Im Prinzip könnte man Ethen auch durch Dehydrierung von Ethan gewinnen, wenn man geeignete Platin- oder Chromkatalysatoren einsetzt. Allerdings ist die Reaktion ziemlich endotherm (ΔH = +136 kJ/mol!) und daher nicht konkurrenzfähig gegenüber dem bewährten Steamcracken.
4.5 Weitere industrielle Verfahren
In dem Wikipedia-Artikel werden noch weitere industrielle Verfahren zur Synthese von Ethen aufgelistet, auf die hier aber nicht weiter eingegangen werden soll; für den Chemie-Unterricht der Oberstufe beispielsweise sind sie nicht relevant.
5. Reaktionen
Das charakteristische Kennzeichen der Alkene ist die C=C-Doppelbindung, die elektrophile und radikalische Additionen erlaubt. Bereits im Chemieunterricht der Oberstufe lernt man im Grundkurs die elektrophilen Addition kennen. Die Addition von Wasserstoff an Ethen liefert beispielsweise Ethan, die Addition von Wasser Ethanol, die Addition von Chlorwasserstoff Chlorethan. Im Leistungskurs wird oft auch die radikalische Addition behandelt, die es erlaubt, Polymere aus Ethen-Monomeren zu synthetisieren: Polyethen.
5.1 Elektrophile Addition
Die elektrophile Addition wird durch den Angriff eines Elektrophils wie H+ oder Br+ eingeleitet. Es bildet sich dann ein positiv geladenes Ion, entweder ein Carbenium-Ion wie bei dem Angriff von H+, oder ein Halolgenium-Ion wie beim Angriff von Br+. Die Markownikoff-Regel spielt beim Ethen noch keine Rolle, da das Molekül völlig symmetrisch aufgebaut ist und beide C-Atome quasi nicht unterscheidbar sind.
Der zweite Schritt der elektrophilen Addition ist dann die Addition eines Nucleophils wie OH- bei der Hydratisierung oder Br- bei der Bromierung.
5.2 Radikalische Addition
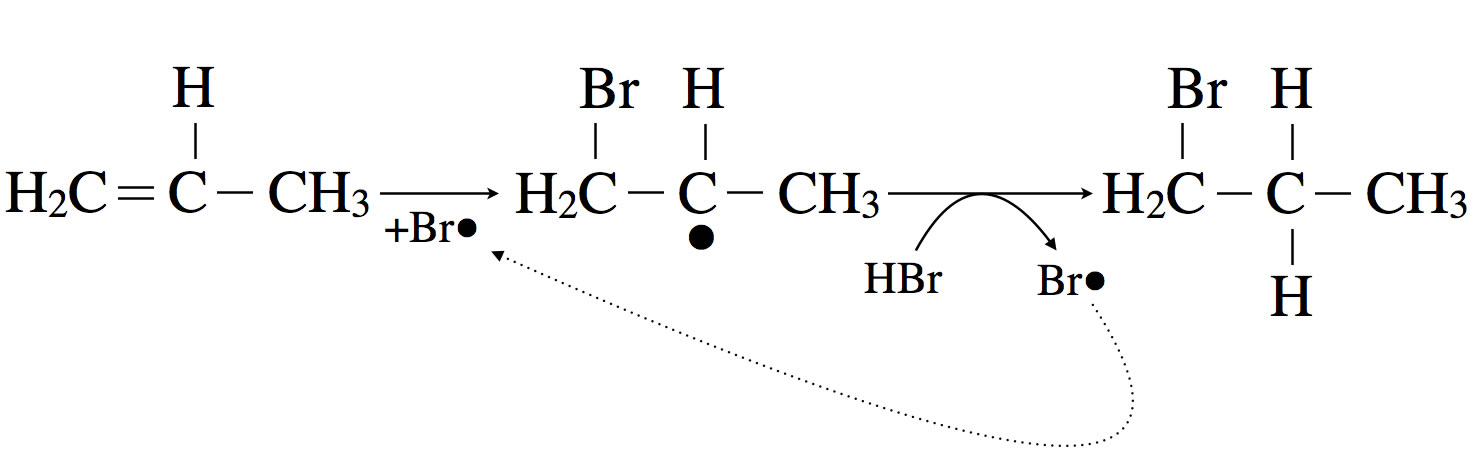
Die radikalische Hydrobromierung von Propen
Autor: Ulrich Helmich 2017, Lizenz: Public domain
Hier sehen wir die Bildung von Brompropan aus Propen - die radikalische Addition von HBr an Ethen läuft ähnlich ab. Zunächst greift ein Brom-Atom als Radikal die C=C-Doppelbindung an, dabei entsteht ein Bromalkyl-Radikal. Dieses Radikal abstrahiert dann aus einem HBr-Molekül ein H-Atom, übrig bleibt ein Brom-Radikal, das dann den nächsten Reaktionszyklus startet.
Solche Reaktionen spielen bei der Polymerisierung von Ethen und anderen Alkenen eine wichtige Rolle. Ein Radikal, das durch Homolyse eines Starters gewonnen wird, setzt sich an ein Ethen-Molekül, das dadurch zu einem Radikal wird. Dieses Ethyl-Radikal setzt sich nun an die C=C-Doppelbindung des nächsten Ethen-Moleküls, so dass ein Butyl-Radikal entsteht. Das Butyl-Radikal setzt sich wieder an ein Ethen-Molekül, und es bildet sich ein Hexyl-Radikal. Und so läuft die Reaktion immer weiter, bis schließlich ein langes, aus vielen Tausend Monomeren bestehendes Polymer entstanden ist.
5.3 Diels-Alder-Reaktion
Unter diesem Begriff versteht man die Cycloaddition eines konjugierten Diens mit einem sogenannten Dienophil. Das einfachste Beispiel für eine solche Reaktion ist die Umsetzung von 1,3-Butadien mit Ethen zu Cyclohexen, die wie folgt abläuft:
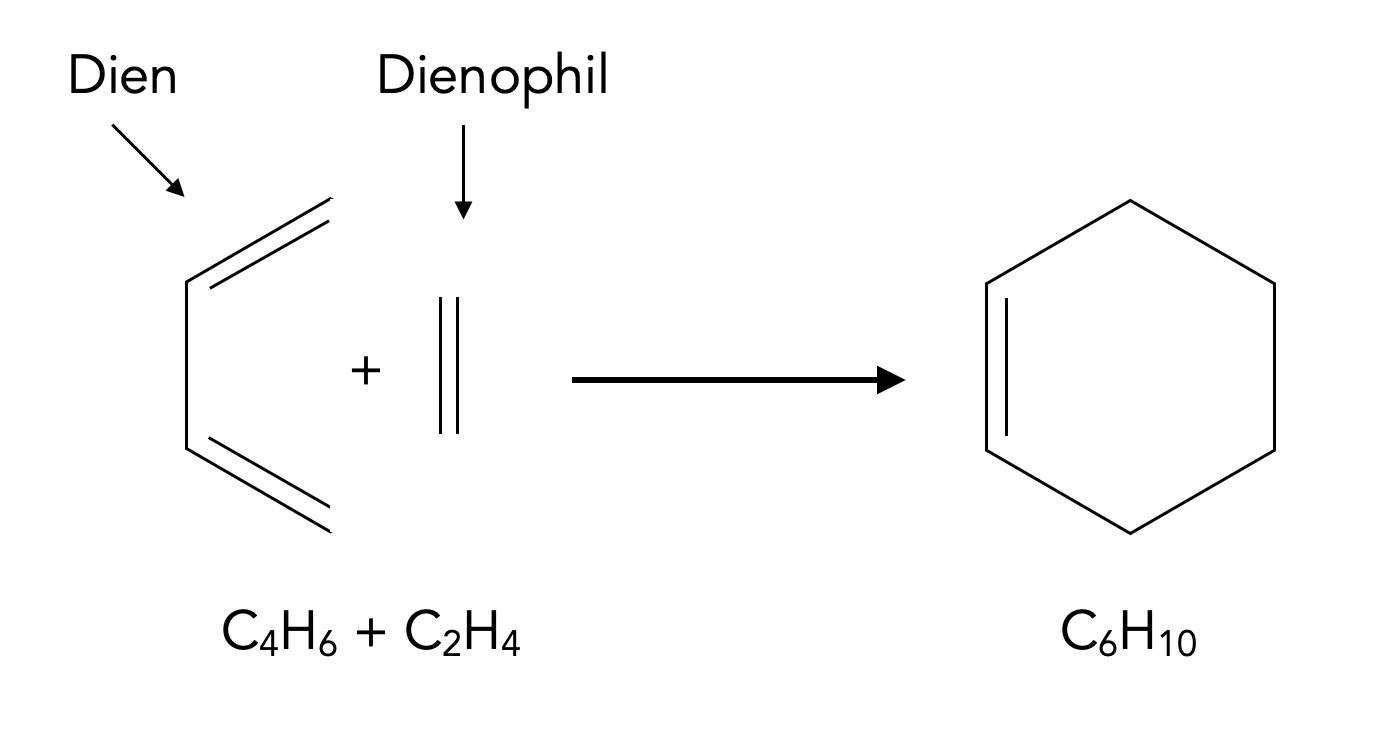
Die denkbar einfachste Diels-Alder-Reaktion
Autor: Ulrich Helmich 01/2024, Lizenz: Public domain
Der genaue Mechanismus dieser Reaktion wird auf dieser Seite im Chemie-Lexikon näher erklärt.
5.4 Metallorganische Reaktionen
In dem Wikipedia-Artikel über Ethen gibt es einen ziemlich langen Abschnitt über die metallorganischen Reaktionen des Ethens, auf den ich hier aber nicht näher eingehen möchte.
Dieser Verweis führt direkt zum entsprechenden Abschnitt in dem Wikipedia-Artikel.
5.5 Oxidation
Ethen ist ein brennbares Gas, wenn genügend Sauerstoff anwesend ist, verbrennt es sauber zu Kohlendioxid und Wasser:
$C_2H_4 + 3 \ O_2 \to 2 \ CO_2 + 2 \ H_2O$
Die Verbrennungsenthalpie beträgt -1411 kJ/mol.
5.6 Weitere Reaktionen
Bei hohen Temperaturen und unter Abwesenheit von O2 kann Ethen in Methan und Kohlenstoff zerfallen. Interessanter ist die Reaktion von Ethen mit Dischwefelchlorid S2Cl2 zu Senfgas:
$C_2H_4 + S_2Cl_2 \to Cl \mbox{-} CH_2 \mbox{-} CH_2 \mbox{-} S \mbox{-} CH_2 \mbox{-} CH_2 \mbox{-}Cl + S$
6. Vorkommen und Bedeutung
6.1 Vorkommen
Ethen kommt in geringen Spuren in der Atmosphäre vor, hauptsächlich wegen der Erzeugung durch Pflanzen. Ethen ist nämlich ein wichtiges Phytohormon (Pflanzenhormon). Ein Teil des atmosphärischen Ethens wird auch durch die Industrie erzeugt, in Städten auch durch den Autoverkehr.
6.2 Bedeutung
Die Bedeutung von Ethen für die chemische Industrie ist nicht zu unterschätzen. Ethen ist einer der wichtigsten Rohstoffe für chemische Synthesen. Über 30% aller Petrochemikalien werden aus Ethen erzeugt.
Aus Ethen werden beispielsweise Polyethen, Ethylendichlorid (zur PVC-Herstellung), Ethylenoxid (Polyester-Herstellung), Anthracen, Chlorethan, Propanal, Isopren und viele andere Verbindungen synthetisiert.
Auch als Phytohormon zur Fruchtreife wird Ethen in großem Maßstab eingesetzt.
In diesem langen Abschnitt des Wikipedia-Artikels über Ethen finden sich viele weitere Beispiele für Folgeprodukte des Ethens.
6.3 Biosynthese
Ethen ist ein Phytohormon, das von Pflanzen produziert wird. Wie der genaue Syntheseweg abläuft, wird in diesem Abschnitt des Wikipedia-Artikels erläutert.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Wikipedia-Artikel "Ethen"
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 3. Auflage, Weinheim 2000.
- Schirmeister, Schmuck, Wich: Beyer/Walter Organische Chemie, 25. Auflage 2015.