Konformation und Konstitution
Was man unter einer Konformation versteht, haben Sie bereits bei der Behandlung des Ethan-Moleküls gelernt. Durch einfaches Drehen einer Methylgruppe um die C-C-Einfachbindung erhält man eine andere Konformation.
Ein anderer wichtiger Fachbegriff ist der Begriff der Konstitution. Unter der Konstitution versteht man die Art und Weise, in der die Atome eines Moleküls verknüpft sind. Die Konstitution eines Moleküls kann man mit Worten beschreiben (verbal) oder durch eine Zeichnung (graphisch, in der Regel durch eine Strukturformel).
Hier die verbale Beschreibung der Ethan-Konstitution:
"Zwei C-Atome sind durch eine Einfachbindung miteinander verbunden. Jedes der C-Atome ist mit drei H-Atomen verbunden."
Da es zwischen Kohlenstoff- und Wasserstoff-Atomen keine Doppel- oder Dreifachbindungen gibt, muss man bei der Beschreibung eigentlich nicht erwähnen, dass die C-H-Bindungen Einfachbindungen sind. Bei Kohlenstoff-Atomen dagegen gibt es Einfach-, Doppel- und Dreifachbindungen. Hier muss man immer angeben, um welche Bindung es sich genau handelt. Also hier die verbale Beschreibung der Ethen-Konstitution:
"Zwei C-Atome sind durch eine Doppelbindung miteinander verbunden. Jedes der C-Atome ist mit zwei H-Atomen verbunden."
Wenn man weiß, dass es sich bei der Verbindung um einen Kohlenwasserstoff handelt, dass also nur C- und H-Atome vorkommen, dann kann man sich die Ergänzung "Jedes der C-Atome ist mit zwei / drei H-Atomen verbunden" auch noch sparen.
Butan
Die Konstitution des Butan-Moleküls könnte man so beschreiben:
"Vier C-Atome sind durch drei Einfachbindungen zu einer Kette verbunden. Die beiden mittleren C-Atome sind außerdem mit je zwei H-Atomen verknüpft, während die beiden äußeren C-Atome mit je drei H-Atomen verbunden sind."
Eine Konstitution kann aber auch graphisch definiert werden, in der Regel benutzt man dazu Strukturformeln, Molekülmodelle oder Photos von Molekülmodellen. Wenn wir die Konstitution des Butans definieren, gibt es ein neues Phänomen: Es existieren zwei völlig verschiedene Konstitutionen des Butans:
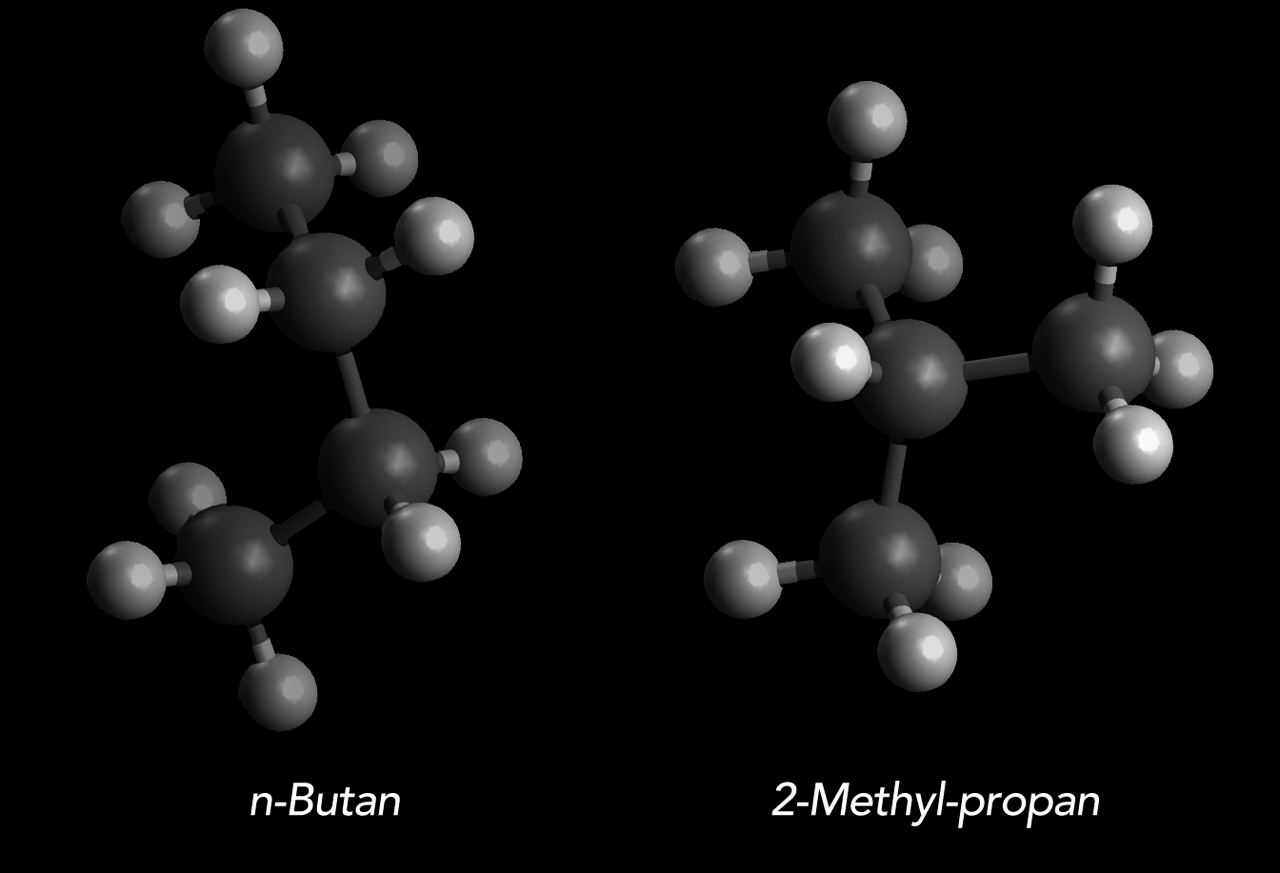
Das "normale" Butan oder n-Butan sowie das 2-Methyl-propan
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Hier sehen wir links das "normale" Butan, das auch als n-Butan bezeichnet wird. Das Molekül sieht recht langgestreckt aus. Rechts sehen wir das 2-Methyl-propan, auch Isobutan genannt. Das Molekül sieht kompakter aus.
Beide Butan-Isomere haben die gleiche Summenformel (C4H10), aber unterschiedliche Strukturformeln und damit auch unterschiedliche Konstitutionen. Was wir hier sehen, ist ein typisches Beispiel für Konstitutions-Isomerie.
Schüler(innen) haben immer Probleme mit dem 2-Methyl-propan. Sie sehen oft nicht ein, dass es sich um ein "Propan" handelt, wo die Verbindung doch vier C-Atome hat. Andere Schüler(innen) dagegen haben das gegenteilige Problem. Wieso ist das 2-Methyl-propan ein Butan? Beide Fragen habe ich oft im Unterricht erlebt.
Jetzt stellt sich die Frage, ob sich diese unterschiedliche Molekülgestalt - die unterschiedliche Struktur also - auf die Eigenschaften der Stoffe n-Butan und 2-Methyl-propan auswirkt. Die Siedepunkt dieser Verbindungen eignen sich besonders gut, um diese Struktur-Eigenschafts-Beziehungen zu untersuchen.
Siedepunkte der beiden isomeren Butane - Anwendung des Struktur-Eigenschafts-Konzepts
Nach dem Struktur-Eigenschafts-Konzept hängen die Eigenschaften eines Stoffes stark von seiner Struktur ab. Unter didaktischen Aspekten könnte man sagen, die Schüler(innen) sollen lernen, die Eigenschaften einer Verbindung mit Hilfe ihre molekulare Struktur zu erklären.
Das 2-Methyl-propan hat nun eine eher "kugelförmige" Struktur, während das n-Butan eher langgestreckt ist.
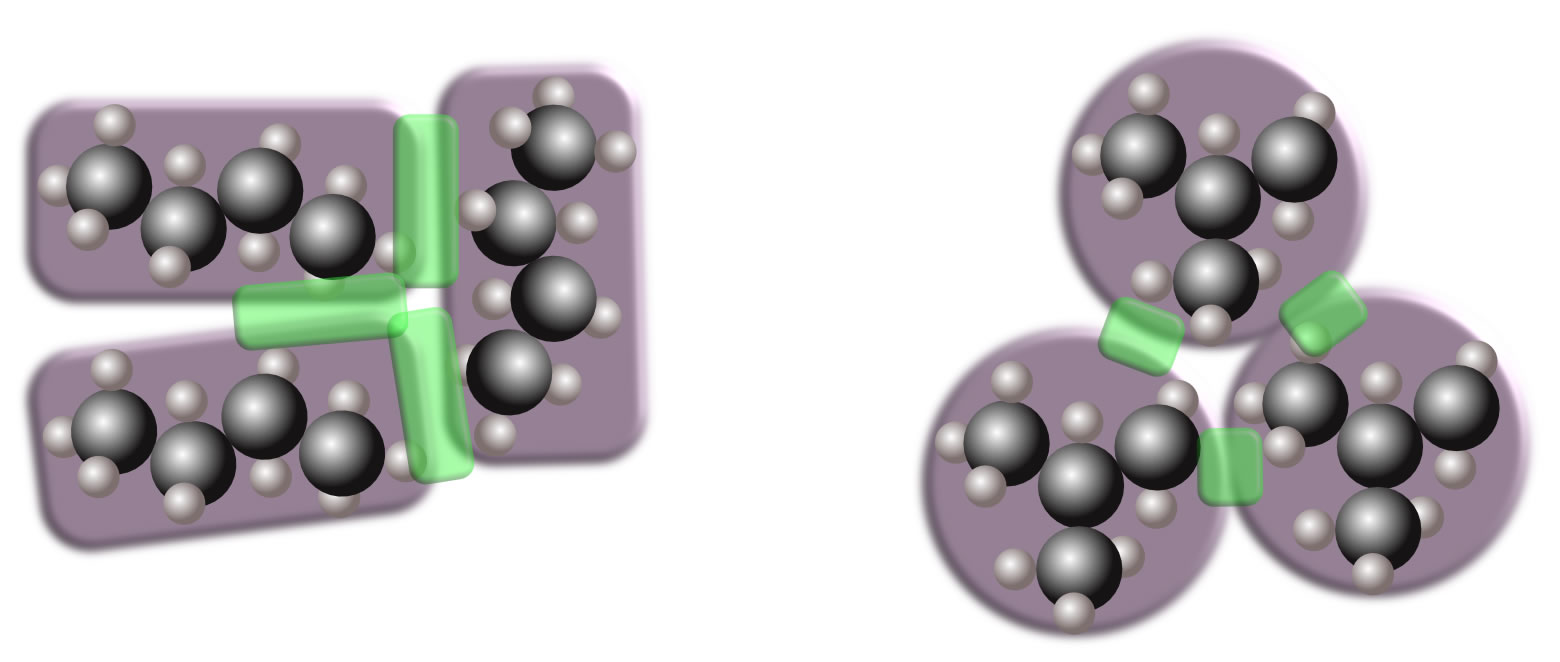
Kontaktflächen zwischen jeweils drei Molekülen n-Butan und 2-Methyl-propan
Autor: Ulrich Helmich 2022, Lizenz: Public domain.
Wie man auf der Graphik oben sieht, haben die langgestreckten n-Butan-Moleküle eine größere gemeinsame Kontaktfläche als die eher kugelförmigen 2-Methyl-propan-Moleküle. Die Kontaktflächen sind in der Abbildung grün hervorgehoben. An diesen Kontaktflächen finden nun die van-der-Waals-Wechselwirkungen zwischen den einzelnen Molekülen statt (genau: die London-Wechselwirkungen). Beim n-Butan sind diese Wechselwirkungen größer also beim 2-Methyl-propan, entsprechend höher sollte der Energiebetrag sein, der zum Auftrennen dieser Molekülverbände notwendig ist. Und das wiederum sollte sich in der höheren Siedetemperatur des n-Butans widerspiegeln.
Unsere Hypothese nach all diesen Überlegungen sollte also sein: Das n-Butan hat einen (deutlich?) höheren Siedepunkt als das 2-Methyl-propan.
Schauen wir nach: Das n-Butan hat einen Siedepunkt von -0,50 ºC, und das 2-Methyl-propan hat einen Siedepunkt von -11,7 ºC, liegt also deutlich darunter. Damit wäre also unsere Hypothese bestätigt.
Pentan
Während es nur zwei Isomere des Butans gibt, existieren drei Pentan-Isomere:

Die drei Pentan-Isomere, hier ein Photo von Kugel-Stab-Modellen
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Oben links sehen wir das n-Pentan mit einem Siedepunkt von 36 ºC, oben rechts das Methyl-butan mit einem Siedepunkt von 28 ºC, und unten links das Dimethyl-propan mit einem Siedepunkt von nur 9,5 ºC. Diese Staffelung der Siedetemperaturen bestätigt das, was wir bereits bei den beiden Butanen herausgefunden hatten: Je kompakter bzw. kugelähnlicher die Moleküle sind, desto geringer die Kontaktflächen zwischen den Molekülen, desto geringer die intermolekularen Anziehungskräfte, desto weniger Energie muss zum Verdampfen aufgewandt werden und desto geringer ist der Siedepunkt.
Von diesen drei Isomeren habe ich mit dem Mac-Programm Avogadro eine neue Version erstellt:

Die drei Pentan-Isomere, hier am Rechner erzeugt
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Beurteilen Sie selbst, welche Darstellung besser aussieht.
Sie fragen sich jetzt vielleicht, warum ich die Bezeichnung Methyl-butan gewählt habe und nicht 2-Methyl-butan? Oder warum Dimethyl-propan und nicht 2,2-Dimethyl-propan?
Ganz einfach: Es gibt nur ein einziges Methyl-butan, nämlich das 2-Methyl-butan. Ein 1-Methyl-butan wäre nichts anderes als n-Pentan, und ein 3-Methyl-butan ist identisch mit dem 2-Methyl-butan, das um 180 Grad gedreht wird. Also muss man die Stellung der Methylgruppe eigentlich gar nicht angeben, die Bezeichnung Methyl-butan ist eindeutig. Gleiches gilt für das 2,2-Dimethyl-propan. Wenn am Propan-Grundgerüst zwei Methylgruppen hängen, können sie sich nur am mittleren C-Atom befinden.
Hexan
Wir wollen unsere Hypothese - je kompakter die Molekülstruktur, desto niedriger der Siedepunkt - an einem zweiten Beispiel überprüfen, und zwar an drei Konstitutions-Isomeren des Hexans.
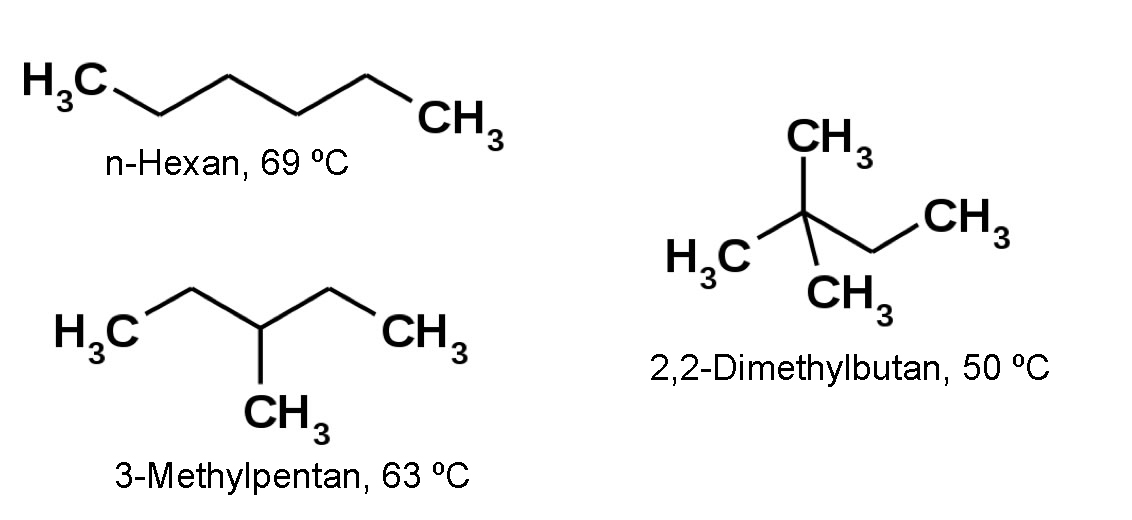
Siedepunkte von drei verschiedenen Hexanen
Autor: Ulrich Helmich 2017, Lizenz: Public domain
Von den drei abgebildeten Hexanen hat das n-Hexan mit 69 ºC den höchsten Siedepunkt. Die Kontaktflächen zwischen den langgestreckten Molekülen sind recht groß, daher herrschen auch verhältnismäßig starke London-Wechselwirkungen zwischen den Molekülen. Das 3-Methyl-pentan ist schon etwas kompakter gebaut, entsprechend sind die Kontaktflächen und damit die intermolekularen Wechselwirkungen kleiner. Das erklärt auch den niedrigeren Siedepunkt von nur 63 ºC. Das 2,2-Dimethyl-butan schließlich hat schon fast eine kugelförmige Gestalt. Somit ist auch die Kontaktfläche zwischen einzelnen Molekülen sehr gering, und das erklärt den sehr niedrigen Siedepunkt von nur 50 ºC.
Unsere Hypothese, dass die Siedepunkte der Alkane von der Kontaktfläche zwischen den Molekülen abhängen, hat sich also bestätigt. Ein mathematisch exakter Beweis ist das natürlich noch nicht, aber die Chemie ist ja auch keine Mathematik.
Seitenanfang -
Methan -
Ethan -
höhere Alkane -
Nomenklatur -
Isomerie -
physik. Eigensch. -
Gewinnung -
Reaktionen -
Abitur NRW