Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie...
- die Reaktionsgleichungen der Sauerstoff-Oxidation eines beliebigen Alkans zu entwickeln,
- das Grundprinzip der Alkan-Halogenierung verstanden haben,
- begründen können, wieso es sich bei der Chlorierung von Methan um eine Kettenreaktion handelt,
- das Verfahren und die Bedeutung der Alkan-Pyrolyse erläutern können.
5.1 Oxidation
Aus dem Alltag ist die Oxidation der Alkane nicht wegzudenken, schließlich ist es die Reaktion, die in jedem Verbrennungsmotor und in jeder Heizungsanlage abläuft, wenn sie mit Erdöl oder Erdgas betrieben wird. So allgegenwärtig diese Reaktion ist, so ist ihr Mechanismus doch noch weitgehend ungeklärt. Fest steht wohl, dass es sich um eine radikalische Reaktion handelt, die einerseits durch eine hohe Aktivierungsenergie (Erzeugung der Radikale) gekennzeichnet ist, andererseits durch eine hohe Reaktionsenthalpie.
Reaktionsgleichung der Oxidation
Wir wollen jetzt einmal die Reaktionsgleichung der Sauerstoff-Oxidation von Methan entwickeln. Zunächst schreiben wir die Edukte (Ausgangsstoffe) und die Produkte auf. Bei der Sauerstoff-Oxidation haben wir das Alkan und gasförmigen Sauerstoff als Edukte, und Wasser und Kohlendioxid als Produkte:
$CH_4 + O_2 \to H_2O + CO_2$
Wenn wir die Gleichung jetzt überprüfen, stellen wir fest, dass sie noch nicht vollständig ist. Auf der linken Seite haben wir vier H-Atome, auf der rechten nur zwei. Das können wir ändern, indem wir die Zahl der H2O-Moleküle rechts verdoppeln:
$CH_4 + O_2 \to 2 \ H_2O + CO_2$
Die Zahl der C-Atome und H-Atome stimmt jetzt links und rechts überein, aber links haben wir zwei O-Atome und rechts vier. Daher verdoppeln wir jetzt auf der linken Seite die Zahl der O2-Moleküle:
$CH_4 + 2 \ O_2 \to 2 \ H_2O + CO_2$
Nun haben wir eine "echte" Reaktions-Gleichung, mit Betonung auf "Gleichung".
Aufgabe
Entwickeln sie auf ähnliche Weise die Reaktionsgleichung für die Sauerstoff-Oxidation von Propan.
Lösung:
$C_{3}H_{8} + 5 \ O_{2} \to 4 \ H_{2}O + 3 \ CO_{2}$
Allgemein kann man sagen, dass die Zahl der Wasser-Moleküle genau halb so groß ist wie die Zahl der H-Atome im Alkan, und die Zahl der Kohlendioxid-Moleküle muss genau so groß sein wie die der C-Atome im Alkan.
Wenn das Alkan also die allgemeine Summenformel CnH2n+2 hat, dann ist die Zahl der H2O-Moleküle = n+1, und die Zahl der CO2-Moleküle ist = n. Daraus berechnet sich dann die Zahl der O-Atome auf der linken Seite mit 2n + n+1 = 3n + 1.
$C_{n}H_{2n+2} + \frac{3n + 1}{2} \ O_{2} \to (n+1) \ H_{2}O + n \ CO_{2}$
Diese allgemeine Gleichung für die Sauerstoff-Oxidation eines Alkans wollen wir einmal für Butan testen (n = 4):
$C_{4}H_{10} + \frac{13}{2} \ O_{2} \to 5 \ H_{2}O + 4 \ CO_{2}$
Wenn man die Atome links und rechts nachzählt, stellt man fest, dass diese allgemeine Gleichung korrekt ist.
Reaktionsmechanismus der Oxidation
Bei der Oxidation der Alkane handelt es sich allem Anschein nach um eine radikalische Kettenreaktion, deren genauer Mechanismus aber noch weitgehend ungeklärt ist. Eine der vielen möglichen Startreaktionen könnte so aussehen:
$CH_{4} +\bullet OH \to \bullet CH_{3} + H_{2}O$
Weiter kann an dieser Stelle nicht auf den Reaktionsmechanismus der Oxidation von Alkanen eingegangen werden, weil dies nicht mehr zum Schulstoff der gymnasialen Oberstufe gehört. Auch in den meisten Hochschul-Lehrbüchern der Organischen Chemie wird dieses Thema nur am Rande behandelt.
5.2 Halogenierung
Bei der Halogenierung reagiert ein Alkan mit einem Halogen wie Iod, Chlor oder Brom zu einem Halogenalkan. Halogenalkane wie Chloroform spielen ein wichtige Rolle im Alltag zum Beispiel als Lösemittel und in der chemischen Industrie als Lösemittel und Ausgangsstoffe für andere Produkte.
Gut untersucht ist die Chlorierung von Methan, die hier exemplarisch beschrieben werden soll. Es handelt sich bei dieser Reaktion um eine mehrschrittige Kettenreaktion. Nach einer Startreaktion erfolgen zwei Kettenfortpflanzungsschritte, die sich immer wiederholen, bis es zu einem Kettenabbruch kommt.
Startreaktion
Ein Chlor-Molekül Cl2 wird durch Lichtenergie in zwei Chlor-Radikale Cl• gespalten:
$Cl_{2} \to 2 \ Cl \bullet$
1. Kettenfortpflanzungsschritt
Ein Chlor-Radikal setzt sich nun an das Methan-Molekül und "zieht" ein H-Atom samt Bindungselektron aus dem Methan heraus. Es bildet sich ein Molekül HCl, und übrig bleibt ein Methyl-Radikal •CH3, dem ein H-Atom fehlt:
$Cl \bullet + \ H-CH_{3} \to Cl-H \ + \bullet CH_{3}$
2. Kettenfortpflanzungsschritt
Das Methyl-Radikal ist nun seinerseits sehr reaktiv und entzieht einem neuen Chlor-Molekül ein Halogen-Atom. Es bildet sich ein Molekül des Endprodukts CH3Cl:
$Cl_{2} + \bullet CH_{3} \to Cl \bullet + \ Cl-CH_{3}$
Kettenreaktion
Übrig bleibt wieder ein Chlor-Radikal Cl•. Dieses kann nun erneut ein Methan-Molekül angreifen und diesem ein H-Atom entziehen, so dass HCl und ein Methyl-Radikal •CH3 entstehen. Das Methyl-Radikal reagiert dann wieder mit einem Chlor-Molekül Cl2 zu Chlormethan CH3Cl und einem neuen Chlor-Radikal. Und so läuft das ganze weiter, bis entweder die Ausgangsstoffe eine zu niedrige Konzentration erreicht haben, um reagieren zu können, oder - viel wahrscheinlicher - bis zwei dieser Radikale zusammenstoßen und die Reaktionkette vorzeitig abbrechen. In der Tat bezeichnet man eine solche Reaktion, wie sie hier beschrieben wurde, als Kettenreaktion.
Kettenabbruch
Eine der folgenden Reaktionen führt stets zum Abbruch der Reaktionskette:
$2 \ Cl \bullet \to Cl_{2}$
$Cl \bullet + \bullet CH_{3} \to Cl-CH_{3}$
$H_{3}C \bullet + \bullet CH_{3} \to H_{3}C-CH_{3}$
5.3 Pyrolyse und Cracken
Durch den Entzug von Wasserstoff kann man aus Alkanen Vertreter der Stoffklasse der Alkene gewinnen. Das soll hier einmal am Beispiel der Pyrolyse von Heptan gezeigt werden.
Bei der Pyrolyse werden Alkane (meistens Gemische verschiedener längerer Alkane) in Abwesenheit von Sauerstoff auf hohe Temperaturen erhitzt und dadurch thermisch gespalten. Es entstehen kürzere Alkyl-Radikale:
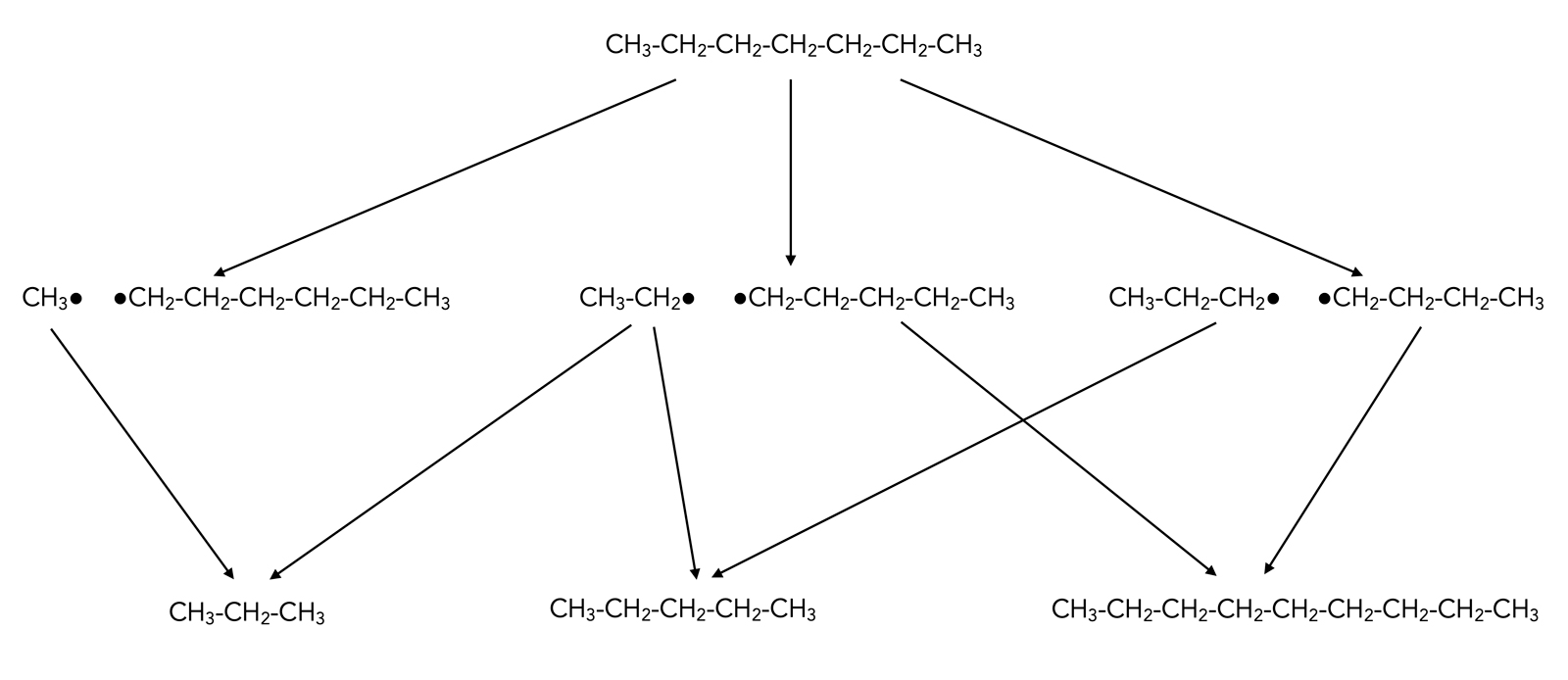
Pyrolyse von Heptan
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Diese kurzen Alkyl-Radikale können sich nun wieder zu Alkan-Molekülen vereinigen, wie man auf der Abbildung sehen kann. Aus einem Methyl-Radikal und einem Ethyl-Radikal kann sich beispielsweise ein Propan-Molekül bilden. Der Sinn dieses Vorgehens ist es, aus langkettigen Alkanen, die man aus dem Erdöl gewonnen hat, kürzerkettige Alkane zu erzeugen, die man für die Produktion von Benzin und anderen nachgefragten Brennstoffen verwenden kann.
Wie man auf dem Bild aber auch erkennen kann, entstehen neben kürzerkettigen Alkanen auch längerkettige Alkane. Rechts unten sehen wir zum Beispiel ein Nonan-Molekül, das sich durch die Vereinigung eines Pentyl- und eines Butyl-Radikals gebildet haben.
Neben dieser Radikal-Kombination haben die Alkyl-Radikale eine weitere Möglichkeit miteinander zu reagieren.
Denken Sie an den ersten Schritt der Alkan-Chlorierung: Ein Chlor-Radikal entreißt einem Alkan-Molekül ein Wasserstoff-Atom. Das Gleiche kann auch bei der Pyrolyse von Alkanen passieren: Ein Alkyl-Radikal entreißt einem anderen Alkyl-Radikal ein H-Atom:
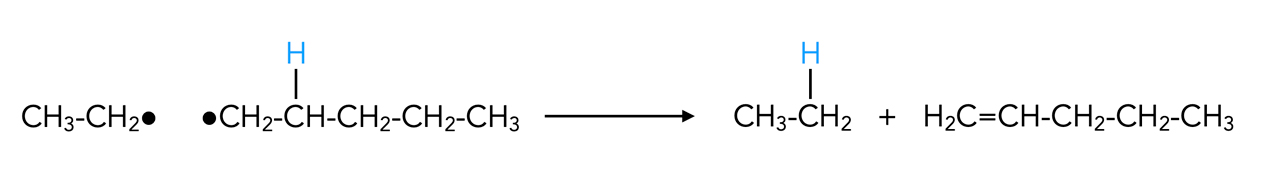
Ein Radikal abstrahiert ein H-Atom aus einem anderen Radikal
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Aus dem Ethyl-Radikal entsteht so das Ethan-Molekül, und aus dem Pentyl-Radikal ein Penten-Molekül. Penten gehört zu den Alkenen, hat also eine C=C-Doppelbindung im Molekül.
Durch den Einsatz bestimmter Katalysatoren kann man den Prozess der Pyrolyse recht genau steuern. Bei der Zeolith-katalysierten Pyrolyse von Dodecan C12H26 bei ca. 480 ºC entstehen so ca. 17% Propan und Propen, 31% Butan/Buten, 23% Pentan/Penten, 18% Hexan/Hexen und 11% höhere Alkane beziehungsweise Alkene; so steht es zumindest im aktuellen VollhardT/Schore [1].
Beim thermischen Cracken laufen übrigens ähnliche Prozesse ab: Lange Alkane werden durch hohe Temperaturen in kurze Alkylradikale gespalten, die dann auf die oben gezeigte Weise zu kürzeren Alkanen oder Alkenen reagieren. Natürlich entstehen dabei durch Rekombination von Radikalen auch wieder Moleküle längerer Alkane, aber diese können dann wieder durch die hohe Temperatur in zwei neue Alkylradikale gespalten werden.
Quellen:
- K. P. C. VollhardT, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Römpp Chemie-Lexikon, 9. Auflage 1992
Seitenanfang -
Weiter mit den Reaktionen der Alkane...