Lernziele
Wenn Sie diese Seite durchgearbeitet haben, sollten Sie...
- die niedrigen Siedepunkte der Alkane mit Hilfe der schwachen intermolekularen Anziehungskräfte erklären können,
- die Bedeutung der Kontaktfläche für die Stärke der van der Waals-Kräfte erläutern können,
- erklären können, wieso verzweigte Alkan-Isomere niedrige Siedetemperaturen haben als langkettige Isomere,
- die Schmelzpunkte, Viskositäten und Dichten der Alkane beschreiben können,
- begründen können, wieso Alkane nicht wasserlöslich sind,
- das Prinzip "Gleiches löst sich in Gleichem" auf Alkane anwenden können.
3.1 Siedetemperaturen
Alkane haben allgemein sehr niedrige Siedetemperaturen. Methan, Ethan, Propan und Butan sind bei Zimmertemperatur gasförmig, Butan kann allerdings leicht verflüssigt werden, wenn man es abkühlt oder unter Druck setzt.
Pentan, Hexan und die weiteren Alkane sind bei Zimmertemperatur flüssig, die Siedepunkt nehmen aber zu, je langkettiger die Alkan-Moleküle werden, wie die folgende Abbildung gut zeigt:
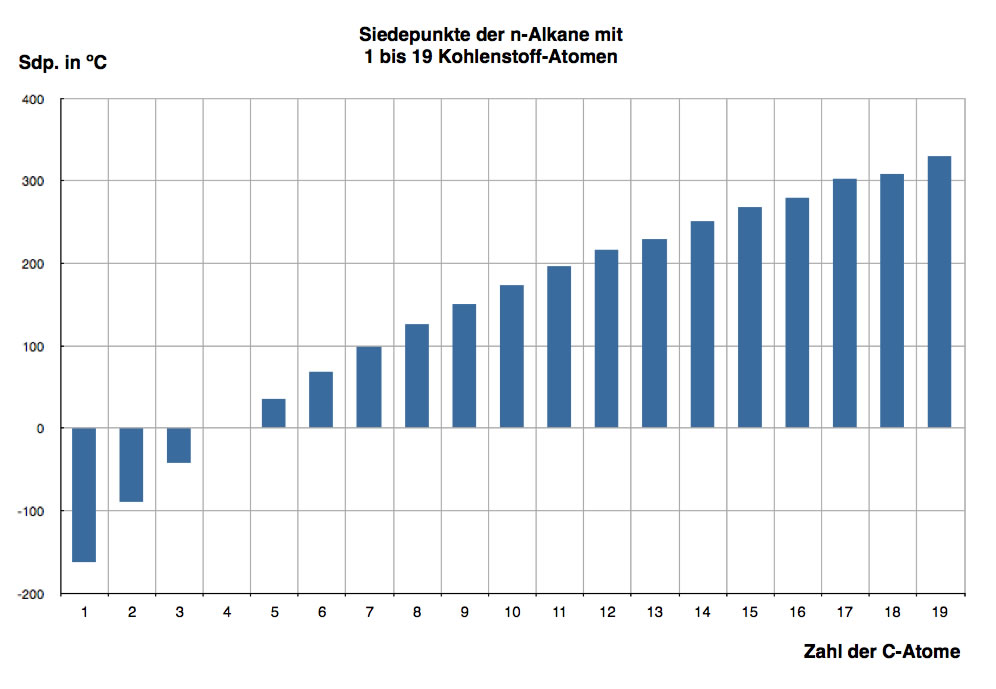
Siedepunkte der n-Alkane mit 1 bis 19 Kohlenstoff-Atomen
Autor: Ulrich Helmich, Lizenz: Public domain
Dass die Siedetemperaturen eines Alkans sehr niedrig sind, sieht man allerdings erst dann, wenn man ein bestimmtes Alkan, beispielsweise Pentan, mit anderen organischen Verbindung ähnlicher Molmasse vergleicht:
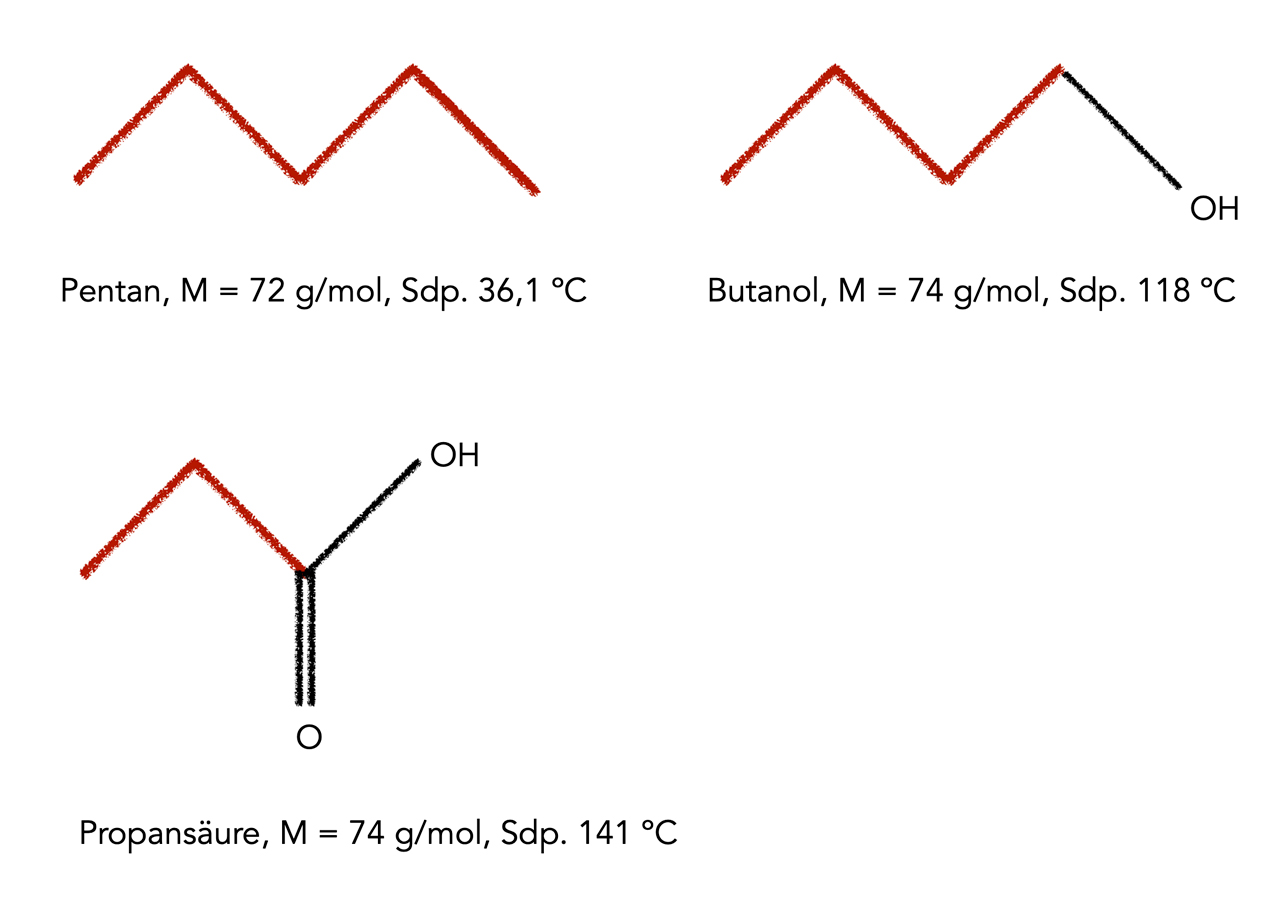
Siedepunkte von drei organischen Verbindungen mit ähnlicher molarer Masse
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Butanol ist ein Butan-Molekül, bei dem ein H-Atom durch eine OH-Gruppe ersetzt wurde. Butanol gehört damit zur Stoffklasse der Alkohole. Obwohl die molare Masse von Butanol nur unwesentlich höher ist als die von Butan, ist der Siedepunkt wesentlich höher, er liegt nämlich bei 118 ºC. Und die Propansäure mit nur drei C-Atomen (aber zwei O-Atomen), hat einen noch höheren Siedepunkt von 141 ºC. Sie sehen an diesem Beispiel also, wie niedrig der Siedepunkt eines Alkans im Vergleich mit anderen organischen Verbindungen ist.
Daher stellt sich jetzt die Frage: Woran liegt das eigentlich?
Dazu müssen wir erst noch einen kleinen Schritt zurückgehen: Was heißt eigentlich "Sieden"?
Sieden
Beim Sieden oder "Kochen" gehen die Teilchen eines flüssigen Stoffes in den gasförmigen Zustand über. Um diesen Übergang zu ermöglichen, ist eine gewisse Energiezufuhr notwendig. Warum ist das der Fall? Die Teilchen des flüssigen Stoffes ziehen sich gegenseitig an. Intermolekulare Kräfte nennt man diese Anziehungskräfte.
Intermolekulare Kräfte
Es gibt drei Typen dieser intermolekularen Anziehungskräfte, die unterschiedlich stark sind. Am schwächsten sind die sogenannten van der Waals-Kräfte, etwas stärker sind die Dipol-Dipol-Kräfte, und am stärksten sind die Wasserstoffbrücken-Bindungen. Bei den Alkanen, Alkenen und Alkinen wirken aber nur die schwächsten dieser Kräfte, also die van der Waals-Kräfte.
Auf dieser weiterführenden Seite wird Ihnen genau erklärt, was man unter diesen Wechselwirkungen versteht und wie sie zustande kommen.
Beim Sieden müssen diese intermolekularen Kräfte überwunden werden. Da Alkan-Moleküle nur durch schwache intermolekulare zusammengehalten werden, sind die Siedepunkte im Vergleich zu anderen Verbindungen sehr klein.
Frage: Warum aber nehmen die Siedepunkte der Alkane mit steigender Kettenlänge kontinuierlich zu?
Anwort: Die Antwort auf diese wichtige Frage liefert folgendes Bild:
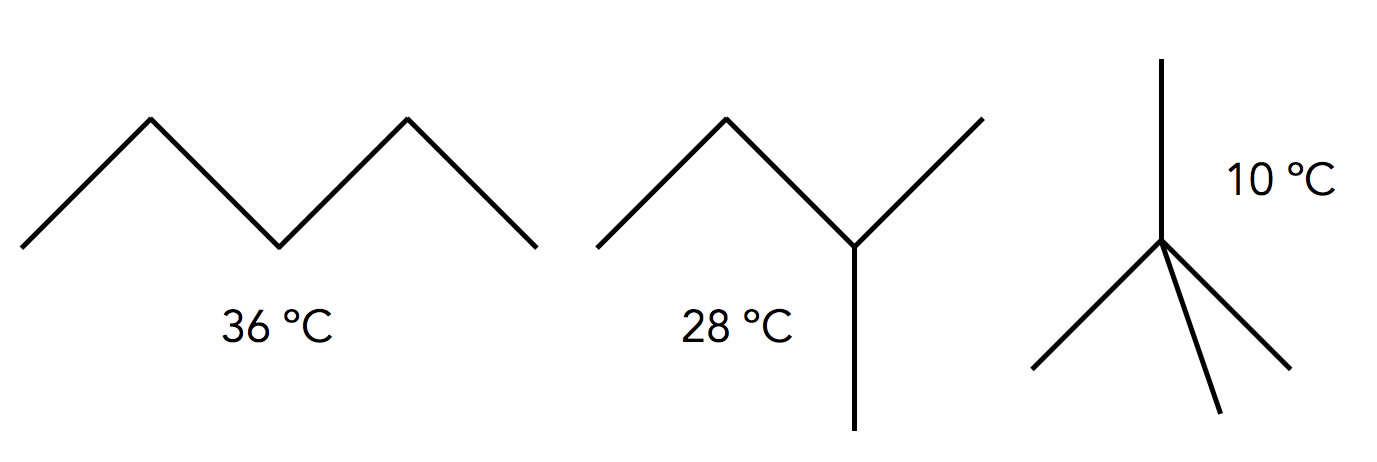
Die Siedetemperaturen von drei Pentan-Isomeren
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Wir sehen hier drei Isomere des Pentans. Als Isomere bezeichnet man Verbindungen mit der gleichen Summenformel (hier also C5H12), aber unterschiedlichen Strukturformeln.
Warum haben diese drei Isomere trotz gleicher molarer Masse so unterschiedliche Siedepunkte? Sollte das an der Gestalt der Moleküle liegen?
An diesem Beispiel kann man ganz klar die Bedeutung der Kontaktfläche für den Siedepunkt einer Verbindung erkennen: Je größer die Kontaktfläche zwischen den Molekülen der Verbindung, desto stärker die van-der-Waals-Kräfte, und um so höher der Siedepunkt.
Das langgestreckte n-Pentan hat - wegen seiner Länge - eine große Kontaktfläche mit anderen n-Pentan-Molekülen, daher ist sein Siedepunkt mit 36 ºC recht hoch. Das Dimethyl-propan ist fast kugelförmig, die Kontaktfläche zwischen zwei Kugeln ist sehr klein. Das ist der Grund für den relativ niedrigen Siedepunkt von nur 10 ºC. Das Methyl-butan liegt von der Gestalt und der Kontaktfläche zwischen diesen beiden "Extremen", daher hat es einen mittleren Siedepunkt von 28 ºC.
Je verzweigter ein Alkan, desto geringer ist die Kontaktfläche zwischen den Molekülen und desto geringer die intermolekularen Anziehungskräfte. Daher ist auch der Siedepunkt verzweigter Alkane niedriger als der Siedepunkt der langkettigen Isomere.
3.2 Schmelztemperaturen
Die Schmelztemperaturen der Alkane verändern sich nicht so regelmäßig wie die Siedetemperaturen, wie die folgende Tabelle zeigt:
| Alkan | Schmelzpunkt in ºC | Differenz in ºC |
|---|---|---|
| Methan | -183 | |
| Ethan | -172 | +11 |
| Propan | -187 | -15 |
| Butan | -138 | +49 |
| Pentan | -130 | +8 |
| Hexan | -95 | +35 |
| Heptan | -90 | +5 |
| Octan | -57 | +33 |
Zwar nehmen die Schmelzpunkte mit der Kettenlänge zu, aber nicht regelmäßig. Propan hat sogar einen niedrigeren Schmelzpunkt als Ethan, was schon mal bemerkenswert ist.
Hier eine graphische Darstellung der Schmelzpunkte in Abhängigkeit von der Zahl der C-Atome bei Alkanen mit bis zu 25 C-Atomen:
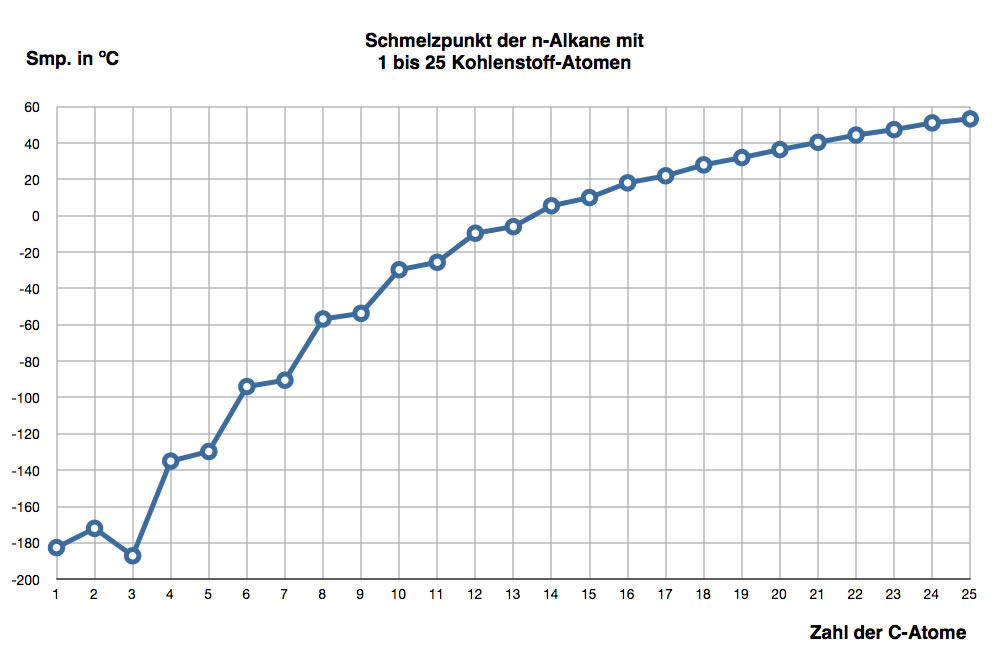
Schmelzpunkte der n-Alkane mit 1 bis 19 Kohlenstoff-Atomen
Autor: Ulrich Helmich 2017, Lizenz: Public domain
Die Unregelmäßigkeit in der Zunahme der Schmelztemperaturen liegt vermutlich daran, dass feste Alkane Kristallgitter bilden.
In einem Kristall mit C4-, C6-, C8- etc. Alkanen scheint die Kontaktfläche zwischen den Molekülen größer zu sein als in Kristallen mit C3-, C5-, C7- etc. Alkanen.
Je länger die C-Ketten der Alkane werden, desto unerheblicher werden diese Unterschiede allerdings.
3.3 Viskosität
Unter der Viskosität versteht man so etwas wie "Zähflüssigkeit". Honig hat zum Beispiel eine sehr hohe Viskosität, die Viskosität von Wasser empfindet man als "normal", und Stoffe wie Benzin, Ether etc. haben eine geringe Viskosität.
Man kann die Viskosität eines Stoffes quantitativ ermitteln, indem man beispielsweise 50 ml der Flüssigkeit in eine Bürette gibt, die Bürette unten mit einem engen Glasrohr verschließt und dann die Zeit misst, die erforderlich ist, bis der Inhalt der Bürette ausgelaufen ist. Bei dünnflüssigem Honig würde das vielleicht 50 Sekunden dauern, bei Wasser vielleicht 10 Sekunden, und bei Pentan dann vielleicht 6 oder 7 Sekunden.
Alkane haben allgemein eine geringe Viskosität, zumindest wenn man die Zahl der C-Atome berücksichtig. Klar, ein Alkan mit 30 C-Atomen hat natürlich eine recht hohe Viskosität, aber andere organische Verbindungen mit der gleichen Anzahl von C-Atomen haben eine noch viel höhere Viskosität. Die geringe Viskosität der Alkane hängt natürlich ebenfalls mit den geringen Anziehungskräften zwischen den Alkan-Molekülen zusammen.
Zu diesem Thema gibt es ein tolles YouTube-Video, dass Sie sich auf jeden Fall ansehen sollten!
3.4 Dichte
Das spezifische Gewicht der flüssigen Alkane wie Pentan, Hexan und Heptan liegt unter dem Wert 1,0 g/cm3, wie er ja für Wasser gültig ist. Die Abstände zwischen den Alkan-Molekülen sind größer, so dass nicht so viele Alkan-Moleküle in ein bestimmtes Volumen hineinpassen. Die Ursache hierfür - Sie haben es sich bestimmt schon gedacht - sind wieder die geringen Anziehungskräfte zwischen den Alkan-Molekülen.
3.5 Wasserlöslichkeit
Viele Stoffe lösen sich gut bis sehr gut in Wasser. Das liegt daran, dass die Moleküle dieser Stoffe Wasserstoffbrücken-Bindungen mit den H2O-Molekülen bilden können. Die Ionen von Salzen wie NaCl bilden Hydrathüllen, wenn sie im Wasser gelöst vorliegen.
Alkan-Moleküle sind dazu nicht in der Lage, sie bilden weder Wasserstoffbrücken-Bindungen zu H2O-Molekülen aus, noch können Sie Hydrathüllen bilden. Ein Alkan-Molekül besitzt keine elektrischen Ladungen, die in der Lage wären, Wasser-Moleküle zu binden. Auch sind keine polaren Gruppen in einem Alkan vorhanden, die Wasserstoffbrücken-Bindungen mit Wasser-Molekülen eingehen könnten. Daher können sich Alkane nur in Flüssigkeiten lösen, die ebenfalls völlig unpolar sind, zum Beispiel anderen Alkanen, Ethern und ähnlichen Verbindungen ("Gleiches löst sich nur in Gleichem").
"Gleiches löst sich nur in Gleichem" ist ein altes chemisches Prinzip, das besagt, dass Substanzen am besten in Lösungsmitteln löslich sind, die ähnlich sind wie sie selbst.
Beziehungen zwischen Struktur und Eigenschaften
Das Struktur-Eigenschafts-Konzept ist eines der fünf Basiskonzepte der Chemie. Auch an den physikalischen Eigenschaften der Alkane lässt sich dieses wichtige Konzept aufzeigen. Dazu betrachten wir einmal das folgende Schema:
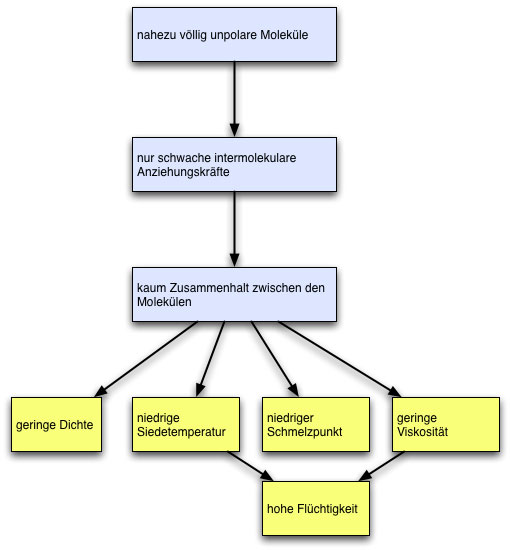
Beziehungen zwischen Struktur und Eigenschaften bei den Alkanen
Autor: Ulrich Helmich 2017. Lizenz: Public domain
Alkane sind nahezu völlig unpolare Moleküle, daraus resultieren nur sehr schwache intermolekulare Anziehungskräfte, so dass kaum ein Zusammenhalt zwischen den Molekülen besteht. Daraus folgen dann die bekannten Eigenschaften der Alkane, die bereits weiter oben auf dieser Seite erörtert worden sind: geringe Dichte, niedrige Siedetemperatur, niedrige Schmelztemperatur, geringe Viskosität und - noch nicht erwähnt - eine hohe Flüchtigkeit; flüssige Alkane wie Pentan oder Hexan verdampfen sehr schnell.
Seitenanfang -
Weiter mit der Gewinnung der Alkane...