Inhaltliche Schwerpunkte (Kernlehrplan NRW)
- Eigenschaften ausgewählter Stoffklassen:
Löslichkeit, Schmelztemperatur, Siedetemperatur - intermolekulare Wechselwirkungen
Weitere Schwerpunkte dieser Seite
- London-Kräfte
- H-Brücken
In dem oben verlinkten YouTube-Video von Ramona Reinhart wird der Zusammenhang zwischen den Siedepunkten der Alkane und der Länge der Kohlenstoffkette sehr anschaulich erklärt.
Die Siedepunkte
Die folgende Abbildung zeigt die Siedetemperaturen der unverzweigten n-Alkane mit 1 bis 19 C-Atomen:

Siedepunkte der n-Alkane mit 1 bis 19 Kohlenstoff-Atomen
Autor: Ulrich Helmich, Lizenz: Public domain
Was man hier auf den ersten Blick klar erkennen kann: Die Siedetemperatur der Alkane hängt von der Kettenlänge ab. Je länger die Kohlenstoffkette, desto höher der Siedepunkt.
Siedepunkte und "van-der-Waals-Kräfte"
Die Moleküle einer organischen Verbindung ziehen sich gegenseitig an. Wäre das nicht der Fall, müssten alle organischen Verbindungen selbst bei niedrigen Temperaturen gasförmig sein.
Alkane sind völlig unpolare Moleküle. Die einzigen Anziehungskräfte, die zwischen den Alkan-Molekülen bestehen, werden in den Schulbüchern als "van-der-Waals-Kräfte" bezeichnet, was auch nicht ganz falsch ist. Eigentlich müsste man hier von London-Kräften ↑Lexikon sprechen, aber den Unterschied hier zu erklären,würde zu weit führen.Mit steigender Kettenlänge werden die Kontaktflächen zwischen den Alkan-Molekülen immer größer, und daher nehmen auch die "van-der-Waals-Kräfte" zu, je mehr C-Atome die Alkan-Moleküle haben. Und je stärker diese intermolekularen Kräfte sind, desto schwerer sind die Moleküle zu trennen. Und genau das passiert ja beim Sieden: Die Moleküle der Flüssigkeit werden voneinander getrennt.
Aber die Stärke der intermolekularen Anziehungskräfte hängt nicht nur von der Kettenlänge des Alkans ab, wie das folgende Beispiel zeigt:
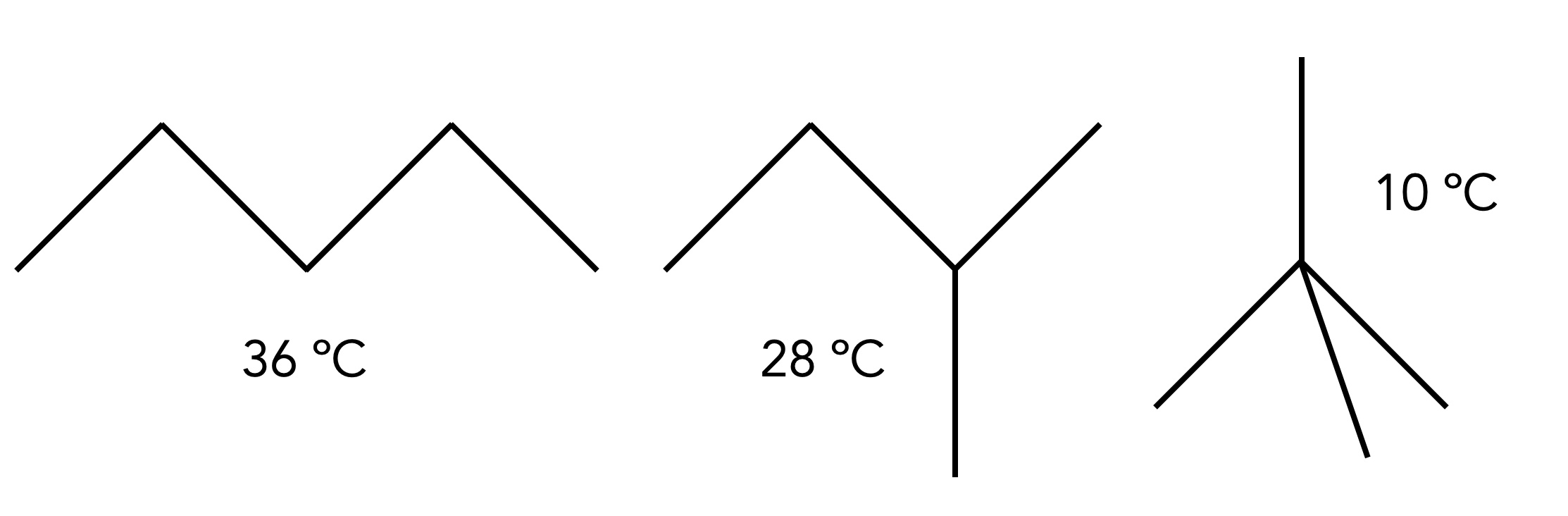
Die Siedepunkt von drei Pentan-Isomeren
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Aufgabe 1
Finden Sie eine Erklärung für die unterschiedlichen Siedetemperaturen der drei abgebildeten Pentan-Isomere n-Pentan, Methylbutan und Dimethylpropan.
Hier geht es zu einem Lösungsvorschlag für diese erste Aufgabe.
Natürlich kann man sich auf ein einziges Beispiel dieser Art nicht verlassen, wenn man eine allgemeine Regel formulieren will. Kommen wir daher gleich zur nächsten Aufgabe. Dazu benötigen Sie allerdings ein internetfähiges Endgerät oder ein sehr ausführliches Chemiebuch.
Aufgabe 2
Recherchieren Sie die Siedetemperaturen der Hexan-Isomere und überprüfen Sie dann, ob die in der Lösung zu Aufgabe 1 formulierte Regel auch für dieses Beispiel zutrifft.
Die Lösung für die Aufgabe 2 finden Sie auf dieser Seite.
Allgemein kann man nach Auswertung dieser beiden Aufgaben formulieren:
Siedetemperaturen der Alkane
Die Siedetemperaturen der Alkane hängen von zwei Faktoren ab:
- Je mehr C-Atome das Alkan hat, desto höher ist die Siedetemperatur.
- Je kompakter die Moleküle der Alkane sind, desto niedriger ist die Siedetemperatur.
van-der-Waals-Kräfte
Die intermolekularen Anziehungskräfte eines Alkans hängen von zwei Faktoren ab:
Kettenlänge: Je mehr C-Atome, desto größer die Kontaktfläche der Moleküle und desto größer die Anziehungskraft zwischen den Molekülen.
Gestalt des Moleküls: Je langgestreckter die Moleküle, desto größer die Kontaktfläche, je kompakter die Moleküle, desto geringer die Kontaktfläche und somit die intermolekularen Anziehungskräfte.
Die sogenannten van-der-Waals-Waals-Kräfte ↑Lexikon sind ein Oberbegriff, der drei intermolekulare Wechselwirkungen umfasst: London-Kräfte, Debye-Kräfte und Keesom-Kräfte.
Die Wasserlöslichkeit
Benzin oder Motoröl ist grundsätzlich nicht in Wasser löslich, das weiß eigentlich jeder und jede aus dem Alltag. Benzin, Diesel und Mineralöle bestehen zum Großteil aus Alkanen, daher kann man wohl auch feststellen, dass Alkane nicht wasserlöslich sind.
Aber das kann man ja mit einem einfachen Schulversuch selbst ausprobieren:
Versuch 1
Wasserlöslichkeit von Hexan
Durchführung:
Füllen Sie ein Reagenzglas mit 5 ml Wasser und 5 ml Heptan. Verschließen Sie das Reagenzglas mit einem Stopfen und schütteln Sie den Inhalt kräftig. Lockern Sie zwischendurch gelegentlich den Stopfen, um eventuellen Überdruck abzulassen.
Lassen Sie das Reagenzglas dann für eine Weile ruhig stehen.
Beobachtungen:
Nach dem Schütteln liegt ein milchig aussehendes Stoffgemisch vor. Nach einiger Zeit findet eine Phasentrennung statt, man kann eine ausgeprägte Phasengrenze zwischen einer oberen Schicht und einer unteren Schicht erkennen.
Erklärungen:
Heptan löst sich nicht in Wasser und hat eine geringere Dichte als Wasser. Daher "schwimmt" das Pentan als eigene Phase auf dem Wasser, das ebenfalls eine Phase bildet.
Wasserlöslichkeit und H-Brücken
Alle Alkane sind völlig unlöslich in Wasser, dagegen lösen sie sich gut in vielen anderen organischen Verbindungen. Der Grund für die Wasserunlöslichkeit liegt in den Wasserstoffbrücken-Bindungen↑Lexikon, die die Wasser-Moleküle untereinander eingehen. Diese H-Brücken sind so stark, dass die Wasser-Moleküle keine Alkan-Moleküle zwischen sich lassen. Die Alkan-Moleküle müssen so unter sich bleiben und bilden daher eine eigene Phase, die aufgrund der geringeren Dichte auf dem Wasser schwimmt.
Mit vielen organischen Verbindungen mischen sich Alkane dagegen mühelos, wie der folgende Versuch zeigt:
Versuch 2
Mischbarkeit von Heptan und Öl
Durchführung:
Füllen Sie ein Reagenzglas mit 5 ml Heptan und geben Sie dann ein paar Tropfen Pflanzenöl dazu. Verschließen Sie das Reagenzglas mit einem Stopfen und schütteln Sie den Inhalt kräftig. Lockern Sie zwischendurch gelegentlich den Stopfen, um eventuellen Überdruck abzulassen.
Beobachtungen:
Nach dem Schütteln liegt leicht gelblich aussehende, klare Flüssigkeit vor, die aus nur einer Phase besteht.
Erklärungen:
Pflanzenöl löst sich sehr gut in Heptan, es bildet mit Heptan ein homogenes Stoffgemisch, eine Lösung.
Zum Schluss noch zwei wichtige Fachbegriffe
In den drei Jahren Oberstufe, die noch auf Sie zukommen, werden Sie in den Fächern Chemie, Biologie und Ernährungslehre, manchmal auch in der Physik, mit vier Begriffen konfrontiert, deren Bedeutung Sie auf jeden Fall kennen sollten. Diese Begriffe haben etwas mit dem zu tun, was wir gerade über das Löslichkeitsverhalten der Alkane gelernt haben.
- Hydrophil
- Hydrophob
- Lipophil
- Lipophob
Nehmen wir diese Begriffe kurz einmal auseinander. "Hydro" heißt so viel wie "Wasser", und "Lipo" so viel wie "Fett". Die Silbe "phil" steht für "lieben", die Silbe "phob" für "meiden" oder sogar "hassen".
Eine hydrophile Verbindung ist also eine Verbindung, die das Wasser liebt, sich also problemlos mit Wasser mischen lässt. Alkohol (Ethanol) beispielsweise ist eine solche lipophile Verbindung.
Eine hydrophobe Verbindung dagegen versucht den Kontakt mit Wasser zu vermeiden. Eine solche hydrophobe Verbindung haben wir in Versuch 1 kennengelernt: Heptan mischt sich nicht mit Wasser, sondern die Moleküle bleiben unter sich und bilden eine eigene Phase.
Eine lipophile Verbindung ist eine Fett liebende Verbindung. Im zweiten Versuch haben wir gesehen, dass sich Pflanzenöl "gern" in Heptan löst, Pflanzenöl ist also eine lipophile Substanz (keine Verbindung, sondern ein Stoffgemisch).
Eine lipophobe Verbindung dagegen versucht den Kontakt mit Kohlenwasserstoffen, Ölen und ähnlichen Substanzen zu vermeiden, sondern löst sich viel besser in Wasser und ähnlichen Stoffen.
Hydrophile Stoffe sind meistens gleichzeitig lipophob, und hydrophobe Stoffe sind meistens gleichzeitig lipophil.
Aufgaben
Am Ende noch zwei kleine Aufgaben, die mal in einem Kasten zusammengefasst werden:
Aufgaben 3 und 4
Wie würden Sie einen Fettfleck aus Ihrer Hose entfernen, mit Wasser oder mit Benzin? Begründen Sie!
Es gibt einen alten Chemiker-Spruch: "Ähnliches löst sich in Ähnlichem". Stellen Sie den Bezug zu den beiden Versuchen 1 und 2 her.
Und hier wieder die beiden Lösungen. Auf der Lösungsseite finden Sie auch noch eine wichtige Ergänzung zum hier Gesagten, die Sie sich unbedingt durchlesen sollten.
Wenn Sie Teilnehmer eines Chemie-Leistungskurses sind oder sogar schon Chemie studieren (oder Biologie), dann sollten Sie sich auf jeden Fall diese Seite aus der Studienvorbereitung Chemie ansehen.
Seitenanfang -
Weiter mit den Reaktionen der Alkane (Oxidation, Halogenierung)...