3.1 Rekapitulation: Schulwissen
3.1.1 Siedetemperaturen
Im Vergleich zu anderen organischen Verbindungen haben Alkane sehr niedrige Siedetemperaturen. Dies ist auf die extrem geringe Polarität der C-H-Bindungen zurückzuführen. Alkan-Moleküle werden untereinander nur durch London-Kräfte zusammengehalten, die schwächste Form der van-der-Waals-Kräfte.
In fast jedem Chemiebuch findet man eine Auflistung oder graphische Darstellung der Siedepunkte der n-Alkane, so wie zum Beispiel diese:

Siedepunkte der n-Alkane mit 1 bis 19 Kohlenstoff-Atomen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Interessant an dieser Graphik ist das kontinuierliche Ansteigen der Siedetemperatur innerhalb der homologen Reihe der Alkane. Das n-Butan hat einen Siedepunkt von -0,5 ºC, deshalb ist der entsprechende Balken in der Abbildung nicht zu sehen. Ab Pentan sind die Alkane bei Zimmertemperatur flüssig (Siedetemperatur von Pentan = 36,1 ºC).
Aufgabe
Erklären Sie, wieso die Siedepunkte der Alkane mit zunehmender Kettenlänge ansteigen.
Lösung:
Die van der Waals-Kräfte wirken über die Kontaktflächen zwischen den einzelnen Molekülen. Je größer diese Kontaktfläche, desto stärker diese intermolekularen Kräfte. Und je länger die Kohlenstoff-Kette eines Alkans, desto länger sind die Moleküle und daher auch die Kontaktfläche zwischen den Molekülen:
Zahl der C-Atome → Länge der Moleküle → Kontaktfläche → van der Waals-Kraft → Siedetemperatur
Aufgabe:
Erklären Sie die unterschiedlichen Siedetemperaturen der folgenden drei Pentan-Isomere!
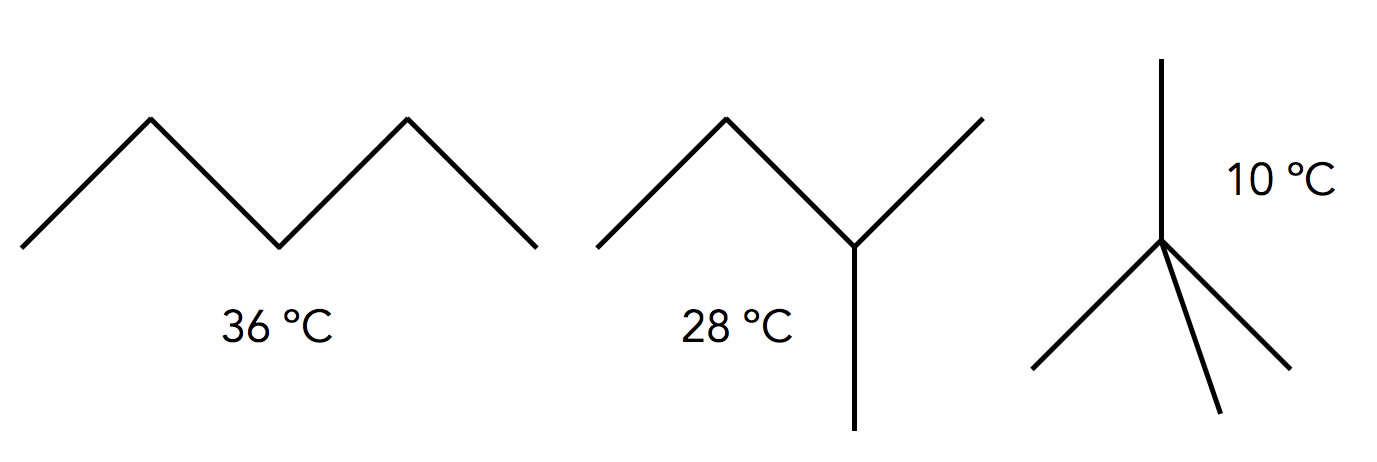
Lösung:
Das 2,2-Dimethyl-propan ganz rechts hat eine fast kugelförmige Gestalt, daher ist die Kontaktfläche zwischen den Molekülen minimal.
Diese minimale Kontaktfläche zwischen den Molekülen hat extrem geringe intermolekulare Anziehungskräfte zur Folge, und die wiederum haben einen sehr niedrigen Siedepunkt zur Folge, weil ja nicht viel Energie aufgewandt werden muss, um diese Anziehungskräfte zu überwinden.
Das langkettige n-Pentan ganz links hat eine große Kontaktfläche mit anderen n-Pentan-Molekülen, die Folge sind hohe zwischenmolekulare Kräfte und somit ein relativ hoher Siedepunkt.
3.2 Vorbereitung auf das Chemie-Studium
2.3.0 Grundlagen
In Alkanen sind die C-C-Bindungen völlig unpolar und die C-H-Bindungen sind nur sehr schwach polar, der EN-Unterschied zwischen C- und H-Atomen ist vernachlässigbar. Alkan-Moleküle sind daher keine Dipole, die intermolekularen Anziehungskräfte im festen und flüssigen Zustand beruhen einzig und allein auf den sehr schwachen London-Kräften (Dispersionskräften).
Diese Kräfte sind umgekehrt proportional der 6. Potenz des Abstandes r: F = k / r6. Daher sind die London-Kräfte nur zwischen direkt benachbarten Molekülen wirksam.
Die London-Kräfte hängen im Westentlichen von der Kontaktfläche zwischen zwei Alkan-Molekülen ab, daher sind diese Anziehungskräfte bei langkettigen Alkanen größer als bei kurzkettigen. Diese Tatsache hat Konsequenzen für verschiedene physikalische Eigenschaften, vor allem für die Siedetemperaturen, die Dichte und die Viskosität. Die Schmelztemperaturen hängen auch von den London-Kräften ab, hier spielt aber die Packungsdichte im festen Kristall noch eine zusätzhliche Rolle. Bei der Wasserlöslichkeit wiederum sind andere Faktoren zu berücksichtigen, vor allem das H-Brücken-Netzwerk zwischen den Wasser-Molekülen.
3.2.1 Schmelztemperaturen
Interessanter als die Siedepunkte sind die Schmelzpunkte der Alkane - dieser werden meistens nicht in der Schule behandelt. Man sollte doch meinen, dass die Schmelzpunkte mit der Kettenlänge kontinuierlich ansteigen, analog zu den Siedepunkten. Das ist aber nicht durchgehend der Fall, wie die folgende Abbildung zeigt:
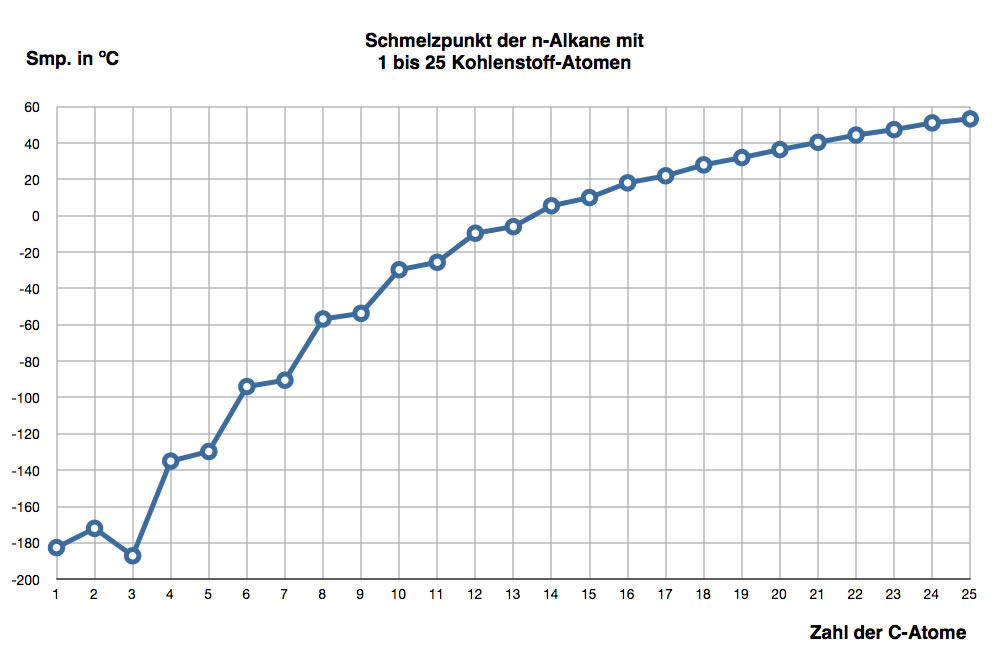
Schmelzpunkte der n-Alkane mit 1 bis 19 Kohlenstoff-Atomen
Autor: Ulrich Helmich, Lizenz: Public domain
Achten Sie auf das Ethan (2) und das Propan (3) ganz links in der Graphik. Propan besitzt einen niedrigeren Schmelzpunkt als Ethan – ein Ergebnis, das man aufgrund der größeren Molekülmasse und Kettenlänge zunächst nicht erwarten würde.
Diese Unregelmäßigkeit im Verlauf der Schmelztemperaturen hängt mit der Kristallstruktur fester Alkane zusammen. n-Alkane bilden im festen Zustand Kristallgitter, deren Packungsdichte davon abhängt, ob die Kohlenstoffkette eine gerade oder ungerade Anzahl von C-Atomen besitzt. Alkane mit geradzahliger C-Atomzahl lassen sich dichter packen als solche mit ungeradzahliger C-Atomzahl, was zu stärkeren zwischenmolekularen Wechselwirkungen und damit zu höheren Schmelzpunkten führt.
Je länger die C-Ketten der Alkane werden, desto unerheblicher werden diese Unterschiede allerdings.
Der Odd-Even-Effekt bei n-Alkanen
n-Alkane liegen im festen Zustand bevorzugt in einer gestreckten Zickzack-Konformation vor. Dabei ist entscheidend, wie die beiden endständigen Methyl-Gruppen räumlich zueinander orientiert sind.
Bei geradzahligen n-Alkanen wie Ethan, Butan, Hexan und so weiter zeigen die beiden endständigen Methyl-Gruppen in entgegengesetzte Richtungen, wenn das Molekül in seiner langgestreckten Form vorliegt. Dadurch besitzen diese Moleküle eine ziemlich symmetrische Gestalt.
Bei ungeradzahligen n-Alkanen wie Propan, Pentan und Heptan zeigen die endständigen Methyl-Gruppen in die gleiche Richtung. Dadurch wirkt das Molekül asymmetrischer, was im Kristallgitter eine regelmäßige Stapelung erschwert - und somit sind die Anziehungskräfte im festen Zustand leichter zu überwinden → geringe Schmelztemperatur.
Dieses als Odd-Even-Effekt bezeichnete Phänomen wirkt sich um so stärker aus, je kürze die Alkane sind. Mit zunehmender Kettenlänge wächst der Einfluss der gesamten Kontaktfläche, sodass die Unterschiede zwar bestehen bleiben, relativ aber weniger auffallen.
Weitere Einzelheiten: siehe Odd-Even-Effekt in meinem Chemie-Lexikon.
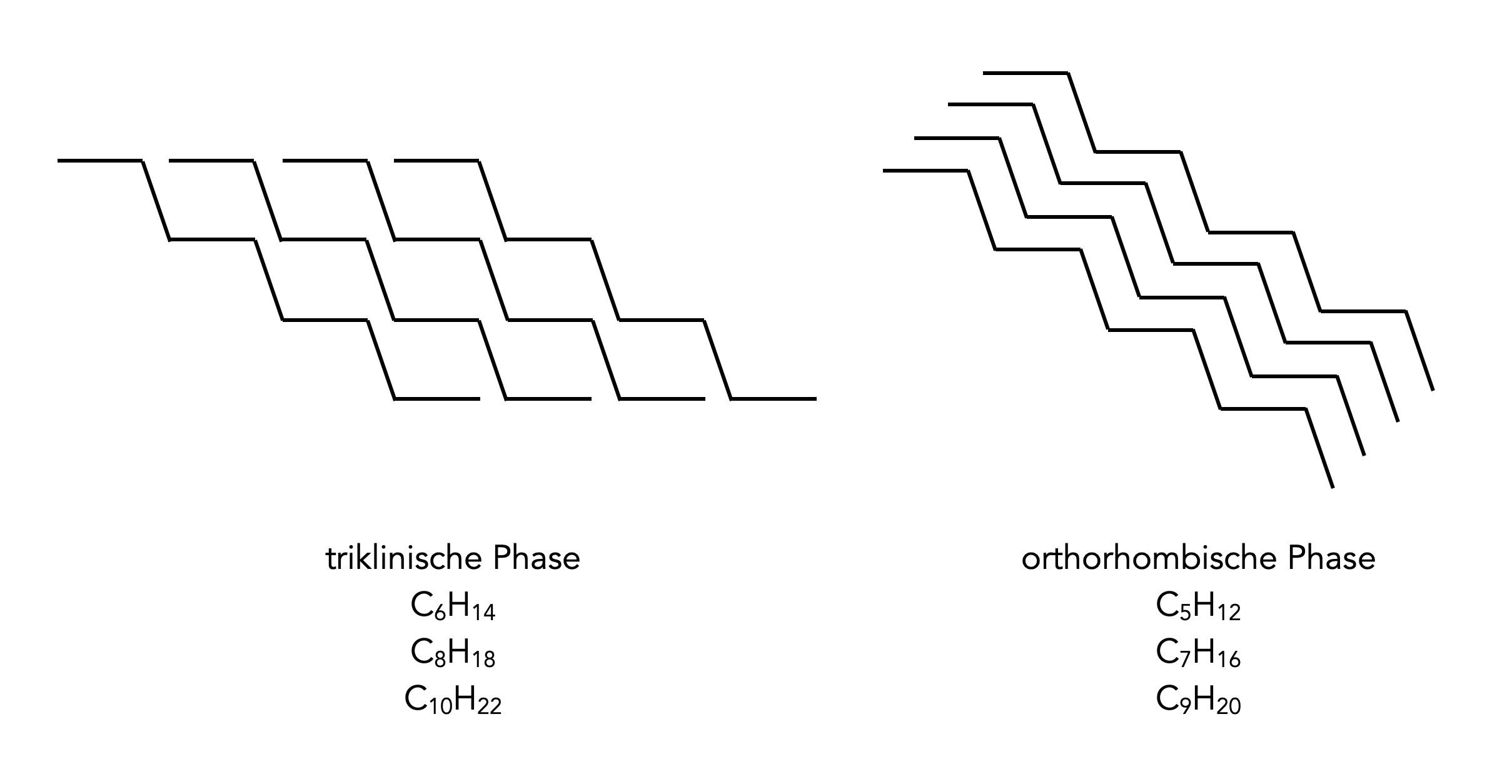
Verschiedene Kristallgitter von Alkanen
Autor: Ulrich Helmich 12/2025, Lizenz: Public domain. Nach einer Abbildung aus der Dissertation von Inez Marita Weidinger.
Dieses Bild zeigt typische Kristallgitter von geraden und ungeraden Alkanen. Wie man leicht erkennen kann, sind gerade Alkane im festen Zustand nicht so dicht gepackt (triklinische Phase) wie ungerade Alkane (orthorhombische Phase) [6].
Interessant ist die Frage, wie es mit dem Schmelzpunkten verzweigter Alkane aussieht. Bei den Siedepunkten war die Sache ja recht eindeutig: Je verzweigter das Alkan, desto geringer die Kontaktflächen zwischen den Molekülen und desto niedriger die Siedetemperatur. Betrachten wir nun mal die Schmelztemperaturen einiger Alkane näher.
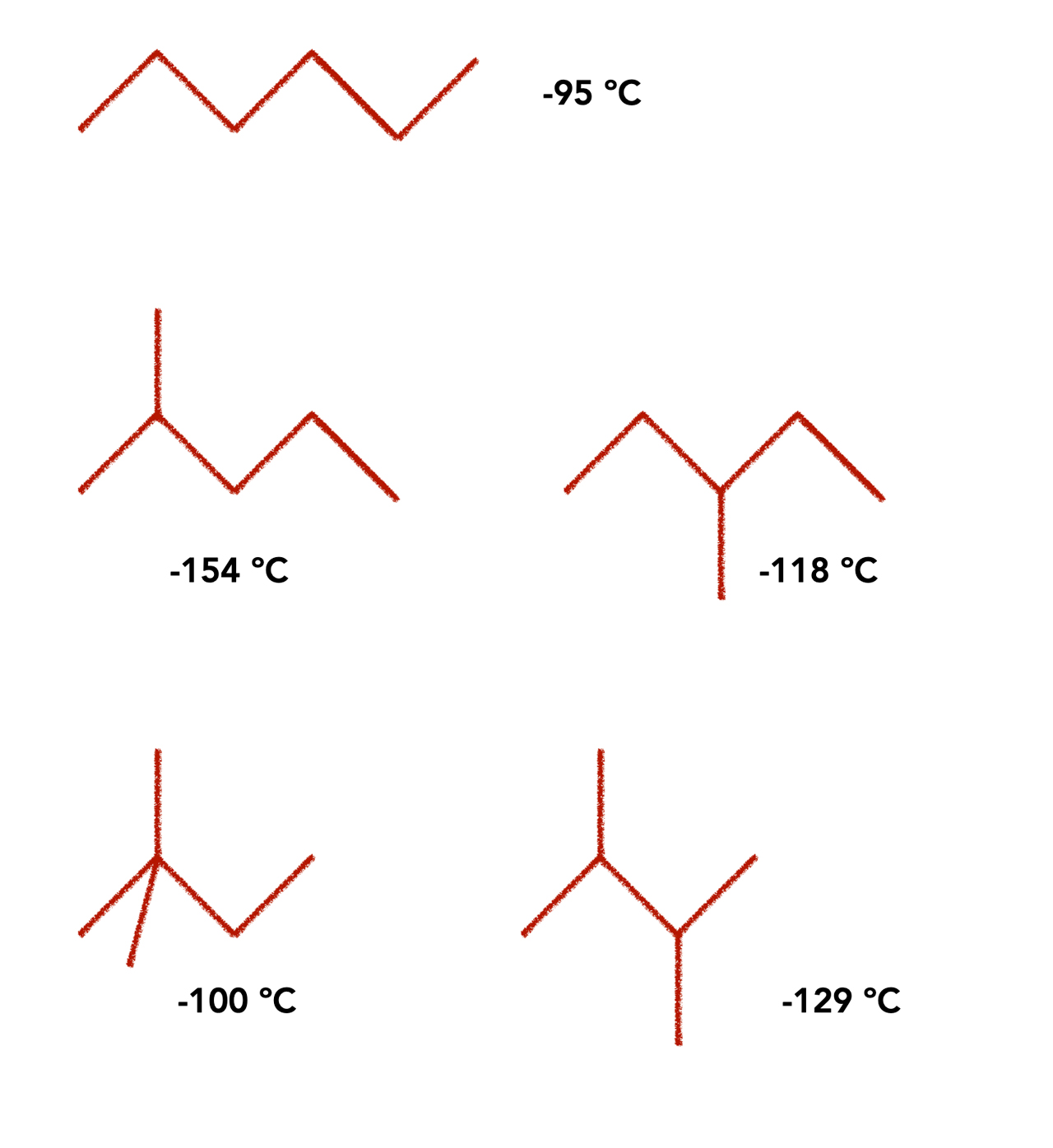
Schmelzpunkte der Hexan-Isomere
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Hier sehen wir die Schmelztemperaturen der fünf Hexan-Isomere. Es ist keineswegs so, dass die Verbindung mit den "kugelförmigsten" Molekülen den niedrigsten Schmelzpunkt hat. Im Gegenteil - das recht langgestreckte 2-Methyl-pentan hat mit -154 ºC den geringsten Schmelzpunkt.
Betrachtet man verzweigte Alkane etwas näher, lassen sich zwei gegenläufige Tendenzen in Bezug auf die Schmelztemperatur erkennen:
Verzweigte Alkane besitzen in der Regel niedrigere Schmelztemperaturen als unverzweigte Alkane mit gleicher Molmasse. Ursache dafür ist die geringere Packungsdichte im Kristallgitter. Langgestreckte Moleküle können sich dichter und regelmäßiger aneinander lagern – vergleichbar mit Ölsardinen in einer Büchse.
Sind verzweigte Alkane jedoch sehr symmetrisch aufgebaut, können sie ebenfalls gut geordnete Kristallgitter ausbilden. Solche Alkane weisen daher trotz ihrer Verzweigung relativ hohe Schmelztemperaturen auf.
Carnelley-Regel
Symmetrische, kompakte Isomere schmelzen oft höher, weil sie leichter in ein regelmäßiges Kristallgitter passen.
"Carnelley's rule states 'of two or more isometric compounds, those whose atoms are the more symmetrically and the more compactly arranged melt higher than those in which the atomic arrangement is asymmetrical or in the form of long chains.' " [5]
3.2.2 Viskosität
Allgemeines, Definition, Experimentelles
Unter der Viskosität versteht man vereinfacht die "Zähflüssigkeit" einer Flüssigkeit. Honig besitzt beispielsweise eine sehr hohe Viskosität, Wasser wird als vergleichsweise dünnflüssig empfunden, während Stoffe wie Benzin oder Diethylether eine sehr geringe Viskosität aufweisen.
Die Viskosität eines Stoffes lässt sich auch quantitativ bestimmen. Dazu kann man beispielsweise ein definiertes Volumen (etwa 50 ml) der Flüssigkeit in eine Bürette füllen, deren Auslass durch ein enges Glasrohr begrenzt ist, und die Zeit messen, die benötigt wird, bis die Flüssigkeit vollständig ausgelaufen ist. Bei zähflüssigem Honig kann dieser Vorgang mehrere zehn Sekunden dauern, bei Wasser deutlich kürzer und bei sehr dünnflüssigen Alkanen wie Pentan nur wenige Sekunden. Solche Messungen erlauben zumindest einen anschaulichen Vergleich der Viskositäten verschiedener Flüssigkeiten.
Viskosität und Kettenlänge
Flüssige Alkane besitzen im Vergleich zu vielen anderen bei Raumtemperatur flüssigen organischen Verbindungen eine relativ geringe Viskosität. Mit zunehmender Kettenlänge steigt die Viskosität der n-Alkane jedoch deutlich an. Eine wichtige Ursache hierfür ist die größere Kontaktfläche zwischen den Molekülen, wodurch die London-Wechselwirkungen (Dispersionskräfte) stärker werden. Zusätzlich können lange, unverzweigte Alkanketten beim Fließen stärker miteinander wechselwirken.
Viskosität und Verzweigungsgrad
Betrachtet man stark verzweigte Alkane, könnte man zunächst vermuten, dass diese Moleküle sich aufgrund ihrer unregelmäßigen Form stärker "verhaken" und daher eine höhere Viskosität aufweisen. Tatsächlich ist jedoch das Gegenteil der Fall.
Lange, unverzweigte Alkanketten können sich beim Fließen vergleichsweise leicht ineinander schieben und gegenseitig behindern. Hier tritt tatsächlich ein Verhakungseffekt auf, der dazu führt, dass sich die Moleküle nur schwer gegeneinander verschieben lassen und die innere Reibung zunimmt.
Verzweigte Alkane sind bei gleicher molarer Masse dagegen in der Regel weniger viskos als ihre unverzweigten Isomere. Dieser Effekt ist eng verwandt mit den Unterschieden in den Siedepunkten. Moleküle mit einer kompakteren, eher kugelförmigen Gestalt besitzen eine kleinere effektive Kontaktfläche als langgestreckte Moleküle. Dadurch sind die London-Wechselwirkungen schwächer ausgeprägt, und die Moleküle können sich leichter gegeneinander bewegen. Die Folge ist eine geringere innere Reibung und damit eine niedrigere Viskosität.
Einfluss der Temperatur
Mit steigender Temperatur nimmt die Viskosität von Alkanen ab. Die zunehmende thermische Bewegung der Moleküle erleichtert deren gegenseitiges Verschieben und schwächt den Einfluss der London-Wechselwirkungen, sodass der Fließwiderstand der Flüssigkeit sinkt.
Auf dieser Lexikonseite finden Sie weitere Informationen, auch zur Viskosität anderer Stoffgruppen.
3.2.3 Dichte
Für bei Zimmertemperatur flüssige Alkane liegt die Dichte unter Normalbedingungen stets unter der von Wasser (1,0 g/cm3). Typische Dichtewerte liegen – abhängig von Kettenlänge und Temperatur – im Bereich von etwa 0,60 bis 0,80 g/cm3. Flüssige Alkane schwimmen daher auf dem Wasser, was auch praktische Bedeutung beispielsweise bei Ölunfällen oder in der Trenntechnik hat.
Ursachen der geringen Dichte
Auch die geringe Dichte der Alkane hat ihre Ursache in der Unpolarität der Moleküle, zwischen denen ausschließlich London-Kräfte wirken. Das hat dann zur Folge, dass die Moleküle im flüssigen Zustand weniger stark aneinander gebunden sind. Daher sind die mittleren Abstände zwischen den Molekülen größer als in vielen anderen organischen Flüssigkeiten wie zum Beispiel Ethanol oder Essigsäure. Große mittlere Abstände führen dann zu einer geringen Dichte.
Verzweigungsgrad und Dichte
Der Verzweigungsgrad von Alkan-Molekülen wirkt sich nicht nur auf die Siedetemperaturen und die Viskosität aus, sondern auch auf die Dichte. Langgestreckte Alkan-Moleküle liegen im flüssigen Zustand enger aneinander als verzweigte und damit kompaktere Moleküle. Allerdings fällt dieser Effekt bei der Dichte nicht so stark ins Gewicht wie bei den Siedetemperaturen oder der Viskosität.
Temperatur und Dichte
Wie bei allen anderen "normalen" Stoffen nimmt auch bei Alkanen die Dichte mit zunehmender Temperatur ab, da sich die Moleküle aufgrund stärkerer thermischer Bewegungen weiter voneinander entfernen. Da die Anziehungskräfte zwischen Alkan-Molekülen sowieso schon recht gering sind (nur London-Kräfte), wirkt sich eine steigende Temperatur besonders stark auf die Dichte von Alkanen aus.
Dichte im festen Zustand
Im festen Zustand liegen die Dichten der Alkane ebenfalls unter 1,0 g/cm3. Besonders regelmäßige, gut packende Moleküle können im Festkörper eine höhere Dichte aufweisen als im flüssigen Zustand. Dennoch bleiben auch feste Alkane insgesamt leichter als Wasser.
Übersicht
Dichte von ausgewählten Alkanen in verschiedenen Aggregatzuständen
| Alkan | fest (g/cm3) | flüssig (g/cm3) | gasförmig (g/cm3) |
| Butan | 0,58 | 0,60 | 0,0025 |
| Pentan | 0,65 | 0,63 | 0,0032 |
| Hexan | 0,72 | 0,66 | 0,0039 |
| Heptan | 0,75 | 0,68 | 0,0045 |
Die Dichten fester und flüssiger Alkane ähneln sich recht stark, meistens haben die festen Alkane aber eine etwas höhere Dichte als die flüssigen. Die gasförmigen Alkane haben eine 100 bis 300 mal geringere Dichte als die entsprechenden flüssigen Alkane.
3.2.4 Wasserlöslichkeit
Unpolare Moleküle wie Alkane sind in Wasser praktisch unlöslich. Die Ursache dafür liegt in der besonderen Struktur und den intermolekularen Wechselwirkungen des Wassers.
Das H-Brücken-Netzwerk des Wassers
Wasser-Moleküle sind untereinander durch ein dichtes Netzwerk von Wasserstoffbrücken-Bindungen verknüpft. Diese Bindungen gehören zu den stärksten intermolekularen Anziehungskräften und stabilisieren den flüssigen Zustand des Wassers energetisch sehr stark. Dieses Wasserstoffbrücken-Netzwerk wird daher bevorzugt aufrechterhalten.
Teilchen, die sich in Wasser lösen sollen, müssen dieses Netzwerk zumindest lokal stören oder umorganisieren können. Ionen wie Na+ oder Cl
Alkan-Moleküle sind dagegen unpolar und besitzen weder elektrische Ladungen noch ein nennenswertes Dipolmoment. Sie können keine Wasserstoffbrücken ausbilden und keine Hydrathüllen bilden. Eine Wechselwirkung mit dem Wasserstoffbrücken-Netzwerk des Wassers ist daher energetisch ungünstig.
Hydrophober Effekt
Stattdessen tritt der sogenannte hydrophobe Effekt auf: Wasser-Moleküle ordnen sich in der Umgebung unpolarer Teilchen stärker und regelmäßiger an, um möglichst viele Wasserstoffbrücken untereinander aufrechtzuerhalten. Diese erhöhte Ordnung ist ungünstig, wenn man den Entropie-Faktor betrachtet. Wenn sich mehrere Alkan-Moleküle zusammenschließen, wird die insgesamt benetzte Oberfläche verkleinert, und die Zahl der stark geordneten Wasser-Moleküle nimmt ab. Dadurch steigt die Entropie/Unordnung des Systems, was energetisch recht günstig ist.
Aus diesem Grund bleiben sowohl die Wasser-Moleküle als auch die Alkan-Moleküle bevorzugt unter sich. Es kommt zur Phasentrennung: Die Alkane bilden zunächst feine Tröpfchen, die sich mit der Zeit zu einer zusammenhängenden organischen Phase vereinigen. Aufgrund ihrer geringeren Dichte schwimmt diese Phase auf der wässrigen Phase.
Dieses Verhalten lässt sich gut beim Schütteln eines Wasser–Hexan- oder Wasser–Heptan-Gemisches beobachten. Zunächst entsteht eine milchige heterogene Emulsion aus vielen kleinen Alkan-Tröpfchen, die sich bei längerem Stehen wieder entmischt und in zwei klar getrennte Phasen übergeht.
Auf dieser Seite wird genauer erklärt, warum sich unpolare Substanzen wie Alkane nicht in Wasser lösen können.
3.3 Übungen
Die Lösungen dieser Aufgaben und der Aufgaben der Kapitel 2 und 3 (Cycloalkane, Alkene) können Sie gegen eine Kostenbeteiligung von 5 Euro über Paypal als PDF-Datei von mir erhalten (einfach auf den Spenden-Button klicken und als Verwendungszweck "Lösungen Organik 1-3" angeben).
Aufgabe 3.1**
Ordnen Sie folgende Alkane aufsteigend nach ihrem Siedepunkt, ohne vorher zu recherchieren:
- n-Pentan
- 2-Methylbutan
- 2,2-Dimethylpropan
- Propan
- n-Heptan
- 3,3-Dimethylpentan
Aufgabe 3.2***
Die neun Heptan-Isomere haben folgende Siedepunkte (Angaben aus der Wikipedia):
- n-Heptan: 98 ºC,
- 2-Methyl-hexan: 90 ºC,
- 3-Methyl-hexan: 92 ºC,
- 2,2-Dimethyl-pentan: 79 ºC,
- 2,3-Dimethyl-pentan: 90 ºC,
- 2,4-Dimethyl-pentan: 80 ºC,
- 3,3-Dimethyl-pentan: 86 ºC,
- 3-Ethyl-pentan: 93 ºC
- 2,2,3-Trimethyl-butan: 81 ºC
a) Zeichnen Sie die neun Strukturformeln (Skelett-Schreibweise),
b) diskutieren Sie dann, inwiefern sich die unterschiedlichen Siedepunkte der Heptan-Isomere mit der Kontaktflächen-Hypothese vereinbaren lassen (langgestreckte Moleküle haben höhere Siedepunkte als kompakt gestaltete Isomere).
Quellen
- Vollhardt, K. P. C.; Schore, N. E.: Organische Chemie. 6. Auflage. Weinheim: Wiley-VCH, 2020.
- Morrison, R. T.; Boyd, R. N.; Bhattacharjee, S. K.: Organic Chemistry. 7. Auflage. London: Dorling Kindersley, 2011.
- Clayden, J.; Greeves, N.; Warren, S.: Organische Chemie. Berlin: Springer Spektrum, 2013.
- Buddrus, J.; Schmidt, B.: Grundlagen der Organischen Chemie. 5. Auflage. Berlin: De Gruyter, 2014.
- Yalkowsky, S. H.: Carnelley's rule and the prediction of melting point. Journal of Pharmaceutical Sciences 103 (2014), 2629–2634.
- Weidinger, I. M.: Untersuchungen zum Gefrierverhalten Levitierter n-Alkan Mikrotropfen. Dissertation, FU Berlin 2003.
Seitenanfang -
Weiter mit der Konformations-Isomerie der Alkane...