Polypropen bzw. Polypropylen ist der nach Polyethen der zweitwichtigste Kunststoff mit einem Marktanteil von ca. 20%.Polypropen ist fast genau so aufgebaut wie Polyethen, nur dass an jedem zweiten C-Atom eine zusätzliche Methylgruppe hängt.
Eigenschaften
Die Eigenschaften von Polypropen (1951 zum ersten Mal hergestellt) ähneln denen von Polyethen, wegen der zusätzlichen Methylgruppen sind aber Dichte, Schmelzpunkt sowie mechanische Belastbarkeit etwas höher. Polypropen ist bis maximal 100 ºC temperaturbeständig! Als Thermoplast kann Polypropen leicht verformt werden, wenn man es erhitzt.
Verwendung
Ähnlich wie Polyethen wird auch Polypropen vielfältig eingesetzt. Bei der Herstellung von Kunstfasern hat Polypropen einen Anteil von über 30%. Auch bei Verpackungsfolien hat Polypropen einen hohen Marktanteil. Darüber hinaus werden Brillengestelle, Plastik-Boxen, Gartenmöbel, CD-Hüllen und viele andere Gegenstände des Alltags aus Polypropen hergestellt. Manche Autos enthalten bis zu 80 kg Polypropen-Teile, zum Beispiel Stoßstangen oder Formteile für den Innenraum von Autos.
Aus Polypropen können auch Kunstfasern gezogen werden. Aus diesen Fasern werden dann Garne und Gewebe hergestellt.
Synthese
Polypropen wird genau wie Polyethen und viele andere Kunststoffe durch Polymerisation hergestellt; das Monomer für Polypropen ist das Alken Propen. Über 60% des heute hergestellten Propens werden für die Polypropen-Synthese eingesetzt.
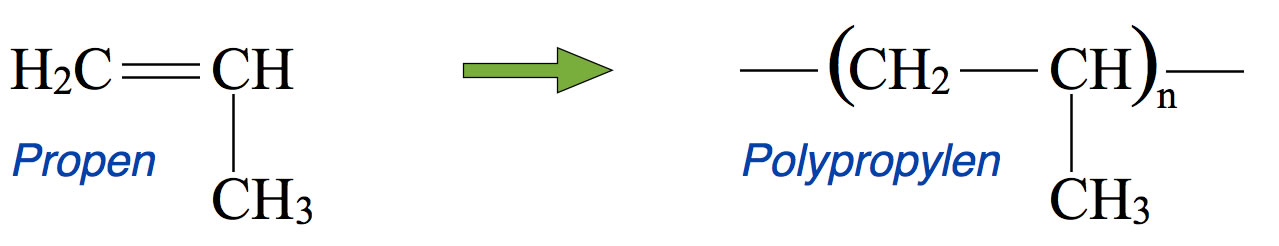
Aus Propen wird Polypropylen
Autor: Ulrich Helmich 2016, Lizenz: Public domain
Es gibt mehrere Verfahren zur Polypropen-Synthese. Früher wurde das Propen-Gas unter hohem Druck auf bis zu 90 Grad Celsius erhitzt. Das radikalische Verfahren führte allerdings zu teilweise verzweigten Polymeren, weil auch aus den Methylgruppen an den Ethen-Einheiten H-Atome abstrahiert werden können.
Ziegler-Natta-Verfahren
Durch Einsatz sogenannter Ziegler-Natta-Katalysatoren kann man die Polymerisation bei tieferen Temperaturen durchführen, und vor allem vermeidet man so Verzweigungen. Allerdings ist dieser Reaktionsmechanismus nicht-radikalisch, sondern etwas komplexer.
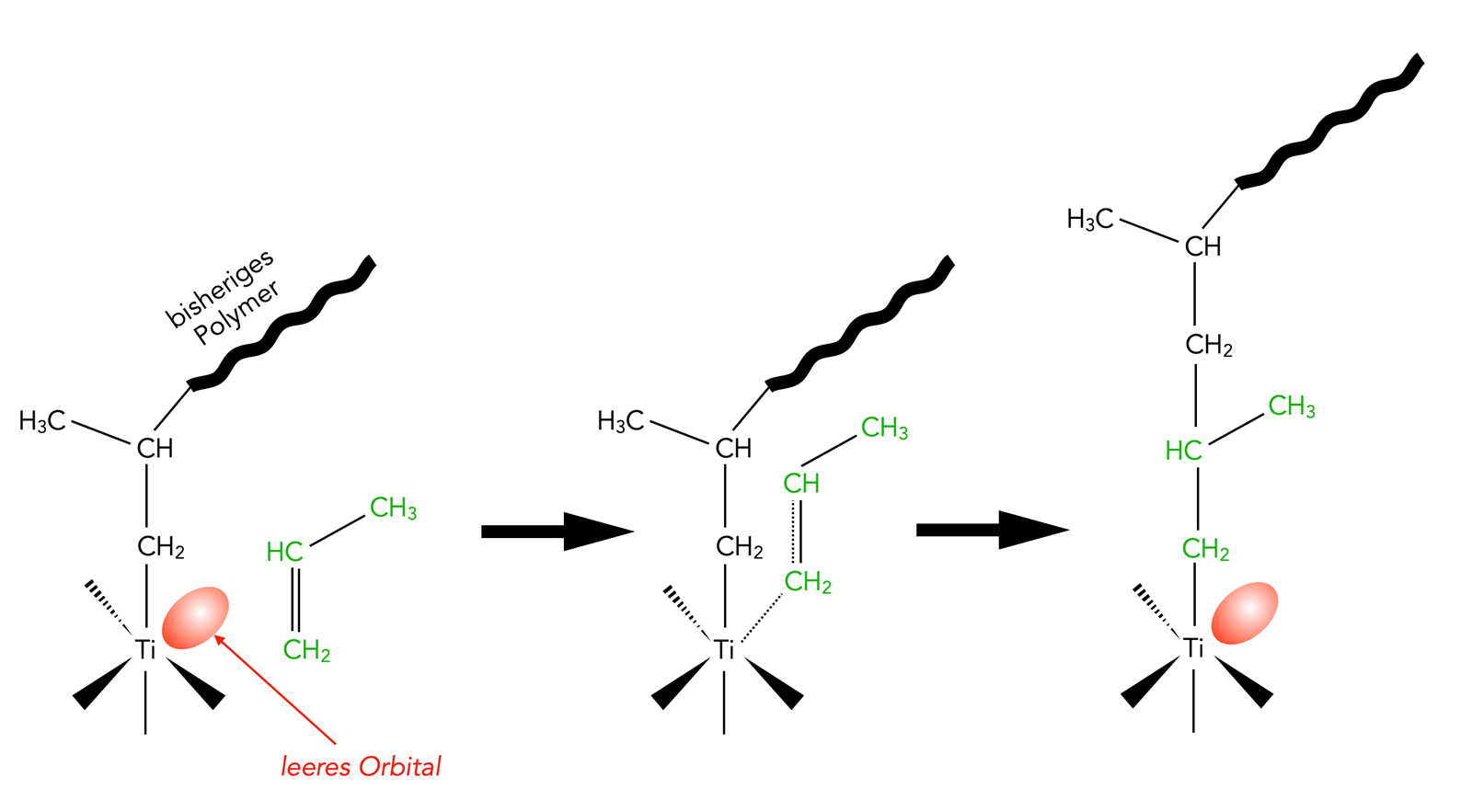
Grundprinzip des Ziegler-Natta-Verfahrens zur Herstellung von Polypropylen
Autor: Ulrich Helmich 7/2023, Lizenz: Public domain
Das obige Bild zeigt, wie man Polypropen bei niedrigen Temperaturen nach dem Ziegler-Natta-Verfahren herstellt. Das Bild ist nach einer Abbildung aus dem Morrison/Boyd sowie einem Bild in der Wikipedia erstellt worden.
Der Katalysator enthält ein Schwermetall wie Titan mit einem unbesetzten Orbital (ist also eine Lewis-Säure). Die pi-Elektronen der C=C-Doppelbindung eines Propen-Moleküls überlappen nun mit diesem Orbital. Die weiteren Schritte werden in der Fachliteratur meistens mit Hilfe des Orbitalmodells dargestellt, was hier zu weit führen würde.
Sowohl das bindende pi-Orbital der Doppelbindung wie auch die nicht-bindende pi*-Orbital überlappen mit Orbitalen des Schwermetalls. Dies zu erklären würde auf dieser Seite, die für den gymnasialen Oberstufenunterricht gedacht ist, zu weit führen. Ich möchte aber auf die hervorragende Präsentation von Dennis Weber der FH Münster verweisen, in der die Ziegler-Natta-Katalysatoren sehr schön erklärt werden. Allerdings werden auch hier erweiterte Kenntnisse des Orbitalmodells vorausgesetzt.
Jedenfalls "schiebt" sich im Endeffekt das Propen-Molekül zwischen das Titan-Atom und das bisherige Polymer.
"The ethylene unit inserts itself between metal and the ethyl group." [1, S. 1131]
Gegenüber der radikalischen Polymerisation hat die Polymerisation mit Ziegler-Natta-Katalysatoren mehrere Vorteile[1, S. 1131]:
- Die Reaktion läuft bei niedrigen Temperaturen ab.
- Es entstehen längere Ketten.
- Die Ketten sind garantiert unverzweigt.
- Die Reaktion erlaubt stereochemische Kontrolle.
- Die Kettenlänge kann exakt bestimmt werden.
Die Tatsache, dass die Polypropen-Ketten nach dem Ziegler-Natta-Verfahren unverzweigt sind, hat eine höhere Packungsdichte des Polymers zur Folge. Das Produkt ist stabiler und mechanisch stärker belastbar als das nach einem radikalischen Mechanismus hergestellte Polypropen.
Durch Zugabe bestimmter Chemikalien kann die Polymerisation gezielt abgebrochen werden, das Polymer trennt sich dann von dem Katalysator, und dieser steht für eine neue "Runde" zur Verfügung.
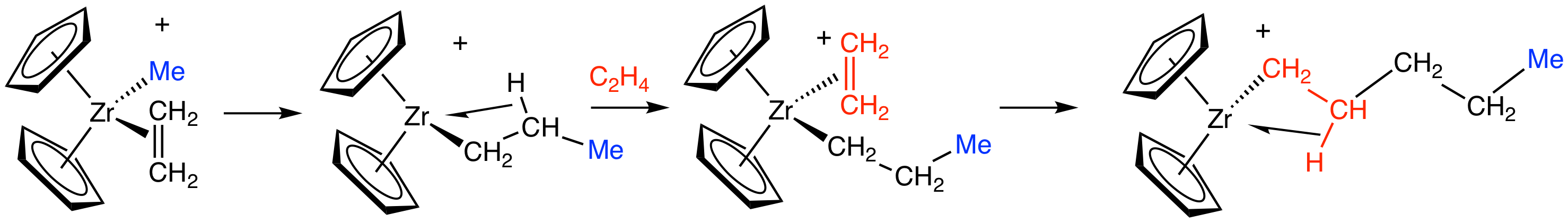
Vereinfachte Darstellung der Ethen-Polymerisation nach dem Ziegler-Natta-Verfahren
Smokefoot, CC BY-SA 4.0, via Wikimedia Commons
Dieses Bild aus der engl. Wikipedia zeigt die Polyethen-Synthese mit einem anderen Ziegler-Natta-Katalysator. Hier ist nicht Titan, sondern Zirkonium das "aktive Zentrum" des Katalysators.
Copolymere
Mischt man dem Propen etwas Ethen bei, erhält man ein Copolymer, in dem sich Propen- und Ethen-Monomere statistisch (unregelmäßig) abwechseln. Einweg-Trinkbecher und manche Plastikflaschen bestehen aus einem solchen Ethen-Propen-Copolymer.
Quellen:
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Wikipedia, Artikel "Ziegler-Natta-Verfahren"
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.