England - irgendwann um 1910. Ein Forscher namens Rutherford fragt sich: "Ist das Rosinenkuchenmodell meines Physik-Lehrers Thomson eigentlich richtig? Wie könnte man das beweisen?"
Wenn Atome so ähnlich aufgebaut sind, wie das Rosinenkuchenmodell vorhersagt, dann müssten kleinste Teilchen, wenn man sie mit hoher Geschwindigkeit auf eine Schicht solcher Atome schießt, zum größten Teil geradlinig hindurchfliegen. Denn die positive Grundmasse ist nach Thomson relativ locker und leicht durchdringbar, während die Elektronen sehr klein sind und die hindurchfliegenden Teilchen so gut wie nicht beeinflussen dürften.
Also entsann Rutherford einen genialen Versuch. Er verwendete eine Goldfolie, die so dünn war, dass sie nur aus 1000 Atomschichten bestand. Gold ist übrigens das einzige Metall, das man so dünn auswalzen kann.
Jetzt brauchte Rutherford nur noch irgendwelche kleinsten Teilchen, die er mit hoher Geschwindigkeit auf die Goldatome schießen konnte. Er entschied sich für die Alpha-Strahlen, die man gerade entdeckt hatte. Alpha-Strahlen bestehen aus positiv geladenen Helium-Ionen, und vor allem ist alpha-Strahlung radioaktiv und hinterlässt schwarze Flecken auf einem photographischen Film und helle Flecken auf einem Leuchtschirm. Damit konnte man sie also sehr leicht nachweisen.
Rutherford baute dann seine Versuchsapparatur zusammen:
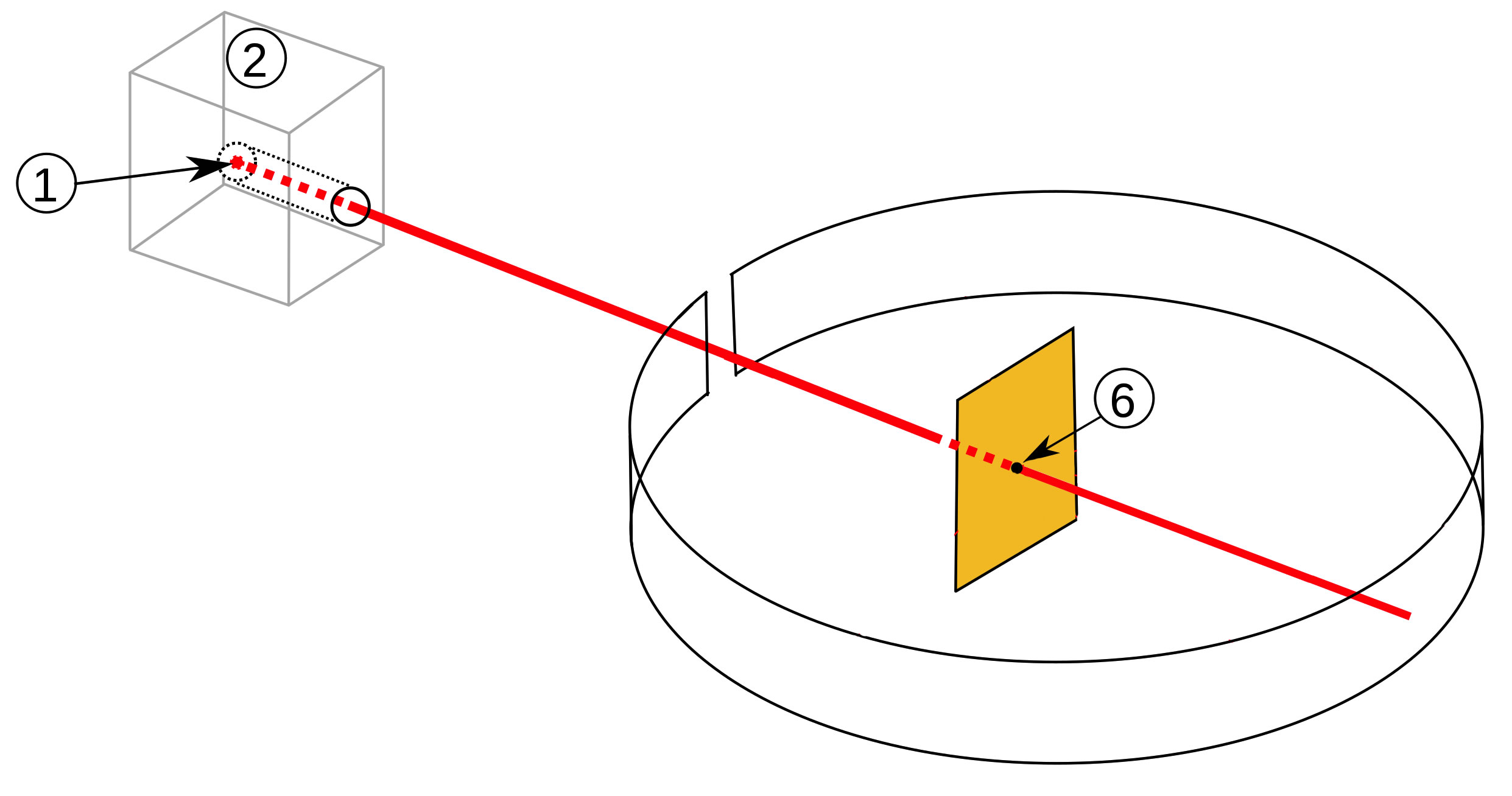
Der Rutherfordsche Streuversuch.
Quelle: Wikipedia. Autor: Sundance Raphael. Modifiziert von: Fujnky. Modifiziert von: Helmich 2021, Lizenz: Public domain.
Links oben im Bild befindet sich ein hohler Bleiwürfel (2) mit einem Stück Radium darin (1). Durch ein kleines Loch in einer Würfelwand kann die Radioaktivität entweichen. Die Strahlung (rot) besteht aus alpha, beta- und gamma-Strahlen.
Rutherford konnte nur die alpha-Strahlung gebrauchen, also filterte er sie heraus. Wie er das machte? Ganz einfach, mit Hilfe eines elektrischen Feldes. Die alpha-Strahlung, die ja aus positiv geladenen Helium-Ionen besteht, wird vom Minuspol angezogen, die beta-Strahlung, die aus negativ geladenen Elektronen besteht, wird vom Pluspol angezogen, und die gamma-Strahlung, die nicht aus Teilchen besteht, wird gar nicht angezogen. So konnte Rutherford die alpha-Strahlung isolieren.
Dann positionierte Rutherford die Goldfolie (6) so, dass sie der alpha-Strahlung ausgesetzt war. Hinter die Goldfolie und auch drumherum platzierte er einen photographischen Film, damit er später nachschauen konnte, wo denn die Strahlung überall einschlug.
Was erwartete Rutherford nun von dem Versuch?
Wenn ein Atom so aufgebaut ist, wie von Thomson postuliert, denn müsste der größte Teil der positiven Strahlung glatt durchgehen:
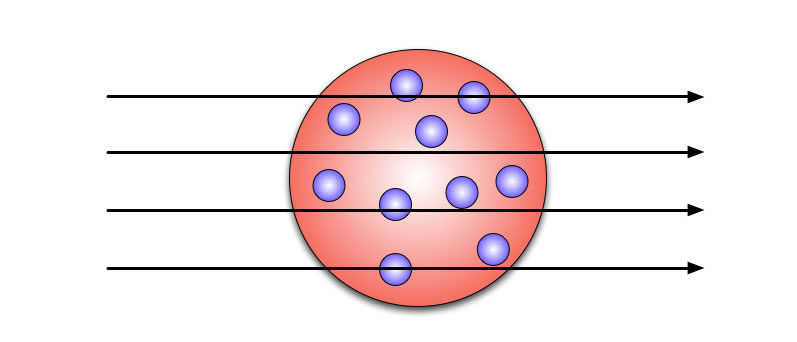
Die alpha-Strahlen sollten ein Gold-Atom ungehindert durchdringen
Die winzigen Elektronen sollten für die alpha-Teilchen kein nennenswertes Hinderniss darstellen, und die "amorphe positive Masse" auch nicht.
Der größte Teil der alpha-Strahlung durchdrang wie erwartet die immerhin 1000 Schichten dicke Goldfolie. Direkt gegenüber dem alpha-Strahler konnte Rutherford die meisten Einschläge in den photographischen Film zählen. Links und rechts daneben auch einige wenige.
Ein paar wenige alpha-Teilchen wurden aber abgelenkt, und ein noch kleinerer Teil wurde sogar direkt reflektiert. Und damit hatte Rutherford nun gar nicht gerechnet. Sein berühmter Ausspruch soll hier zitiert werden:
"Es war fast genau so unglaublich, als ob Sie eine 15-Zoll-Granate gegen ein Stück Seidenpapier abfeuern und sie kommt zurück und trifft Sie".
Das heißt, irgendwo musste etwas in dem Atom sein, was in der Lage ist, positive Teilchen abzulenken oder sogar zu reflektieren. Und dieses "irgendetwas" musste ziemlich massiv sein, denn sonst hätte es die relativ schweren alpha-Teilchen gar nicht ablenken können. Andererseits musste dieses "irgendetwas" auch ziemlich klein sein, denn sonst würden die meisten alpha-Strahlen nicht geradlinig durch die Atome fliegen.
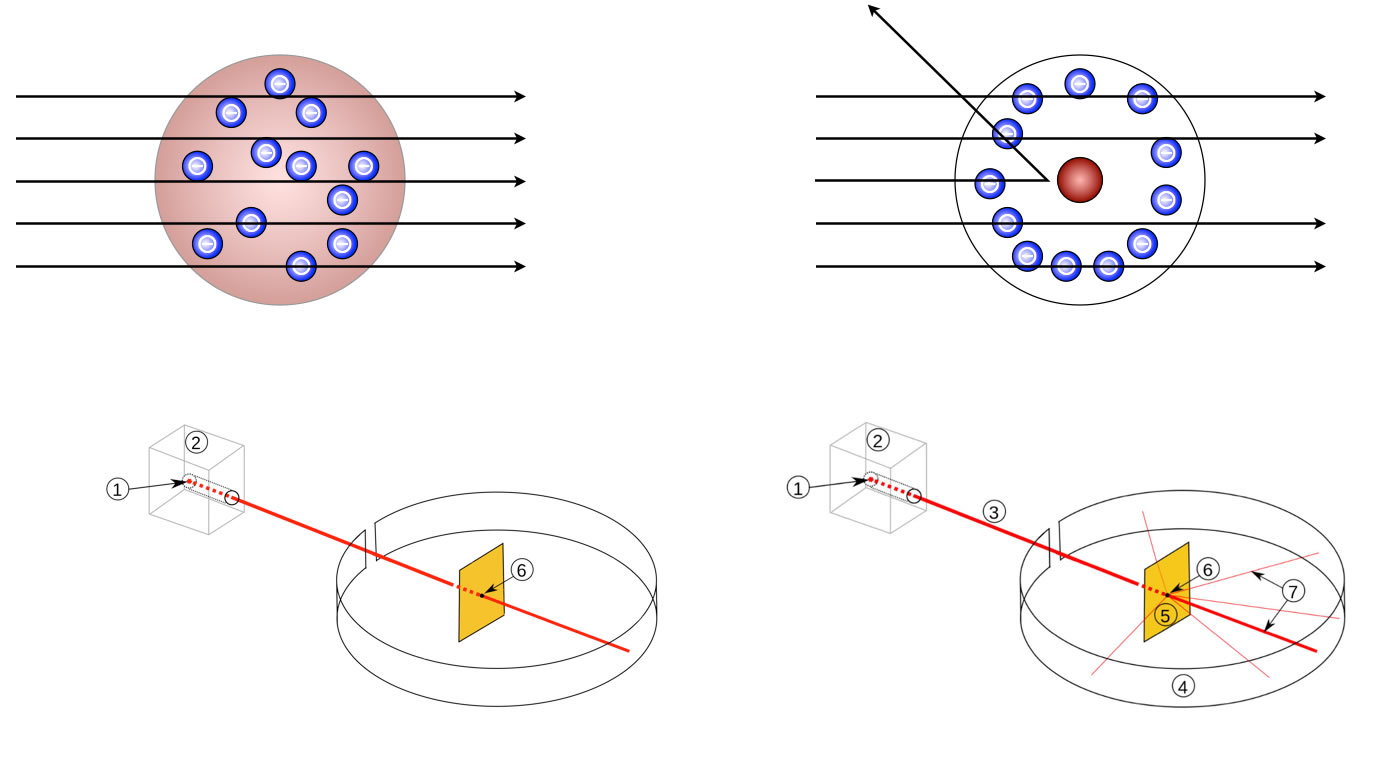
Links: Die Erwartungen Rutherfords. Rechts: Die gefundenen Ergebnisse
Links in der Abbildung sieht man die Erwartungen von Rutherford. Der alpha-Strahl (rot gezeichnet) sollte ungehindert die lockere amorphe positive Masse der Atome durchdringen können.
Rechts sieht man die gefundenen Versuchsergebnisse. Ein kleiner Teil der Strahlung wurde von den Gold-Atomen abgelenkt oder sogar ganz reflektiert.
Diese unerwarteten Beobachtungen konnte Rutherford nur durch die Annahme eines extrem kompakten und winzigen Atomkerns erklären. Nach Rutherfords Vorstellungen befindet sich die gesamte positive Ladung des Atoms in einem extrem winzigen aber recht schweren Atomkern konzentriert. Die negative Ladung - in Form von Elektronen - schwirrt dagegen in der Atomhülle herum. Das Atommodell, das auf Rutherford zurück geht, wird daher auch als Kern-Hülle-Modellbezeichnet.
Genauere Messungen ergaben, dass der Atomkern mit einem Durchmesser von 10-14 m 10.000 mal kleiner ist als das gesamte Atom, dessen Durchmesser 10-10 m beträgt.
Das muss man sich mal vorstellen! Wenn der Atomkern durch einen Kirschkern dargestellt würde (Durchmesser vielleicht 5 mm), so müsste das entsprechende Atom 50 Meter Durchmesser haben! Die Elektronen wären so klein, dass man sie nicht sehen könnte. Außerdem wäre es fast unmöglich, die winzigen Elektronen in der 50 m großen Kugel zu finden. Eine "Stecknadel im Heuhaufen" würde man viel schneller finden, um mal das bekannte Sprichwort zu bemühen. Der größte Teil eines Atoms ist also leer, besteht aus nichts! Nicht einfach aus "nichts", sondern aus "dem Nichts", mit einem groß geschriebenem N.
Die Versuchsergebnisse des RUTHERFORDschen Streuversuchs (wie der Versuch jetzt auch genannt wird) lassen sich so ganz einfach erklären. Die meisten alpha-Teilchen fliegen einfach durch das große Atom durch, ohne dem winzigen Atomkern auch nur nahe zu kommen. Einige wenige alpha-Teilchen kommen aber in die Nähe des Atomkerns und werden durch die positive Ladung mehr oder weniger stark abgelenkt. Und nur ein paar alpha-Teilchen treffen genau auf den Atomkern und prallen dort wegen der hohen Masse des Kerns und seiner positiven Ladung ab.
Exkurs:
Der Atomkern
Wie ist der Atomkern eigentlich aufgebaut?
Jetzt begeben wir uns kurz in das Gebiet der Kernphysik oder Kernchemie. Ein Atomkern ist keine "amorphe Masse" mehr, wie es das Rosinenkuchenmodell für den positven Anteil des ganzen Atoms behauptet. Ein Atomkern besteht aus kleinsten Teilchen, nämlich aus Protonen und Neutronen. Die Protonen sind positiv geladen und haben eine Masse von jeweils 1 u, und die Neutronen sind elektrisch neutral, haben aber auch eine Masse von 1 u.
Das Helium-Atom
Der Atomkern eines Helium-Atoms besteht aus genau zwei Protonen und zwei Neutronen. Daher hat der Atomkern von Helium die Masse 4 u. Die Elektronen haben im Vergleich zum Atomkern eine vernachlässigbar kleine Masse. Daher kann man sagen, dass auch das ganze Helium-Atom die Masse von 4 u hat.
Die zwei Protonen im Atomkern des He-Atoms führen dazu, dass der Atomkern zweifach positiv geladen ist. In der Hülle des He-Atoms befinden sich zwei Elektronen, die Hülle ist also zweifach negativ geladen. Die positive Ladung des Atomkerns und die negative Ladung der Hülle heben sich gegenseitig auf. Daher ist das Atom nach außen hin elektrisch neutral.
Wenn man ein Elektron aus der Hülle entfernt, wird das Helium-Atom zum einfach positiv geladenem Helium-Ion. Schafft man es, ein drittes Elektron in die Hülle zu versetzen, erhält man ein einfach negativ geladenes Helium-Ion.
Das Wasserstoff-Atom
Noch einfacher ist das Wasserstoff-Atom aufgebaut. Sein Atomkern besteht nur aus einem einzigen Teilchen, nämlich einem Proton. In der Hülle des H-Atoms befindet sich nur ein einziges Elektron. Daher ist das Wasserstoff-Atom nach außen hin elektrisch neutral. Entfernt man das einzige Elektron, bleibt das Proton als einziges Teilchen zurück. Aus diesem Grund bezeichnet man positiv geladene Wasserstoff-Ionen auch einfach als "Protonen".
Das Brom-Atom
Der Atomkern des Brom-Atoms ist wesentlich komplexer aufgebaut. Er enthält 35 Protonen. Das kann man im Periodensystem übrigens an der Ordnungszahl des Elementes Brom ablesen: 35. Die Ordnungszahl gibt immer die Zahl der Protonen im Atomkern und gleichzeitig die Zahl der Elektronen in der Elektronenhülle an. Die Masse des Brom-Atoms beträgt aber 80 u. Von diesen 80 u sind 35 u auf die Protonen zurückzuführen. Für die restlichen 45 u müssen die Neutronen verantwortlich sein. Der Kern des Brom-Atoms besteht also aus 35 Protonen und 45 Neutronen.
Das Zink-Atom
Zink hat die Ordnungszahl 30, der Atomkern enthält also 30 Protonen. Die Atommasse von Zink hat den Wert 65 (gerundet), das heißt, der Atomkern enthält neben den 30 Protonen noch 35 Neutronen.
Kritische Frage
Ist das Rutherford-Modell besser als das Thomson-Modell?
Einerseits ist das Atommodell von Rutherford genauer als das von Thomson. Physiker und Chemiker hatten schon von Anfang an Probleme mit dieser "postiven amorphen Masse", von der Thomson ausging. Wieso hatte diese Masse immer exakt die gleiche Ladung wie die Elektronen im Atom? Das Modell von Rutherford ist da mit seinen Aussagen über den Aufbau des Atomkerns deutlich genauer.
Andererseits kann man mit dem einfachen Thomson-Modell einige chemische Phänomene gut erklären, wie beispielsweise die Elektrolyse von Zinkbromid. Um diesen Versuch zu verstehen, braucht man das erweiterte Modell von Rutherford eigentlich gar nicht, es bringt keine neue Erkenntnis für das Verständnis des Versuchs.
Seitenanfang -
Einleitung -
Rosinenkuchenmodell -
Kern-Hülle-Modell -
Schalenmodell -
Periodensystem