Enzyme sind substratspezifisch
Enzyme sind globuläre Proteine mit einer ganz bestimmten Struktur: Sie haben ein oder mehrere aktive Zentren und meistens auch noch - an einer anderen Stelle des Proteins - ein allosterisches Zentrum.
Aktive Zentren
Im Schulunterricht hat man es meistens mit Enzymen zu tun, die genau ein aktives Zentrum haben. In dieses passt das Substrat wie ein Schlüssel in das Schloss hinein, hochspezifisch und komplementär. Man spricht daher auch stets von einem Schlüssel-Schloss-Prinzip.
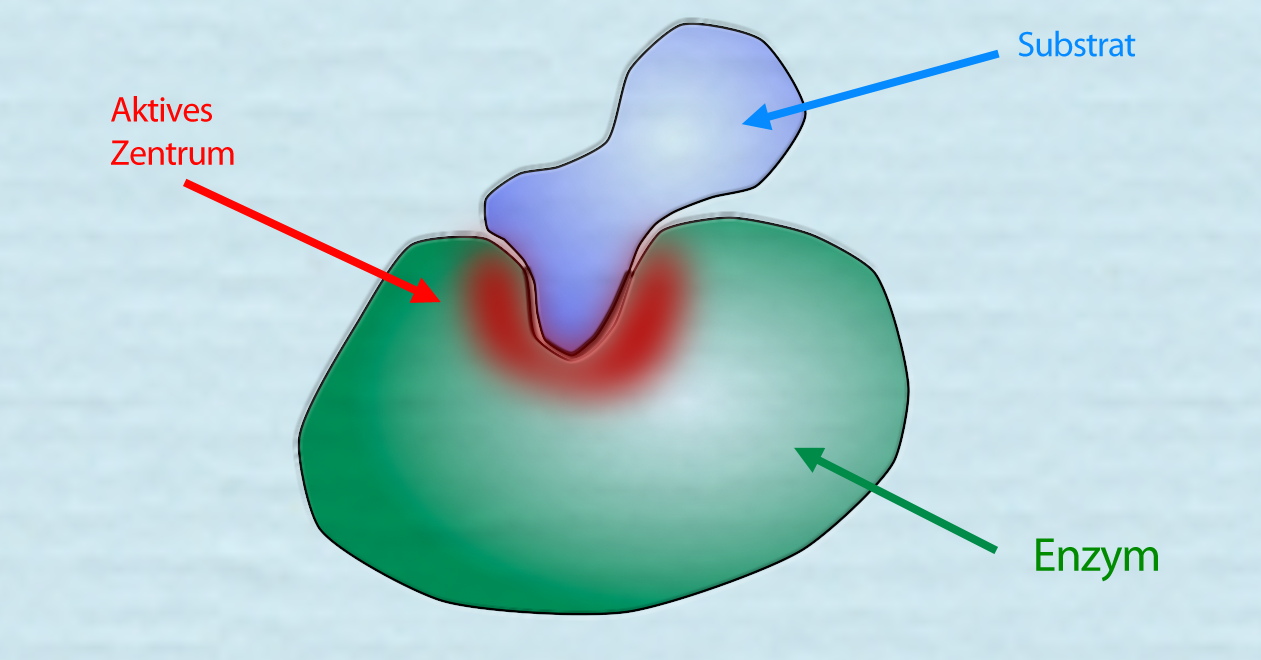
Ein Enzym-Substrat-Komplex
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende.
Hier sehen wir ein Enzym, das ein passendes Substrat gebunden hat. Das aktive Zentrum ist rot hervorgehoben. Hat eine organische Verbindung eine etwas andere Form als das oben gezeichnete Substrat, passt es nicht mehr in das aktive Zentrum des Enzyms. Das Enzym kann das nicht passende Substrat nicht (oder nicht so gut) verarbeiten.
Den Komplex aus Substrat(en) und Enzym nennt man übrigens Enzym-Substrat-Komplex.
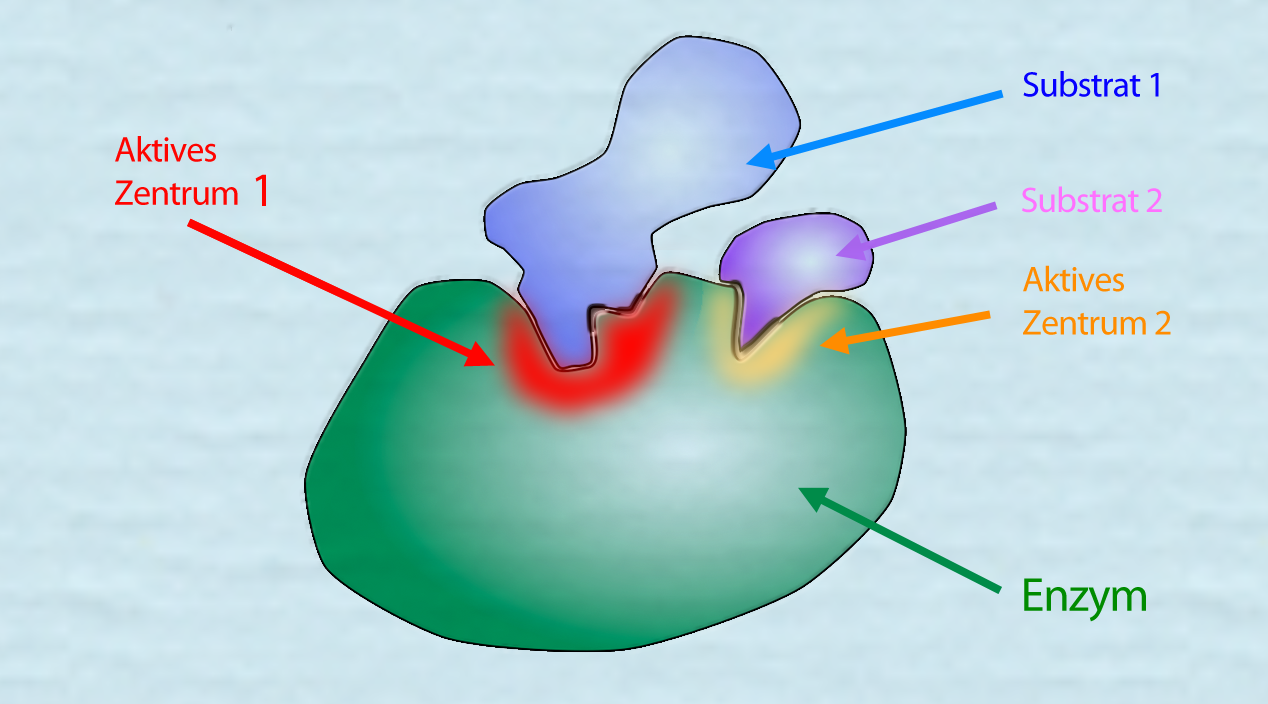
Ein Enzym, das zwei Substrate binden kann
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende.
In diesem Bild sehen wir ein Enzym, das zwei Substrate gleichzeitig binden kann, dieses Enzym hat dann natürlich auch zwei aktive Zentren. Liegen diese recht nahe beieinander, könnte man natürlich auch von einem großen aktiven Zentrum sprechen, in das zwei Substrat-Moleküle hineinpassen.
Ein bekanntes Enzym aus der Glycolyse, die Hexokinase, muss beispielsweise gleichzeitig ein Glucose-Molekül und ein ATP-Molekül binden, damit es eine Phosphatgruppe vom ATP auf die Glucose übertragen kann.
Wenn nun diese beiden aktiven Zentren nicht in der Lage wären, ihre Form zu verändern, würde wahrscheinlich gar nichts passieren. Durch eine kleine Strukturänderung mindesten eines der beiden aktiven Zentren werden die beiden Edukte der Reaktion aber näher zusammengebracht, so dass sie miteinander reagieren können. Nach erfolgter Reaktion (hier: Übertragung einer Phosphatgruppe von ATP auf Glucose) wird aus dem Enzym-Substrat-Komplex der Enzym-Produkt-Komplex.
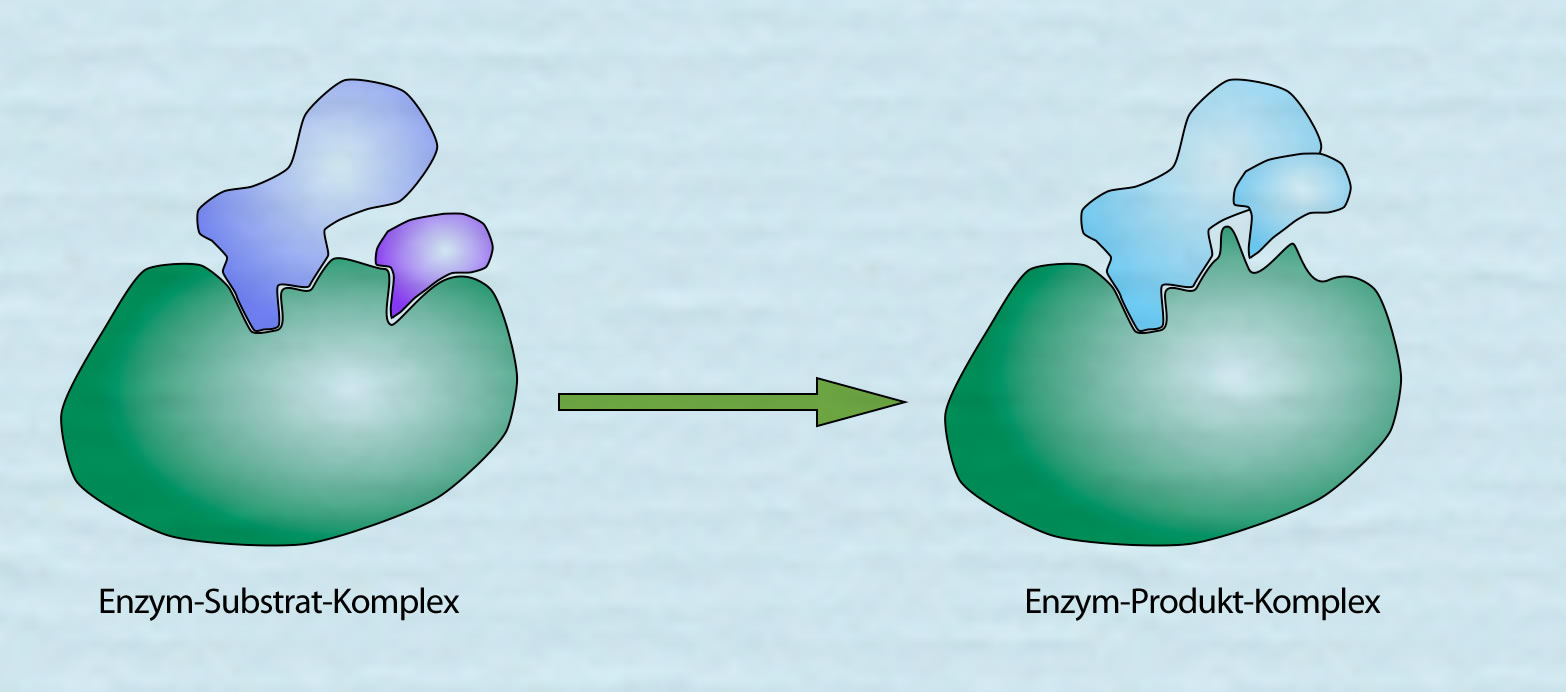
Aus dem Enzym-Substrat-Komplex wird der Enzym-Produkt-Komplex
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende
Anschließend müssen sich die aktiven Zentren des Enzyms noch einmal ein wenig verändern, damit die Reaktionsprodukte freigesetzt werden und das Enzym verlassen können. Schließlich katalysiert das Enzym ja nicht nur einen einzigen Reaktionsschritt, sondern viele Tausend bis Hunderttausend dieser Schritte.
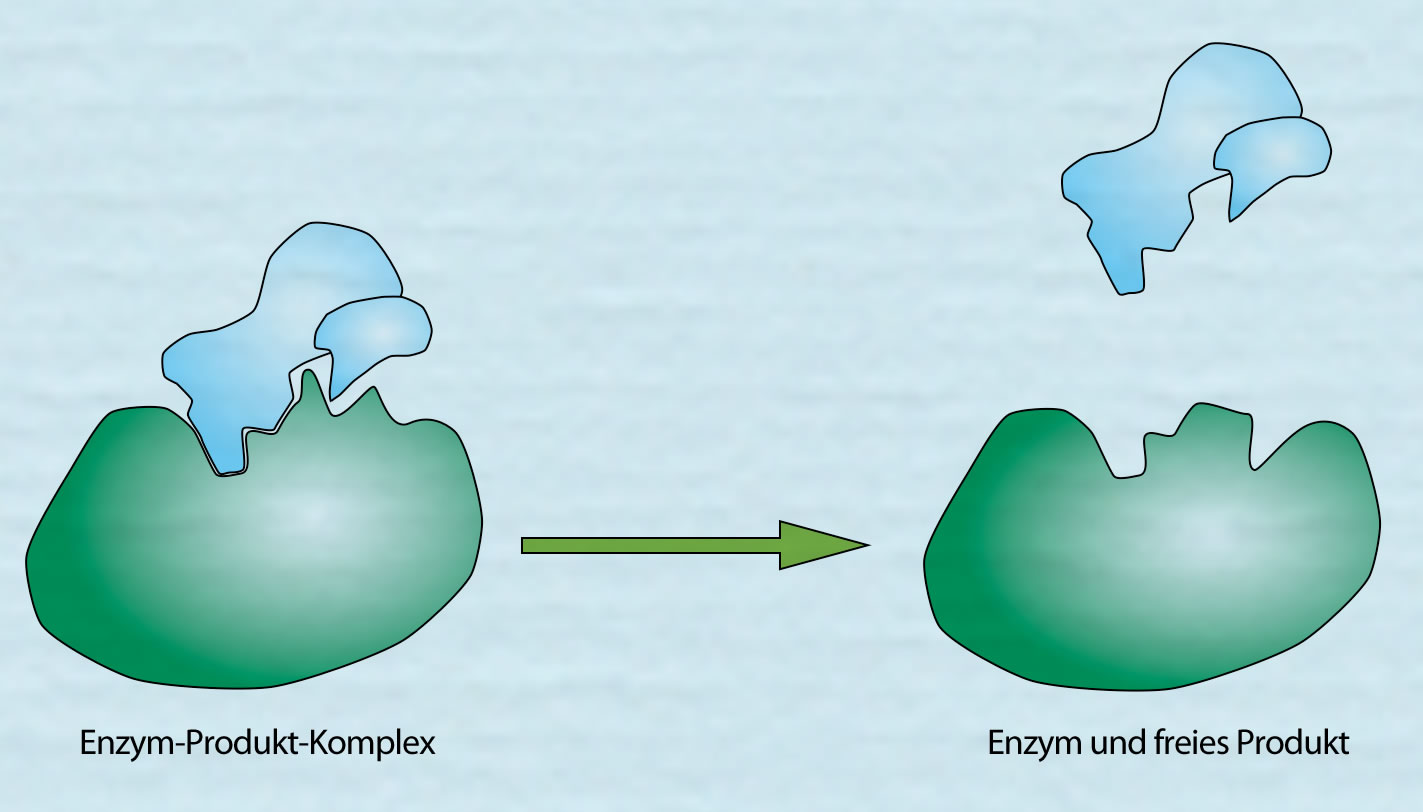
Das Produkt wird freigesetzt
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende
Hier sieht man, wie das Produkt freigesetzt wird. Anschließend liegt das Enzym wieder im ursprünglichen und erneut arbeitsfähigem Zustand vor. Es kann jetzt ein neues Substrat bzw. in diesem Fall zwei neue Substrate A und B binden.
Die Zeichnungen stellen allerdings nicht die eben besprochene Reaktion zwischen Glucose und ATP dar. Vielleicht finden Sie ja heraus, was hier noch fehlt.
Aufgabe
Finden Sie heraus, was bei den beiden letzten Zeichnungen verändert werden müsste, um die Phosphorylierung von Glucose zu zeigen.
Lösungsvorschlag:
Es gibt bei dieser Reaktion zwei Produkte, nämlich Glucose-6-Phosphat und ADP. Das ADP-Molekül wurde in den Zeichnungen nicht berücksichtigt. Die Zeichnungen zeigen eine einfachere Reaktion A + B → C mit nur einem Produkt.
Das Ganze jetzt noch einmal im Zusammenhang:
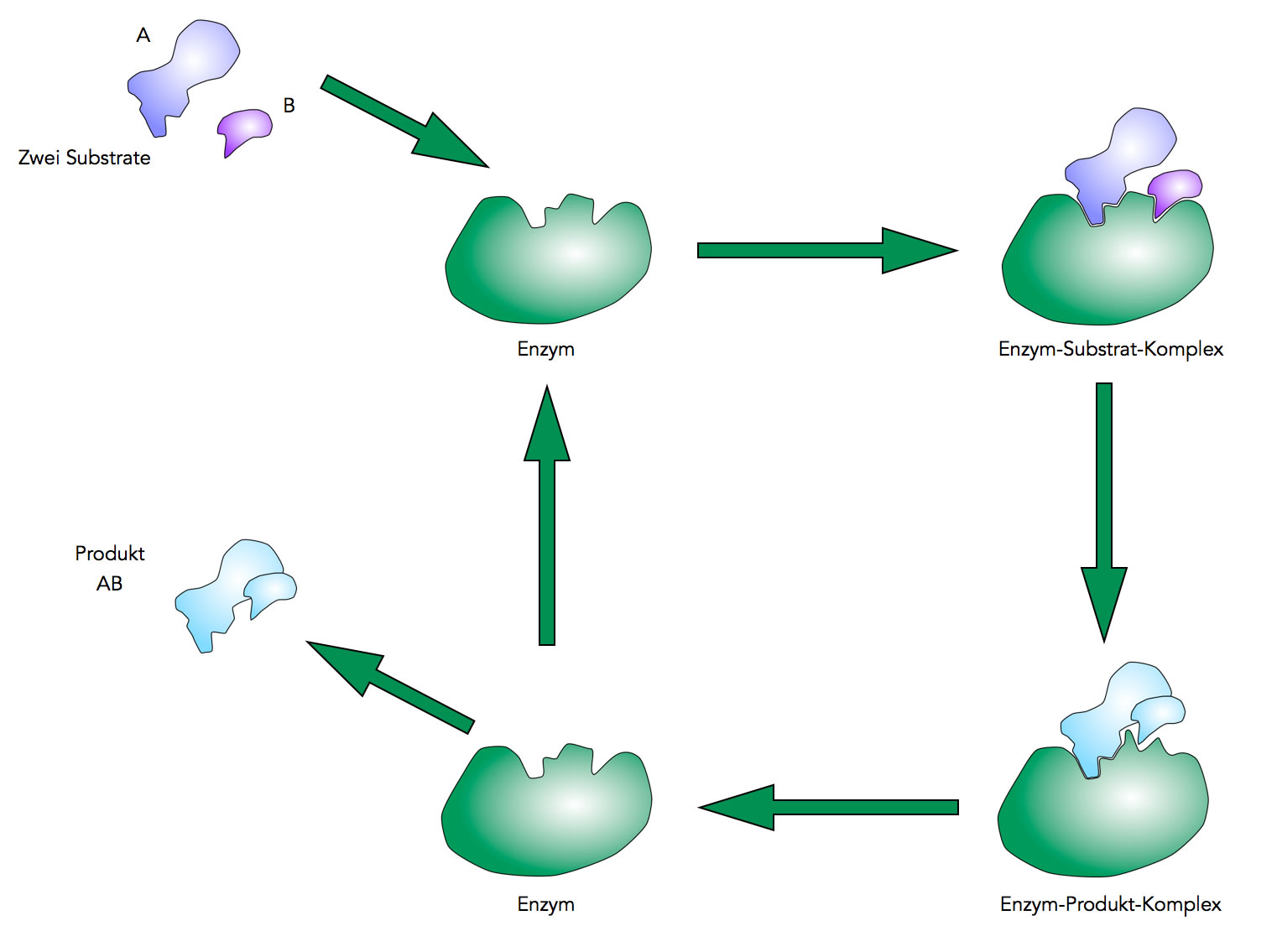
Die enzymatisch katalysierte Reaktion A + B ⇒ AB
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende
Substratspezifität und Gruppenspezifität
Die meisten Enzyme sind allerdings nicht 100%ig substratspezifisch. Sehr ähnlich aussehende chemische Verbindungen passen ebenfalls in das aktive Zentrum hinein. Allerdings ist die Enzymaktivität, also die Geschwindigkeit, mit der das Enyzm arbeitet, dann nicht so hoch.
Die meisten Enzyme haben ein recht kleines aktives Zentrum, in das nicht das ganze Substrat hineinpasst, wie man den ganzen Abbildungen gut sehen kann. Nur ein kleiner Teil des Subtrats befindet sich im aktiven Zentrum. Der Rest des Substrats, der sich nicht im aktiven Zentrum befindet, kann ohne Weiteres eine andere Struktur haben, ohne dass dies die enzymatische Aktivität beeinträchtigt.
Stellen wir uns ein Enzym vor, das Ethanol zu Acetaldehyd oxidiert, indem es dem Ethanol Wasserstoff entzieht. Diese Alkoholdehydrogenase ist übrigens ein äußerst wichtiges Enzym des Menschen. Wenn wir Alkohol getrunken haben, kommt dieses Enzym zur Arbeit und macht aus dem Ethanol des Weins oder Biers Acetaldehyd, das Oxidationsprodukt des Ethanols, das dann für den Kater am nächsten Morgen verantwortlich ist.
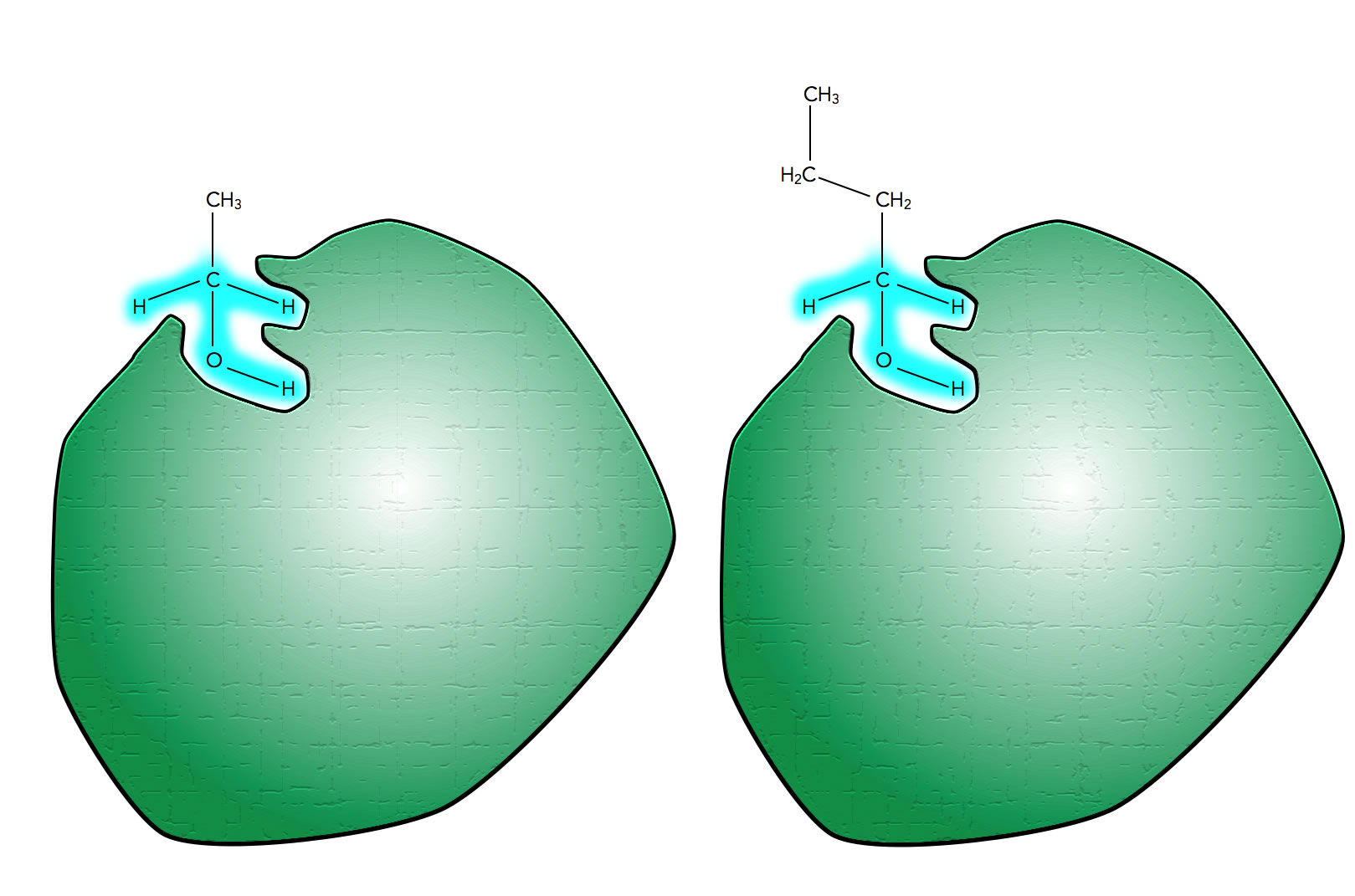
Das Ethanol-verarbeitende Enzym kann auch Butanol verarbeiten
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende
Man kann sich nun aber leicht vorstellen, dass auch andere Alkohole mit einer ähnlichen Struktur wie Ethanol von dem Enzym verarbeitet werden. In der Abbildung ist beispielsweise ein Butanol-Molekül zu sehen, das ebenfalls gut in das aktive Zentrum des Enzyms passt, weil die entscheidenden Molekülbereiche (blau markiert) ja vollkommen mit denen des Ethanols übereinstimmen.
In der Tat sind viele Enzyme gruppenspezifisch, es gibt aber auch einige wenige Enzyme, die streng substratspezifisch sind, also tatsächlich nur ein spezielles Substrat verarbeiten können.
Stereospezifität
Es gibt Moleküle, die sich wie Bild und Spiegelbild verhalten. Das folgende Bild zeigt ein solches Molekül:
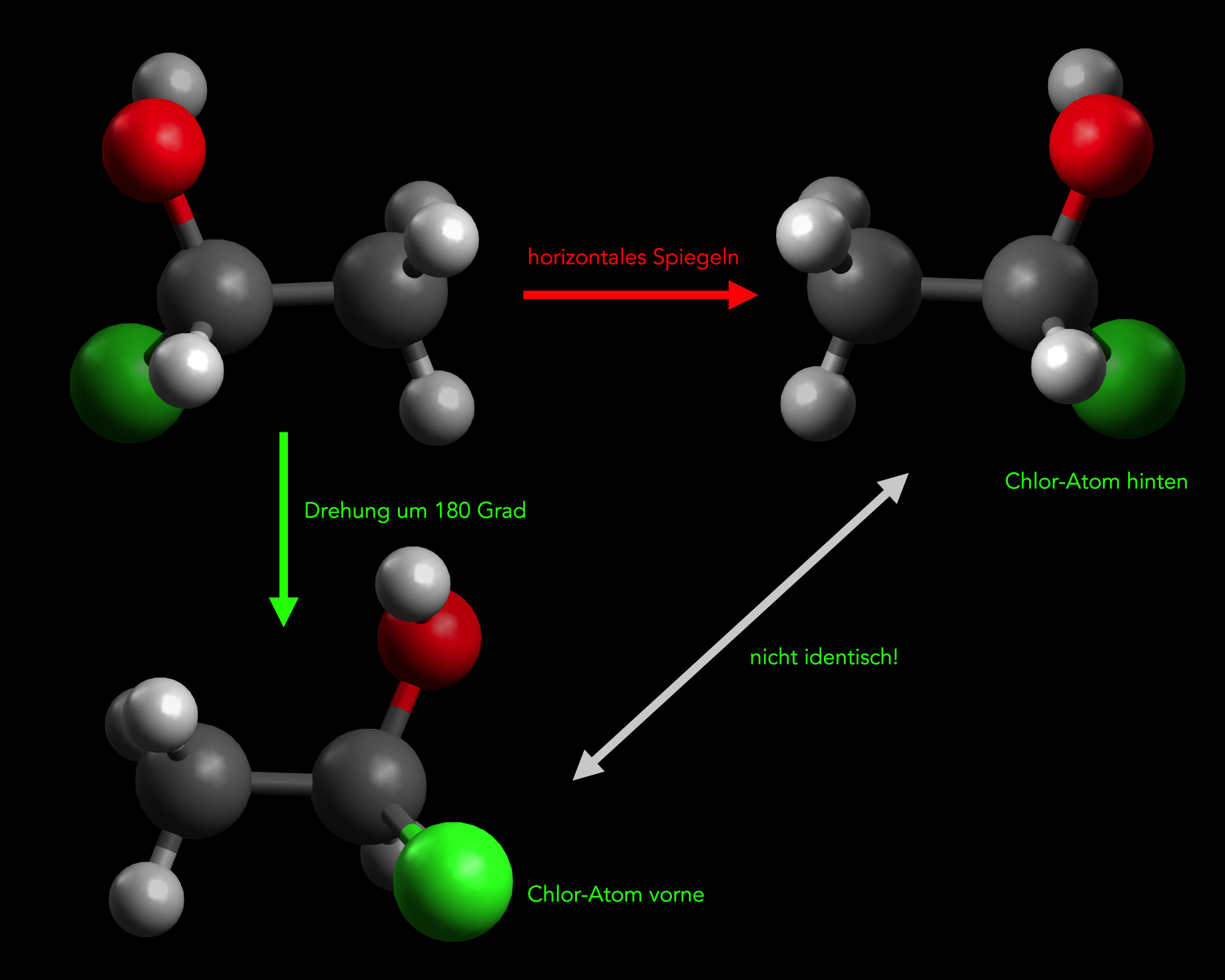
Ein 1-Chlor-ethan-1-ol-Molekül wird horizontal gespiegelt (obere Reihe) und um 180 º gedreht
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende.
Die Abbildung zeigt ein organisches Molekül, nämlich ein Ethanol-Molekül, bei dem ein H-Atom durch ein Cl-Atom ersetzt wurde. Oben im Bild sehen wir die beiden Enantiomere (Spiegelbild-Isomere) dieser Verbindung.
Unten im Bild wird überprüft, ob man das linke Enantiomer durch einfaches Drehen um 180º in das rechte Enantiomer umwandeln kann. Wie man sieht, geht das nicht. Bei rechten Enantiomer befindet sich das Chlor-Atom hinter der Bild-Ebene, bei dem gedrehten linken Enantiomer liegt das Chlor-Atom dagegen vor der Bild-Ebene.
Enantiomerie oder Spiegelbildisomerie wird auf der Seite des Chemie-Lexikons näher erklärt.
Die chemischen und physikalischen Eigenschaften solcher Enantiomere sind völlig identisch, aber Enzyme können die beiden Formen leicht voneinander unterscheiden. Genau so wenig, wie man seine linke Hand in einen rechten Handschuh hineinbekommt, kann sich das Spiegelbild eines Substrats in das aktive Zentrum eines Enzyms setzen.

Das Spiegelbild des Substrats passt nicht mehr in das aktive Zentrum hinein
Autor: Ulrich Helmich 2022, Lizenz: siehe Seitenende
Enzyme sind also stereospezifisch.
Das Contergan-Beispiel
Contergan ist ein Medikament gegen Übelkeit mit dem Wirkstoff Thalidomid, das 1954 im Labor der deutschen Firma Grünenthal entwickelt wurde. Als Frauen das Medikament im ersten Drittel einer Schwangerschaft einnahmen, führte das bei vielen der geborenen Kindern zu schweren Missbildungen, zum Beispiel verstümmelte Arme oder Beine. Diese Babys sind dann als "Contergan-Kinder" bekannt geworden. Die ganze Geschichte um den Contergan-Skandal lässt sich auf der Webseite der Firma Grünenthal sehr gut nachlesen.
Thalidomid ist ein chirales Molekül mit folgender Struktur:
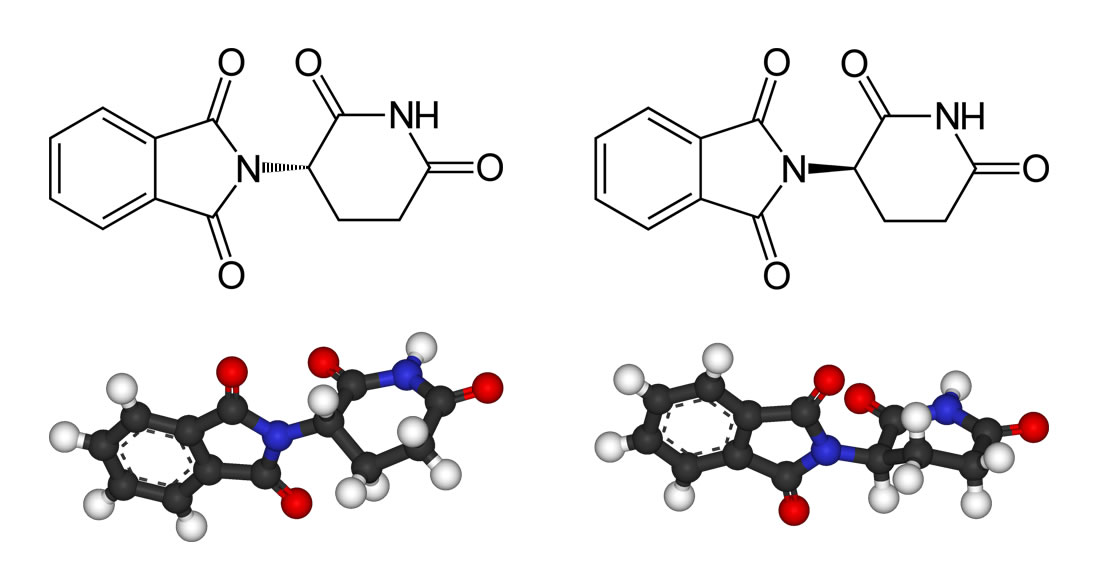
Die beiden Enantiomere des Thalidomids: Links (S)-Thalidomid, rechts (R)-Thalidomid.
Autor: Benjah-bmm27, Lizenz: public domain.
Im Contergan liegt das Thalidomid als Racemat vor, das heißt, beide Stereoisomere, sowohl die S-Form wie auch die R-Form, sind in ungefähr gleichen Anteilen vorhanden. Das (R)-Enantiomer hat eine beruhigende Wirkung und ist an sich harmlos, während das spiegelbildlich aufgebaute (S)-Enantiomer die schweren fruchtschädigenden Folgen hat.
Dieses berühmte und berüchtigte Beispiel zeigt die Wichtigkeit des Schlüssel-Schloss-Prinzips bei Enzymen, denn auch die Thalodomid-Wirkung ist ja über eine ganze Reihe von Enzymen im Körper der Schwangeren und der Kinder abgelaufen.
Enzyme sind wirkungsspezifisch
Das in Abbildung 6 gezeigte Enzym kann Ethanol und ähnliche Substrate umsetzen, es ist substratspezifisch, allerdings nicht sehr streng, da ja neben Ethanol auch Propanol, Butanol etc. umgesetzt werden können.
Allerdings kann ein Alkohol wie Ethanol auf mehrere Weisen chemisch verändert werden. Das obige Enzym ist beispielsweisefür die Oxidation von Ethanol um eine Stufe zuständig, also für die Bildung von Ethanal aus Ethanol. Andere Enzyme können Ethanol vielleicht direkt zu Essigsäure oxidieren, und wieder andere Enzyme reduzieren Ethanol zu Ethan. Und dann wieder kann ein viertes Enzym Ethanol dehydratisieren, so dass Ethen entsteht.
Die meisten Enzyme katalysieren jedoch nur eine einzige dieser Möglichkeiten. Daher sagt man, dass solche Enzyme wirkungsspezifisch sind. Jedes Enzym kann nur eine bestimmte chemische Reaktion katalysieren.
Auch die Rückreaktion wird katalysiert!
Allerdings stimmt die obige Aussage nicht ganz, dass jedes Enzym nur eine chemische Reaktion katalysiert.
Betrachten wir wieder ein Enzym, das Ethanol zu Ethanal oxidiert. Würde sich jetzt ein Molekül Ethanal, das Produkt der Reaktion also, in das aktive Zentrum unseres Enzyms setzen, dann könnte auch wieder Ethanol entstehen. Enzyme katalysieren sowohl die Hinreaktion wie auch die Rückreaktion einer biochemischen Umsetzung.
Allerdings gibt es zwei Möglichkeiten, eine solche Rückreaktion zu verhindern.
- Wenn die Aktivierungsenergie für die Rückreaktion erheblich größer ist als die Aktivierungsenergie für die Hinreaktion, wird auf jeden Fall die Hinreaktion begünstigt, die Wahrscheinlichkeit, dass es zur Rückreaktion kommt, ist extrem klein. Dies ist bei stark exothermen Reaktionen immer der Fall. Das chemische Gleichgewicht einer solchen Reaktion liegt dann stark auf der Seite der Produkte.
- Wenn das Reaktionsprodukt der enzymatischen Umsetzung sofort aus dem Systen entfernt wird, zum Beispiel durch eine anschließende chemische Reaktion, die von einem zweiten Enzym katalysiert wird, dann ist die Wahrscheinlichkeit, dass es zur Rückreaktion kommt, ebenfalls extrem klein.
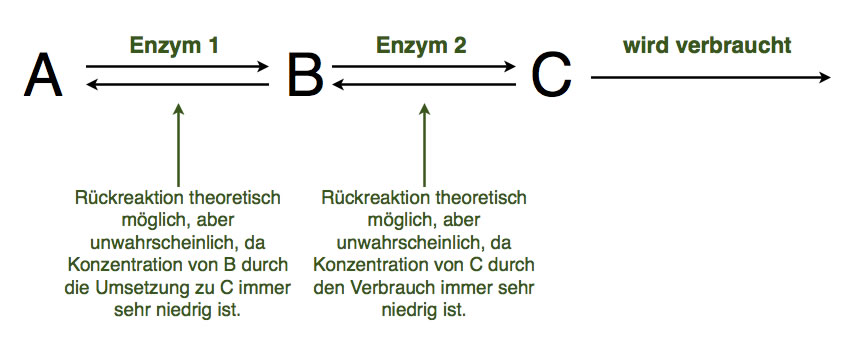
Eine enzymatische Wirkkette und das Prinzip des kleinsten Zwangs
Autor: Ulrich Helmich 2021, Lizenz: siehe Seitenende.
Hier sehen wir sogar eine noch etwas komplexere Stoffwechselkette. Enzym 1 katalysiert die Reaktion von A nach B und umgekehrt. Allerdings gibt es ein Enzym 2, das die Reaktion von B nach C katalysiert. Dadurch wird die Konzentration von B stets gering gehalten, und eine Rückreaktion nach A wird unwahrscheinlicher.
Damit aber nicht genug. Die Verbindung C wird ständig verbraucht, vielleicht durch ein drittes Enzym, das hier nicht mehr eingezeichnet ist. Dann wird auch die Wahrscheinlichkeit, dass C zu B zurückreagiert, sehr klein bis unmöglich.
Das alles wird unter den Begriffen "Chemisches Gleichgewicht" und "Prinzip des kleinsten Zwangs" im Chemie-Unterricht behandelt.
➥Prinzip des kleinsten Zwanges
Auf dieser Seite der Chemie-Abteilung meiner Homepage wird das LeChateliersche Prinzip des kleinsten Zwanges erklärt. Die Seite ist für Schüler(innen) der Stufe EF geschrieben, also sollten Sie eigentlich keine Probleme haben, alles zu verstehen.
Das chemische Gleichgewicht spielt eine sehr wichtige Rolle bei biochemischen Umsetzungen, vor allem bei Stoffwechselvorgängen. Wenn Sie dazu mehr wissen möchten, gehen Sie bitte auf die entsprechende Abteilung auf meinen Chemie-Seiten.
Enzymklassen
Nach [1] gibt es sieben EC-Klassen von Enzymen, je nach den Substratgruppen, die sie umsetzen. Das Kürzel "EC" steht für "Enzyme Commission" und nicht für "Enzyme class". Eine komplette Liste (englisch) der Enzymklassen und -unterklassen gibt es in dem Wikipedia-Artikel "List of enzymes" (ausgedruckt über 20 A4-Seiten!).
EC 1. Oxidoreduktasen
Das sind Enzyme, die Redoxreaktionen katalysieren.
EC 2. Transferasen
Das sind Enzyme, die eine funktionelle Gruppe X von einem Donator auf einen Akzeptor übertragen.
EC 3. Hydrolasen
Wie der Name schon andeutet, sind das Enzyme, die eine chemische Bindung reversibel hydrolysieren, also durch Einbau von Wasser auflösen.
EC 4. Lyasen
Lyasen sind Enzyme, die ein Molekül ohne Zufuhr von Wasser spalten können, also nicht-hydrolytisch.
EC 5. Isomerasen
Isomere sind Moleküle mit der gleichen Summenformel, aber einer anderen Strukturformel. Isomerasen katalysieren die Umwandlung des einen Isomers in ein anderes Isomer.
EC 6. Ligasen
Ligasen verknüpfen zwei Moleküle zu einem neuen, wobei Energie zum Beispiel in Form von ATP benötigt wird.
EC 7. Translocasen
Das sind komplex aufgebaute Transportproteine, die in der Lage sind, Verbindungen quer durch eine Membran zu transportieren. Einfache liganden- oder spannungsgesteuerte Ionenkanäle oder Carrierproteine gehören nicht zu den Translocasen und werden eigentlich auch nicht als Enzyme bezeichnet.
Eine deutlich genauere Auflistung der sieben Enzymklassen finden Sie auf dieser Seite im Biologie-Lexikon meiner Homepage.
Quellen:
- Nelson, Cox. LEHNINGER Principles of Biochemistry. Macmillan Learning, New York 2021.
- Berg, Tymoczko, Gatto jr., Stryer: Stryer Biochemie, 8. Auflage, Springer Berlin Heidelberg 2018.
- Wikipedia, Artikel "Thalidomid".