 |
 |
 |
|
| Giftig | Ätzend | Ernste Gesundheitsgefahr |
1. Einführung
Methanal oder Formaldehyd H2C=O, ist der einfachste Aldehyd, das erste Glied in der
2. Strukturdaten

Strukturdaten des Methanal-Moleküls und des Ethanal-Moleküls
Autor: Ulrich Helmich 10/2024, Lizenz: Public domain
Dieses Bild zeigt die Strukturdaten von Methanal und Ethanal, dem nächst höheren Glied in der Reihe der Alkanale. Die Strukturdaten in der deutschen Wikipedia weichen geringfügig von den Angaben der engl. Wikipedia ab (zum Beispiel 116,16º statt 117º beim H-C-H-Bindungswinkel).
Bindungswinkel
Theoretisch betragen die Bindungswinkel an einem sp2-hybridisierten C-Atom genau 120º, wenn alle Bindungen gleichwertig sind. Bei Aldehyden und Ketonen ist das aber nicht der Fall, die vier Bindungselektronen sowie die beiden freien Elektronenpaare des O-Atoms üben eine Abstoßungskraft auf die anderen beiden kovalenten Bindungen aus.
Beim Methanal führt dass dann zu einem H-C-H-Bindungswinkel von 117 statt 120 Grad. Beim Ethanal wird die CH3-Gruppe noch stärker abgestoßen als ein H-Atom, wegen der sechs Elektronen der drei C-H-Bindungen der Methyl-Gruppe. Der CH3-C-H-Bindungswinkel schrumpft hier sogar auf 114 Grad.
Bindungslängen
Die Bindungslängen sind wahrscheinlich denen im Ethanal-Molekül ähnlich, also 120 pm für die C=O-Doppelbindung und je 112 pm für die beiden C-H-Bindungen.
Geometrie
Das gesamte Methanal-Molekül ist wegen der sp2-Hybridisierujng des C-Atoms und des O-Atoms planar, alle drei Atome befinden sich also in der gleichen Ebene.
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedepunkt
Der Schmelzpunkt von Methanal beträgt -117 ºC, der Siedepunkt liegt bei -19 ºC . Methanal bzw. Formaldehyd ist also bei Zimmertemperatur gasförmig.
Wenn man in der Chemiesammlung der Schule eine braune Glasflasche mit dem Aufdruck "Formaldehyd" findet, so handelt es sich stets um eine wässrige Lösung des Aldehyds.
Die Methanal-Moleküle werden nur durch durch die schwachen London-Kräfte zusammengehalten sowie durch Keesom-Kräfte (auch als Dipol-Dipol-Kräfte bezeichnet). Wasserstoffbrücken-Bindungen können die Methanal-Moleküle untereinander nicht bilden. Aus diesen Tatsachen sollte man schließen, dass Methanal einerseits einen höheren Schmelz- und Siedepunkt hat als vergleichbare Alkane und Alkene, andererseits aber einen niedrigeren Schmelz- und Siedepunkt als entsprechende Alkohole.
| Verbindung | molare Masse | Siedepunkt |
| Ethan | 30 g/mol | -88,6 ºC |
| Methanal | 30 g/mol | -19 ºC |
| Methanol | 32 g/mol | +65 ºC |
Die obige Tabelle bestätigt unsere Vermutung.
3.2 Löslichkeitsverhalten
Die große Wasserlöslichkeit des Methanals wird dadurch erklärt, dass das Methanal-Molekül H-Brücken mit Wasser-Molekülen bilden kann. Auch mit andern H-Brücken-Donatoren (also Molekülen, die eine OH- oder NH2-Gruppe besitzen) können Methanal-Moleküle H-Brücken bilden, daher löst sich Methanal auch in Alkoholen und entsprechenden Verbindungen. Aber auch in wenig polaren Stoffen wie Diethylether ist Methanol sehr gut löslich.
3.3 Weitere Eigenschaften
Formaldehyd bzw. Methanal ist ein farbloses und stechend durchdringend riechendes brennbares Gas. Gemische mit Luft sind explosiv! Das Gas reizt die Augen und die Atemwege. Seit 1980 wird Methanal als krebserregend eingestuft.
Kühlt man Methanal auf -20 ºC ab, wird es flüssig und man kann seine Dichte messen: 0,815 g/cm3.
Das Dipolmoment von Methanal liegt bei 2,33 Debye.
4. Gewinnung und Synthese
4.1 Industrielle Synthese von Methanal
4.1.1 Oxidation von Methanol (Formox-Verfahren)
Methanal kann technisch durch die Oxidation von Methanol erzeugt werden:
$CH_3 \mbox{-} OH + \frac{1}{2} O_2 \to H_2C=O + H_2O; \ \ \ \Delta H = -159 kJ/mol $
Bei diesem sogenannten Formox-Verfahren (Formaldehyd-Oxidation) wird Methanol mit einem Überschuss an Luftsauerstoff umgesetzt, und zwar bei Temperaturen von 350 bis 450 ºC. Als Katalysatoren werden dabei Eisen(III)oxid oder Mangan(IV)oxid verwendet.
4.1.2 Dehydrierung von Methanol
Formal handelt es sich auch bei dieser Reaktion um eine Oxidation (Wasserstoff-Entzug).
$CH_3 \mbox{-} OH \to H_2C=O + H_2; \ \ \Delta H = +84 kJ/mol$
Diese endotherme Reaktion findet bei 600 bis 720 ºC an Silberkatalysatoren statt. Dass die Reaktion endotherm ist, spielt energietechnisch keine Rolle, denn der erzeugte Wasserstoff wird im zweiten Schritt mit Sauerstoff verbrannt, und bei dieser stark exothermen Knallgasreaktion werden 243 kJ/mol freigesetzt, so dass die Gesamtreaktion stark exotherm ist (Delta H = -159 kJ/mol).
4.1.3 Oxidation von Steamcrack-Produkten
Beim Steamcracken von Erdöl kann die Fraktion, die Propan und Butan und entsprechende C3- und C4-Derivate enthält, oxidiert werden. Allerdings entstehen bei dieser unspezifischen Reaktion viele verschiedene Produkte (Methanol, Ethanal, Ameisensäure, Essigsäure, Aceton etc.), das Methanal muss dann aufwändig abgetrennt werden. Dies geschieht dann in Gaswäschern mit Hilfe von Wasser. Dabei entsteht eine wässrige Formaldehyd-Lösung, die aber auch noch Methanol ein Ameisensäure enthält.
In diesem Abschnitt des Wikipedia-Artikels "Methanal" werden die drei hier nur kurz angerissenen Verfahren ausführlich besprochen.
4.2 Laborsynthesen
Wegen der allgemeinen Verfügbarkeit besteht in der Regel keine Notwendigkeit, Methanal im Labor herzustellen.
4.2.1 Oxidation mit Kupferblech
Im Chemieunterricht stellt man Methanal her, indem man ein glühendes Stück Kupferblech in eine Abdampfschale mit Methanol hält. Das schwarz angelaufene Kupferblech wird dann wieder blank, und die Schüler bemerken einen stechenden Geruch. Dieser Versuch wird meistens zu Beginn einer Unterrichtsreihe über Aldehyde und Ketone durchgeführt.
4.2.2 Darstellung aus Paraformaldehyd
Eine anderes Verfahren ist die Gewinnung von Formaldehyd aus Paraformaldehyd (einem Methanal-Polymer). Durch leichtes Erhitzen auf 100 bis 160 ºC zerfällt Paraformaldehyd zu Formaldehyd-Dampf. Diese Methode ist relativ sicher, da Paraformaldehyd leicht zu handhaben ist.
Paraformaldehyd
Hierbei handelt es sich um ein kurzkettiges Polymer aus 8 bis 100 Methanal-Monomeren. Paraformaldehyd ist ein weißes Pulver, das durch Zugabe von Säure oder durch Erhitzen wieder in Formaldehyd gespalten wird. Ganz ungefährlich ist Paraformaldehyd allerdings nicht, denn die Verbindung steht im Verdacht, Krebs zu erzeugen.
5. Reaktionen
Methanal ist ein wertvoller Ausgangsstoff für viele industrielle Synthesen. In der Wikipedia werden an erster Stelle die verschiedenen Kunststoffe genannt, die aus Methanal hergestellt werden können: Harnstoff-Formaldehyd-Harze, Phenoplaste und Polyoxymethylene.
Theoretische Überlegungen
Wir wollen zunächst einmal rein theoretisch überlegen, welche Art von Reaktionen Methanal eingehen könnte.
Das C-Atom der Verbindung ist positiv polarisiert und kann daher von Nucleophilen angegriffen werden. Das O-Atom ist negativ polarisiert und kann von Elektrophilen angegriffen werden. Die typische Reaktion des Methanals wäre also die Nucleophile Addition, wie sie für Aldehyde und Ketone charakteristisch ist.
Die Substitution eines H-Atoms wäre auch denkbar, aber energetisch gesehen nicht so einfach wie die Addition eines Nucleophils/Elektrophils.
Tatsächliche Reaktionen
Wenn wir uns in der Fachliteratur und in entsprechenden Artikeln im Internet umschauen, finden wir eine ganze Latte von Reaktionen, die Methanal eingehen kann. Aus Platz- und Zeitgründen werde ich hier aber nur eine kleine Auswahl präsentieren und dann auch nur kurz anreißen.
5.1 Oxidation
Mit Oxidationsmitteln wie Ag(NH3)2+, KMnO4 oder K2Cr2O7 können Aldehyde zu Carbonsäuren oxidiert werden. Bei der Tollens-Probe wird diese Reaktion als Aldehyd-Nachweis angewendet.
5.2 Reduktion zu Alkoholen
Mit einem geeigneten Reduktionsmittel lassen sich Aldehyde - auch Methanal - zum entsprechenden primären Alkohol reduzieren. Aus Methanal lässt sich so Methanol herstellen. Als Reduktionsmittel kann Wasserstoff H2 verwendet werden, wobei dann aber ein Katalysator wie Nickel, Platin oder Palladium benötigt wird. Auch Lithiumaluminiumhydrid LiAlH4 ist ein geeignetes Reduktionsmittel.
5.3 Reduktion zu Alkanen
Der Morrison-Boyd führt hier die Clemmensen-Reduktion und die Wolff-Kishner-Reduktion an, die mit Zn(Hg) und konz. HCl bzw. NH2NH2 und einer Base im sauren bzw. alkalischen Medium durchgeführt werden.
5.5 Addition von Grignard-Verbindungen
Durch Umsetzen mit einer Grignard-Verbindung RMgX entsteht ein Zwischenprodukt, das dann zum Alkohol hydrolysiert werden kann.
5.5 Addition von Cyanid
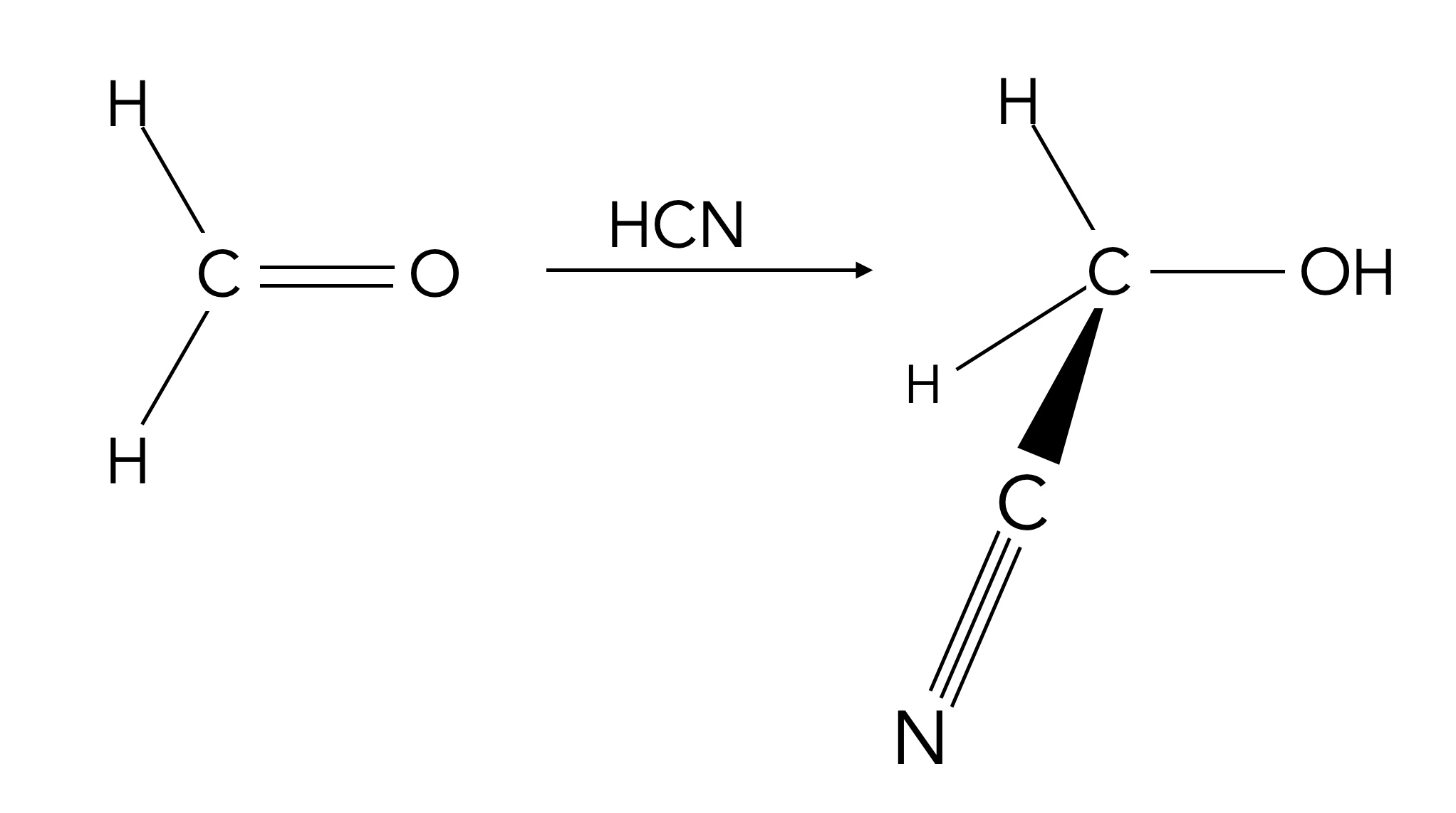
Methanal reagiert mit Blausäure zu Glyconitril
Autor: Ulrich Helmich 10/2024, Lizenz: Public domain
Diese Reaktion sollte bereits aus dem Chemieunterricht bekannt sein, denn es handelt sich um eine wichtige Zwischenstufe bei der Synthese von Plexiglas aus Propan. Es entsteht ein Cyanhydrin, dessen C≡N-Gruppe dann zu einer COOH-Gruppe hydrolysiert werden kann. Auf diese Weise kann man eine neue C-C-Einfachbindung in eine organische Verbindung einbringen. Bei der Plexiglas-Synthese wird allerdings das Keton Aceton verwendet und nicht Methanal.
Im Morrison-Boyd werden dann noch eine ganze Reihe weiterer möglicher Reaktionen der Aldehyde aufgeführt, auf die wir hier dann nicht mehr weiter eingehen wollen:
5.6 Addition von basischen Stickstoffverbindungen
Eine interessante Reaktion von Methanal mit Ammoniak ist die Folgende:
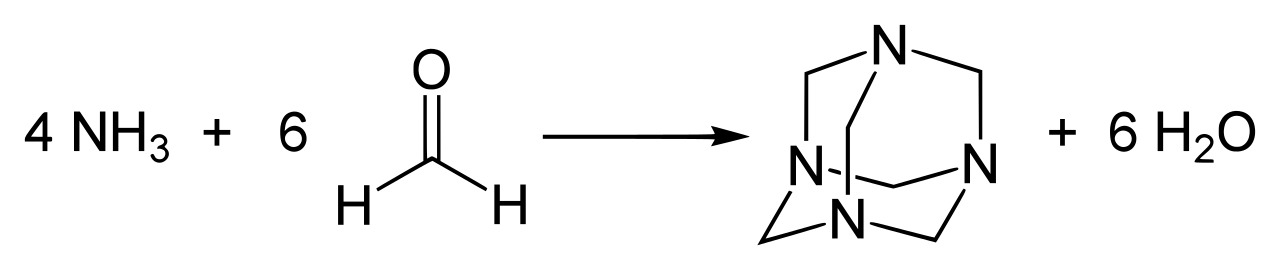
Reaktion von Methanal mit Ammoniak
Yikrazuul, Public domain, via Wikimedia Commons
Bei dieser Reaktion entsteht die komplex aufgebaute Verbindung Hexamethylentetramin, ein farbloses kristallines Pulver. Diese Verbindung wurde bereits 1859 beschrieben und 1894 als Urotropin als Mittel zur Desinfektion der Harnwege eingeführt [4].
5.7 Cannizzaro-Reaktion
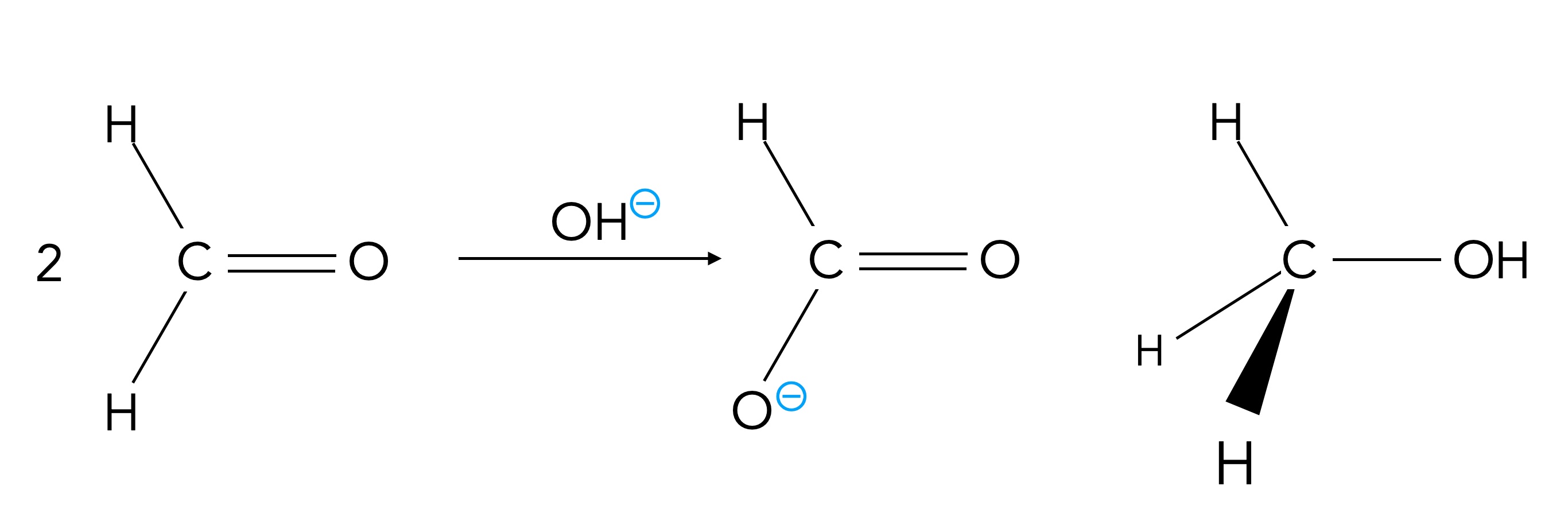
Text
Autor: Ulrich Helmich, Lizenz: Public domain
Bei dieser Reaktion handelt es sich um eine Disproportionierung. In Anwesenheit von einer Base reagieren zwei Methanal-Moleküle zum Formiat-Anion und zu einem Methanol-Molekül. Ein Methanal-Molekül wird also oxidiert, während gleichzeitig das andere Methanal-Molekül reduziert wird.
Diese Seite im Chemielexikon behandelt diese wichtige Reaktion mit Hilfe anderer Beispiele.
Viele weitere Reaktionen
Im Morrison-Boyd, in anderen Hochschul-Lehrbüchern sowie in dem Wikipedia-Artikel zum Formaldehyd sind noch viele weitere Reaktionen des Methanals beschrieben, auf die ich hier aber aus Zeitgründen nicht eingehen möchte.
6. Vorkommen und Bedeutung
Vorkommen
Im tierischen Körper kommt Methanal als sogenannter aktiver Formaldehyd auf, als C1-Körper gebunden an das Coenzym Folsäure.
Biologische Vorkommen
Text aus der Wikipedia, Artikel "Formaldehyd", von mir etwas gekürzt
In der Natur kommt Formaldehyd zum Beispiel in Säugetierzellen beim normalen Stoffwechsel als Zwischenprodukt vor. Im Menschen werden auf diese Weise pro Tag etwa 878 bis 1310 Milligramm pro Kilogramm Körpergewicht gebildet. Für einen Menschen mit einem Körpergewicht von 70 Kilogramm entspricht dies 61 bis 92 Gramm Formaldehyd pro Tag...
Ebenso kommt Formaldehyd in Holz vor und diffundiert in geringen Mengen nach außen.
Einige Bakterien ... verstoffwechseln eine Reihe von Verbindungen mit nur einem Kohlenstoffatom (C1-Verbindungen) wie Methanol, Methan, Methylamin und Dichlormethan als Energiequelle. Diese Verbindungen werden über ... Formaldehyd metabolisiert. Die Oxidation von Formaldehyd zu Kohlenstoffdioxid ist ein wichtiger Teil des Stoffwechsels dieser aeroben Bakterien.
In Früchten wie Äpfeln oder Weintrauben kommt Formaldehyd natürlicherweise vor. Die niedrigste Formaldehyd-Konzentration in Lebensmitteln konnte in Frischmilch gemessen werden, mit einem Gehalt von 0,013 bis fast 1 mg/kg. Der höchste Gehalt wurde in gefrorenem Seehecht mit 232–293 mg/kg gemessen.
Beim Konsum von einer Packung Zigaretten werden etwa 3 mg Formaldehyd vom Raucher aufgenommen. Zum Teil enthalten E-Zigaretten Stoffe wie Propylenglykol, die beim Verdampfen Formaldehyd abgeben können. Dabei werden pro Tag vom Raucher von E-Zigaretten bei gleichem Konsum etwa 14 mg Formaldehyd aufgenommen.
Bedeutung
Methanal ist ein wichtiger organischer Grundstoff der chemischen Industrie, viele Verbindungen können direkt oder indirekt (über Zwischenprodukte) aus Formaldehyd hergestellt werden (siehe weiter oben, Reaktionen). Auch Farbstoffe und Arzneimittel können aus Methanal hergestellt werden. Methanal kann leicht oxidiert werden, daher ist es ein starkes Reduktionsmittel und wird zur Keimabtötung verwendet; viele ältere biologische Präparate sind in 4- bis 8-prozentiger Formaldehyd-Lösung eingelegt. Auch zur Desinfektion und Sterilisation wird Formaldehyd gasförmig oder in Lösung verwendet.
In dem Wikipedia-Artikel "Formaldehyd" werden in diesem langen Abschnitt zahlreiche Verwendungs- und Einsatzmöglichkeiten von Methanal ausführlich beschrieben.
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Schirmeister, Schmuck, Wich: Beyer/Walter Organische Chemie, 25. Auflage 2015.
- Wikipedia, Artikel "Formaldehyd"
- Wikipedia, Artikel "Hexamethylentetramin"