 |
 |
||
| Brandfördernd | Gas unter Druck |
1. Einführung
Methan CH4, ist das einfachste Alkan, das erste Glied in der
2. Strukturdaten
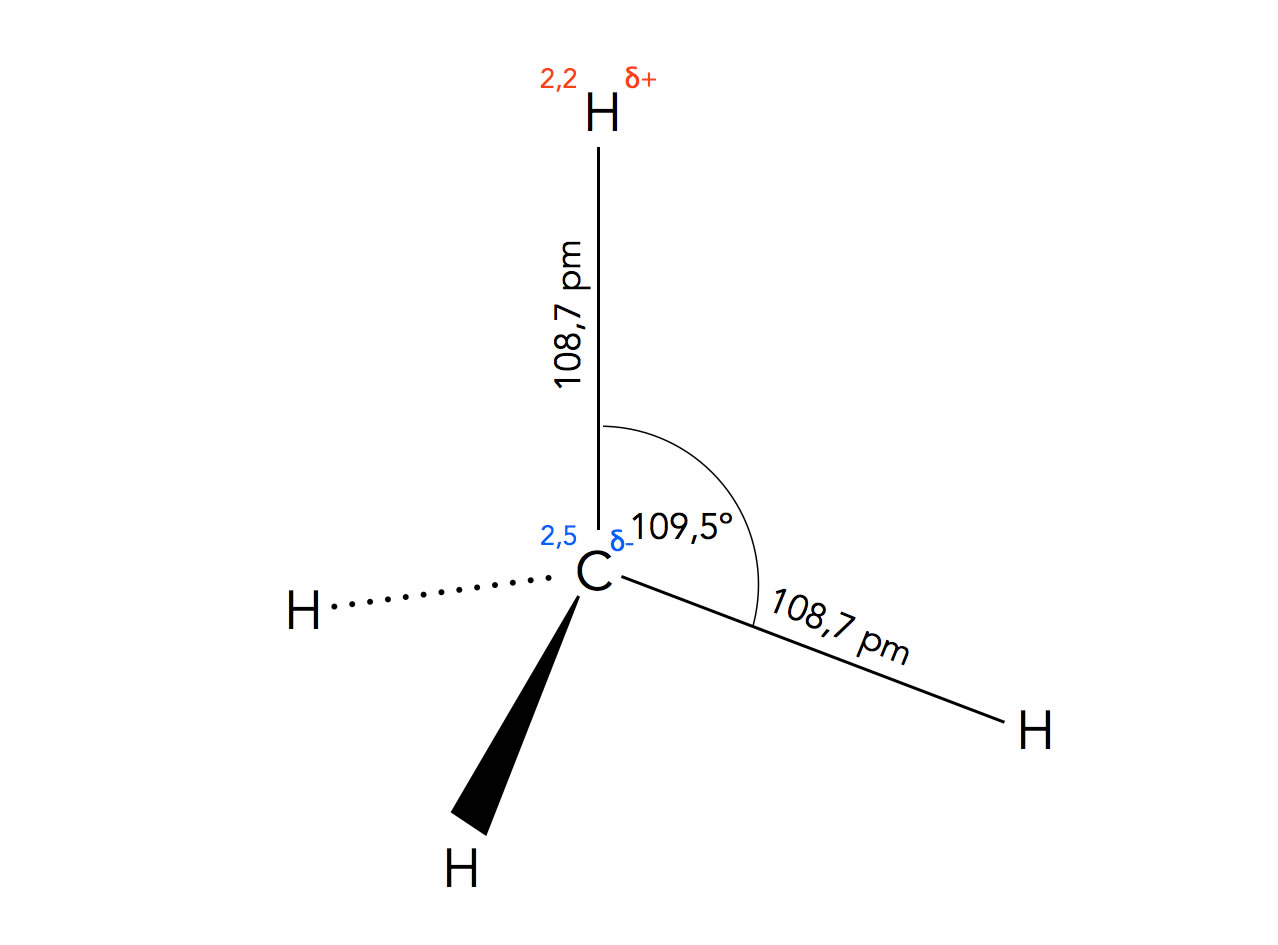
Strukturdaten des Methan-Moleküls
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die vier H-Atome des Methans sind tetraedrisch angeordnet, der Bindungswinkel H-C-H beträgt also jeweils 109,5º.
Die vier C-H-Bindungen sind nicht ganz unpolar, da ein gewisser EN-Unterschied zwischen Kohlenstoff (2,5) und Wasserstoff (2,2) vorhanden ist, aber für die meisten Belange wird die C-H-Bindung als unpolar bezeichnet. Auch vom physikalischen Verhalten her ist die Verbindung Methan unpolar, was man u.a. an dem sehr niedrigen Siedepunkt und der extrem schlechten Wasserlöslichkeit erkennen kann.
Die Bindungslänge der C-H-Bindungen beträgt 108,7 pm, und die Bindungsdissoziationsenergie liegt bei 411 kJ/mol, wobei das nur ein Durchschnittswert ist; zur Abspaltung des ersten H-Atoms sind beispielsweise 421 kJ/mol notwendig.
Weitere Einzelheiten zur Struktur des Methan-Moleküls finden Sie in diesem vertiefenden Lexikon-Artikel auf dieser Homepage.
3. Physikalische Eigenschaften
3.1 Schmelz- und Siedepunkt
Der Schmelzpunkt von Methan ist mit -182 ºC sehr niedrig, ebenso der Siedepunkt mit -161 ºC [1]. Das liegt einmal an den ziemlich unpolaren C-H-Bindungen (EN-Differenz nur 0,4) und zum andern an der symmetrischen tetraederförmigen Ausrichtung der C-H-Bindungen. Selbst wenn jede der vier Bindungen stark polar wäre (was sie nicht sind), hätte das Molekül wegen seiner symmetrischen Struktur kein Dipolmoment. Allein auf die schwachen London-Kräfte halten die Moleküle zusammen.
3.2 Löslichkeitsverhalten
Die extrem geringe Wasserlöslichkeit des Methans wird dadurch erklärt, dass das Methan-Molekül keine H-Brücken mit Wasser-Molekülen bilden kann. Gut löslich ist Methan dagegen organischen Lösemitteln wie Alkohol oder Ether [1].
3.3 Weitere Eigenschaften
Methan ist farb- und geruchlos; seine Dichte ist mit 0,656 g/l deutlich geringer als die der Luft (1,29 g/l bei 0 ºC), weshalb Methan, das auf der Erdoberfläche freigesetzt wurde, in die oberen Atmosphärenschichten aufsteigt und dort als Treibhausgas 20-30 mal aktiver ist als Kohlendioxid.
Giftig ist Methan für den Menschen nicht direkt, aber ein zu hoher Methangehalt in der Luft (>14%) vermindert den Sauerstoff-Anteil, was dann zu Atemproblemen führen kann [2].
4. Gewinnung und Synthese
4.1 Biogas
Auf natürliche Weise entsteht Methan durch den anaeroben Abbau organischer Materie durch Bakterien (Methangärung). Auf diese Weise sind auch die großen Methanvorkommen im Erdgas entstanden. Heute macht man sich diesen Prozess bei der Gewinnung von Biogas zunutze.

Ein Biogasspeicher
No machine-readable author provided. Gerfriedc assumed (based on copyright claims)., CC BY-SA 3.0, via Wikimedia Commons
4.2 Industrielle Synthese von Methan
Methan kann technisch durch die direkte Umsetzung von Kohlenstoff und Wasserstoff erzeugt werden (Kohlevergasung). Auch die Umsetzung von Kohlenmonoxid oder Kohlendioxid mit Wasserstoff ist ein mögliches Verfahren (Sabatier-Prozess). Allerdings kommt Methan so häufig in der Natur vor, dass diese industriellen Verfahren so gut wie keine Rolle spielen.
4.3 Laborsynthesen
Im Labor kann Methan gut aus Aluminiumcarbid Al4C3 oder Natriumacetat CH3COONa gewonnen werden [3]:
$Al_4C_3 + 12 \ H_2O \to 4 \ Al(OH)_3 + 3 \ CH_4$
$Al_4C_3 + 12 \ H_2O \to 4 \ Al(OH)_3 + 3 \ CH_4$
$CH_3COONa + NaOH \to Na_2CO_3 + CH_4$
Falls der Browser die Formeln auf dieser Seite nicht richtig darstellt, wurde die Erweiterung MathJax nicht korrekt geladen. Entweder ist der Browser veraltet, oder es besteht im Augenblick keine Internetverbindung.
Auf diesem YouTube-Video kann man sehr schön einen Versuch zur Synthese von Methan aus Natriumacetat und NaOH sehen.
Noch ausführlicher wird dieser Versuch auf der dieser Webseite gezeigt, in einem Video und mit guten Erklärungen dazu.
5. Reaktionen
Methan ist ein wertvoller Ausgangsstoff für viele industrielle Synthesen, beispielsweise für Methanol, Formaldehyd, Ethin, Schwefelkohlenstoff, Dichlormethan und so weiter.
5.1 Oxidation
Industriell noch wichtiger ist allerdings die Verbrennung von Methan (im Erdgas) zur Energiegewinnung für Gasheizungen oder - in größerem Maßstab - in Erdgas-Kraftwerken:
$CH_{4} + 2 \ O_{2} \to CO_{2} + 2 \ H_{2}O \ \ \ \Delta H = -802,4 kJ/mol$
Da Methan ein Treibhausgas ist und bei der Verbrennung das (harmlosere) Treibhausgas CO2 entsteht, ist es nur noch eine Frage der Zeit, bis das Verbrennen von Methan durch die Nutzung erneuerbarer Energien abgelöst wird.
5.2 Halogenierung
Unter Lichteinfluss reagiert Methan mit den Halogenen Chlor und Brom.
Bei der Chlorierung, die nach dem Mechanismus der Radikalischen Substitution SR abläuft, entsteht zunächst Chlormethan CH3Cl (ΔH = -103,5 kJ/mol). Reagiert das Chlormethan weiter, bildet sich Dichlormethan CH2Cl2 (ΔH = -102,5 kJ/mol). Bei weiterer Reaktion mit Chlor entsteht Trichlormethan CHCl3 bzw. Chloroform, früher als Betäubungsmittel bei Operationen eingesetzt (ΔH = -99,2 kJ/mol). Am Ende, bei noch weiterer Chlorierung, ergibt sich Tetrachlormethan CCl4 bzw. Tetrachlorkohlenstoff (ΔH = -94,8 kJ/mol), ein wichtiges unpolares Lösemittel.
Die Radikalische Substitution ist einer der wichtigsten Reaktionsmechanismen der organischen Chemie. Auf dieser Seite wird im Detail auf diesen Mechanismus eingegangen.
5.3 Andere Reaktionen
Methan kann auch mit Schwefel reagieren (700 ºC und Aluminiumoxid als Katalysator), dabei entstehen Kohlenstoffdisulfid CS2 und Schwefelwasserstoff. Bei der Reaktion mit Ammoniak NH3 bilden sich Cyanwasserstoff HCN (Blausäure) und Wasserstoff. Das Alkin Ethin C2H2 kann aus Methan synthetisiert werden, dabei lagern sich zwei Methan-Moleküle zu einem Ethin-Molekül zusammen, als Nebenprodukt entsteht Wasserstoff.
Hier noch einmal ein graphischer Überblick:

Einige Reaktionen des Methans
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Die hier gezeigten organischen Produkte wie CH3Cl sind natürlich keine endgültigen und unveränderlichen Produkte, sondern können selbst wieder Ausgangsstoffe weiterer Reaktionen sein. Das Chlor-Atom im CH3Cl kann zum Beispiel durch ein Brom-Atom oder eine OH-Gruppe ersetzt werden, an die Dreifachbindung im C2H2 können sich Wasser-Moleküle oder andere Verbindungen wie H2 oder NH3 addieren und so weiter. Wollte man das alles zeichnen, würde sich ein riesengroßes Netz von Reaktionen und Stoffen ergeben, das auf dieser Seite keinen Platz hätte.
In der Wikipedia findet sich ein wirklich ausführlicher Artikel zum Methan, auch auf Gewinnung und Darstellung sowie auf Verwendung, biologische Bedeutung und Umweltrelevanz (Methan als Treibhausgas!) wird hier eingegangen. Sehr zu empfehlen!
6. Vorkommen und Bedeutung
Methan ist mit 75% bis 99% der Hauptbestandteil des Erdgases. Aber auch in Kohleflözen und Erdöllagerstätten kann Methan vorkommen. Beim Untertagebau kann dies zu gravierenden Problemen führen, da Methan mit Luftsauerstoff und Kohlenstaub explosive Gemische bildet (siehe Schlagwetter in der Wikipedia) [1,2,3]. Daher muss in solchen Bergwerken der Methangehalt der Luft ständig überwacht werden [1].
Aber auch von Mikroorganismen wird Methan gebildet, vor allem beim Faulen organischer Stoffe unter Luftabschluss (Sumpfgas, Biogas). Am Meeresgrund ist viel Methan in Form von Methanhydrat ("Methaneis") gespeichert. Bestimmte Darmbakterien können Nahrungsmittelbestandteile enzymatisch spalten, dabei entsteht dann auch Methan, was zu unangenehmen Blähungen führen kann [2,3].
Weitere Vorkommen von Methan sind Permafrostböden und das Methanhydrat in der Tiefsee [2,3].
Methanhydrat [3]
Methanhydrat ist ein Clathrat oder auf Deutsch eine Käfigeinschlussverbindung.
Käfige aus Wasser-Molekülen, die Methan enthalten können
Mrmw, CC0, via Wikimedia Commons
Dabei bilden Wasser-Moleküle eine Art Käfig, in der sich dann ein oder mehrere Methan-Moleküle befinden. Zusammengehalten wird diese Wasser-Käfig durch Wasserstoffbrücken-Bindungen zwischen den H2O-Molekülen.
Methanhydrat entsteht vor allem in der Tiefsee, wo Methanbakterien (Archaeen der Klasse Methanobacteria) das CH4 produzieren. Dieses Methan wird dann unter dem hohen Druck, der in der Tiefsee herrscht, in solche Wasserkäfige eingeschlossen. Die Vorkommen an Methanhydrat sind enorm, man vermutet bis zu 12 Billionen Tonnen. Das ist zweimal so viel wie sämtliche Erdöl-, Erdgas- und Kohlevorkommen der Erde zusammengerechnet. Kein Wunder, dass man daran arbeitet, Methanhydrat als Energiequelle zu erforschen. Ein Problem dabei ist natürlich die schlechte Zugänglichkeit des Methanhydrats, eine wirtschaftliche Förderung ist noch in weiter Ferne. Und wahrscheinlich ist das auch gut so, denn Methan ist ein Treibhausgas, das den Klimawandel weiter antreibt.
In der Erdatmosphäre ist ebenfalls Methan enthalten, allerdings nicht sehr viel, nur ca. 1,72 ppm. Trotzdem darf das atmosphärische Methan nicht vernachlässigt werden, schließlich ist es ein viel stärkeres Treibhausgas als Kohlendioxid (1 g Methan hat die gleiche Wirkung wie 23 g CO2) [2].
Laut [1] beträgt der Methangehalt der Atmosphäre nur 1,3 ppm und steigt um 1 bis 2 Prozent pro Jahr. Der Römpp ist 1992 erschienen, während der Beyer/Walter 2015 veröffentlicht wurde. Dazwischen liegen also 23 Jahre. Der Methangehalt der Luft sollte nach [1] in diesen 23 Jahren um 23-46% zugenommen haben. Das entspricht ziemlich genau der Differenz zwischen diesen beiden ppm-Werten.
Interessant ist, das Methan ein Bestandteil der Uratmosphäre der Erde war - allerdings auch nur in Spuren. Auf den großen Planeten unseres Sonnensystems (Jupiter, Saturn, Uranus und Neptun) ist Methan dagegen der Hauptbestandteil der Atmosphäre. Auf dem Saturnmond Titan soll es sogar große Seen aus Methan geben [2].
7. Schulversuche mit Methan
7.1 Darstellung von Methan
7.1.1 aus Natriumacetat
Frei nach dem Motto "Starke Säure verdrängt schwache Säure aus ihren Salzen" kann man Essigsäure leicht aus ihren Salzen wie beispielsweise Natriumacetat freisetzen, indem man das Salz mit Schwefelsäure, also einer sehr starken Säure, versetzt. Die Herstellung von Methan aus Natriumacetat dagegen ist nicht so leicht. In dem Buch "Experimente im Chemieunterricht Band 2" [4] habe ich dagegen einen schönen Versuch gefunden, der allerdings etwas komplexer in der Durchführung ist.
In diesem Versuch werden wasserfreies Natriumacetat (1g) und Natriumhydroxid (1g) in einem schwer schmelzbaren Reagenzglas durch Schütteln gemischt. Mit dem Brenner wird das Gemisch dann stark erhitzt und geschmolzen. Dabei entweicht Methan:
$CH_3COONa + NaOH \to CH_4 + Na_2CO_3$
Die Gasentwicklung kann man mit Hilfe des Brenners regulieren. Das entstehende Gas wird dann aufgefangen und für weitere Versuche verwendet.
7.1.2 aus Aluminiumcarbid
Auch aus Aluminiumcarbid Al4C3 lässt sich Methan herstellen:
$Al_4C_3 + 12 \ HCl \to 3 \ CH_4 + 4 \ AlCl_3$
Dazu gibt man eine kleine Menge (2,5g) Aluminiumcarbid in einen Zweihalskolben und lässt aus einem Tropftrichter verd. Salzsäure dazu tropfen. Das entstehende Gas wird dann abgeleitet und in einem Kolbenprober oder einer pneumatischen Wanne in einem Standzylinder aufgefangen und für weitere Versuche verwendet.
In einem älteren Buch [5] findet man einen ähnlichen Versuch, allerdings wird hier nicht Salzsäure zugetropft, sondern Wasser:
$Al_4C_3 + 12 \ H_2O \to 3 \ CH_4 + 4 \ Al(OH)_3$
7.2 Versuche mit Methan
7.2.1 Knallgasprobe
Hier findet man in der Literatur eigentlich nur die Knallgasprobe mit Methan, die äußerst vorsichtig durchzuführen ist - ähnlich wie die Knallgasprobe mit Wasserstoff.
7.2.2 Brennbarkeit von Methan
Dazu füllt man einen Luftballon mit Methan (Erdgas). Im Freien befestigt man den Luftballon und entzündet ihn mit einer Wunderkerze. Der Luftballon platzt und das Methan entzündet sich mit orangeroter Flamme.
7.2.3 Nachweis der Verbrennungsprodukte (einfach)
Man feuchtet einen kleinen Standzylinder von innen mit Kalkwasser an. Dann wird der Standzylinder mit Methan gefüllt und mit einem Deckel verschlossen. Für den eigentlichen Versuch entfernt man dann den Decken und entzündet das Methangas mit einem langen Streichholz. Man kann dann beobachten, dass sich an den Wänden des Standzylinders viele kleine farblose Tropfen bilden (Wasser), und dass sich das Kalkwasser in dem Zylinder trübt (durch CO2).
7.2.4 Nachweis der Verbrennungsprodukte (anspruchsvoller)
Man baut sich eine Apparatur zusammen, bei der das brennende Gas aus einem Bunsenbrenner mit Hilfe eines Trichters aufgefangen und dann mit Hilfe von Schlauchverbindungen durch eine Gaswaschflasche und dann durch ein U-Rohr geleitet wird. In der Gaswaschflasche befindet sich Kalkwasser, im U-Rohr weißes Kupfersulfat. Das U-Rohr wird dann an eine Wasserstrahlpumpe angeschlossen, welche die Verbrennungsprodukte des Methans durch die gesamte Apparatur saugt.
Man kann dann beobachten, wie sich das Kalkwasser trübt (CO2-Nachweis) und wie das Kupfersulfat blau wird (H2O-Nachweis):
Quellen:
- Römpp Chemie-Lexikon, 9. Auflage 1992
- Schirmeister, Schmuck, Wich: Beyer/Walter Organische Chemie, 25. Auflage 2015.
- Verschiedene Wikipedia-Artikel
- Sieve, Struckmeier, Böhm: Experimente im Chemieunterricht Band 2. Springer Berlin Heidelberg.
- Just, Hradetzky: Chemische Schulexperimente Band 4, Berlin, Volk und Wissen Volkseigener Verlag,; 1. Auflage 1977.
- Schakowske: Schulversuchspraktikum Methan und Erdgas, Sommersemester 2013.