Inhaltsübersicht
5.1 Rekapitulation: Schulwissen
Im Chemieunterricht haben Sie wahrscheinlich Brom oder Bromwasser zu Hexan oder Heptan gegeben und beobachtet, dass die Braunfärbung der Lösung verschwindet, wenn man das Reaktionsgefäß stark belichtet. Man stellt beispielsweise einen Erlenmeyerkolben mit dem Stoffgemisch auf einen Tageslichtprojektor. Bestrahlt man das Alkan-Brom-Gemisch mit blauem Licht, läuft die Reaktion deutlich schneller ab als bei Bestrahlung mit gelbem oder rotem Licht.

Schulversuch zur Bromierung von Heptan, Einfluss der Lichtfarbe.
Autor: Ulrich Helmich 2015, Lizenz: Public domain
Die Chlorierung von Methan läuft nach dem gleichen Reaktionsmechanismus ab, lässt sich aber leichter an der Tafel formulieren, da man nicht ständig sechs oder sieben C-Atome zeichnen muss. Es handelt sich um eine typische Kettenreaktion. Das heißt, das Reaktionsprodukt des Schrittes A ist gleichzeitig der Ausgangsstoff für den nächsten Schritt B, und dessen Produkt ist wieder der Ausgangsstoff für den Schritt A.

Chlorierung von Methan wie sie in jedem Schulbuch steht
Autor: Ulrich Helmich 01/2026, Lizenz: Public domain
Dieses Bild zeigt die Einzelschritte der Methan-Chlorierung, wie sie wohl auch in jedem Schulbuch abgebildet sind.
(S) Startreaktion
In einer Startreaktion werden die Chlor-Moleküle durch Lichtenergie gespalten, man spricht hier auch von einer Photolyse (Spaltung durch Licht). Es entstehen Chlor-Radikale, die mit dem Alkan reagieren.
(1) Erster Kettenfortpflanzungsschritt
Im 1. Kettenfortpflanzungsschritt abstrahiert (entfernt) das Chlor-Radikal ein H-Atom aus dem Alkan, es bildet sich das Nebenprodukt Chlorwasserstoff HCl. Übrig bleibt ein Alkyl-Radikal, hier also das Methyl-Radikal.
(2) Erster Kettenfortpflanzungsschritt
Das Methyl-Radikal selbst ist ebenfalls sehr reaktiv und reagiert dann im 2. Kettenfortpflanzungsschritt mit einem neuen Chlor-Molekül zum Endprodukt Chlormethan.
So entsteht ein neues Chlor-Radikal, dass dann wieder mit einem weiteren Alkan-Molekül reagiert und so weiter. Es handelt sich um eine sogenannte Kettenreaktion. Die Startreaktion bildet Radikale, und jedes Chlor-Radikal kann dann eine Reaktionskette aus 5000 oder mehr Zyklen starten. Jede Zyklus besteht aus den beiden oben erwähnten Kettenfortpflanzungsschritten.

Visualisierung der Kettenreaktion
Autor: Ulrich Helmich 01/2026, Lizenz: Public domain
Hier sehen wir eine etwas andere Darstellung der beiden Kettenfortpflanzungsschritte; der Charakter der Kettenreaktion soll mit diesem Bild verdeutlicht werden. Methan (oben links) und Chlor (unten rechts) werden als Edukte in das System "hineingesteckt", Chlormethan (oben rechts) und Chlorwasserstoff (unten links) verlassen das System als Produkte.
Ein einziger Lichtquant, der ein Chlor-Molekül spaltet, kann bis zu 5.000 Zyklen dieser Kettenreaktion auslösen. Da bei der Spaltung eines Chlor-Moleküls zwei Radikale entstehen, hat die sogenannte Quanten-Ausbeute der Chlorierung den Wert 10.000.
(A) Kettenabbruch
Gelegentlich wird eine solche Reaktionskette abgebrochen, nämlich immer dann, wenn zwei Radikale miteinander reagieren. Für diese Kettenabbruchreaktion gibt es bei der Methan-Chlorierung drei Möglichkeiten:
(A1) Es können zwei Chlor-Radikale zusammenstoßen,
(A2) ein Chlor- und ein Methyl-Radikal stoßen zusammen,
(A3) zwei Methyl-Radikale vereinigen sich zu einem Ethan-Molekül.
Monochlorierung und Mehrfachchlorierung
Nur wenn man sehr wenig Chlor zu dem Methan gibt, entsteht ausschließlich Chlormethan. Erhöht man die Chlor-Konzentration, erhält man auch mehrfach substituierte Methan-Derivate, nämlich Dichlormethan, Trichlormethan und schließlich Tetrachlormethan.
Bromierung
Die Bromierung von Methan oder anderen Alkanen verläuft analog, allerdings ist Brom lange nicht so reaktiv wie Chlor, daher verläuft die Reaktion nicht so explosiv. Auch Ethan, Propan und die anderen Alkane lassen sich chlorieren und bromieren. Beim Propan gibt es allerdings schon zwei verschiedene Monochlor- bzw. Monobrom-Produkte, denn sowohl ein primäres wie auch ein sekundäres H-Atom können substituiert werden.
Selektivität
Im Leistungskurs haben Sie sich vielleicht schon mit der Frage beschäftigt, wie die Chlorierung bzw. Bromierung bei längerkettigen und eventuell auch verzweigten Alkanen wie zum Beispiel Propan oder Methylpropan abläuft. Hier hat das Chlor- oder Brom-Radikal die Auswahl zwischen primären, sekundären und eventuell sogar tertiären H-Atomen, die es abstrahieren kann. Aufgrund der hohen Stabilität tertiärer Alkyl-Radikale entstehen dann hauptsächlich Reaktionsprodukte, bei denen das Halogen-Atom ein tertiäres H-Atom substituiert, wenn das möglich ist. Auch sekundäre H-Atome werden leichter substituiert als primäre. Bei der Bromierung ist diese Selektivität noch extremer ausgeprägt als bei der Chlorierung.
Wenn Sie nach dem Lesen dieses Abschnitts festgestellt haben, dass Ihnen doch noch einige Grundlagen fehlen, sollten Sie sich diese Seiten zur Radikalischen Substitution ansehen, die ich speziell für Schüler(innen) der Qualifikationsphase geschrieben habe.
5.2 Vorbereitung auf das Chemie-Studium
Die Radikalische Substitution wird meistens ganz zu Beginn der Organik-Vorlesung behandelt, als erster großer Reaktionsmechanismus. Auch in den Hochschul-Lehrbüchern steht dieser Reaktionsmechanismus meistens am Anfang. Vorher kommen eher grundsätzliche Themen wie Atombau, chemische Bindung etc., aber dann fängt der eigentliche Organik-Teil mit den Alkanen und der Radikalischen Substitution an.
5.2.0 Warum ist die Radikalische Substitution so wichtig für das Chemie-Studium?
Der Grund für diese Vorzugsbehandlung der Radikalischen Substitution ist die Tatsache, dass man mit Hilfe dieser Reaktion funktionelle Gruppen in einen Kohlenwasserstoff einführen kann. Die Chlorierung eines Alkans führt zu einem Halogenalkan. Das eingeführte Chlor-Atom kann dann durch weitere Reaktionen gegen andere Atome oder Atomgruppen ausgetauscht werden, zum Beispiel durch eine OH-Gruppe. Den so erhaltenen Alkohol kann man zu einem Aldehyd oder Keton oxidieren oder auf andere Weise weiterreagieren lassen, zum Beispiel zu einem Alken.
5.2.1 Selektivität als Phänomen
In den Vorlesungen und Lehrbüchern wird zunächst das Grundprinzip der radikalischen Kettenreaktion besprochen, so ähnlich, wie wir es im Teil 5.1 (Schulwissen) gemacht haben.
Im nächsten Schritt werden die Chlorierung und die Bromierung von Propan behandelt, im Clayden beispielsweise auf Seite 1081, im Buddrus schon ganz vorn auf Seite 85 (wie es sich eigentlich gehört!).

Chlorierung von Propan
Autor: Ulrich Helmich 01/2026, Lizenz: Public domain
Bei der Chlorierung von Propan würde man erwarten, dass mehr 1-Chlorpropan entsteht als 2-Chlorpropan. Das Propan-Molekül besitzt schließlich sechs primäre H-Atome, aber nur zwei sekundäre. Daher sollten sich 1-Chlorpropan und 2-Chlorpropan im Verhältnis 6:2 bzw. 3:1 bilden.
Statt der erwarteten 75% 1-Chlor-propan findet man jedoch nur 45%, und vom 2-Chlorpropan bilden sich statt der erwarteten 25% ungefähr 55%.
Bei der Bromierung von Propan sieht die Sache noch extremer aus. Es bilden sich nur 4% 1-Brompropan und 96% 2-Brompropan.
Selektivität
An dieser Stelle wird in den Vorlesungen und Fachbüchern meistens der Begriff der Selektivität eingeführt. Darunter versteht man das Phänomen, dass ein Reaktionsprodukt häufiger entsteht, als es rein statistisch zu erwarten wäre.
Bei der Chlorierung von Propan kann man eine solche Selektivität schon beobachten, bei der Bromierung von Propan ist diese Selektivität deutlich ausgeprägter.
Zur Verdeutlichung des Selektivitäts-Begriffs wird in den Vorlesungen und Lehrbüchern dann eine Tabelle präsentiert, die ungefähr so aussieht:
| primär | sekundär | tertiär | |
| Fluorierung | 1 | 1,2 | 1,4 |
| Chlorierung | 1 | 3,7 | 5,0 |
| Bromierung | 1 | 72 | 890 |
Diese Zahlen stammen übrigens aus dem Lehrbuch von Buddrus [4].
Wie kann man diese wichtige Tabelle nun interpretieren?
Bei der Chlorierung lässt sich ein sekundäres H-Atom im Schnitt 3,7 mal leichter (schneller) abstrahieren als ein primäres H-Atom. Für ein tertiäres H-Atom ergibt sich sogar ein Geschwindigkeits-Zuwachs von Faktor 5. Die Chlorierung ist also eindeutig selektiv, es werden tertiäre H-Atome bevorzugt abstrahiert.
Bei der Bromierung ist diese Selektivität noch viel ausgeprägter. Hier werden tertiäre H-Atome 890 mal so schnell abstrahiert wie primäre.
Wenn die Studierenden all dies verstanden haben, folgen meistens ein paar Übungen wie zum Beispiel die folgende:
Aufgabe
Berechnen Sie die prozentualen Anteile der Reaktionsprodukte bei der Monochlorierung von Methylbutan.
Lösung:
Zunächst zeichnen wir uns das Molekül einmal auf, benennen die Produkte und berechnen die statistischen Anteile:
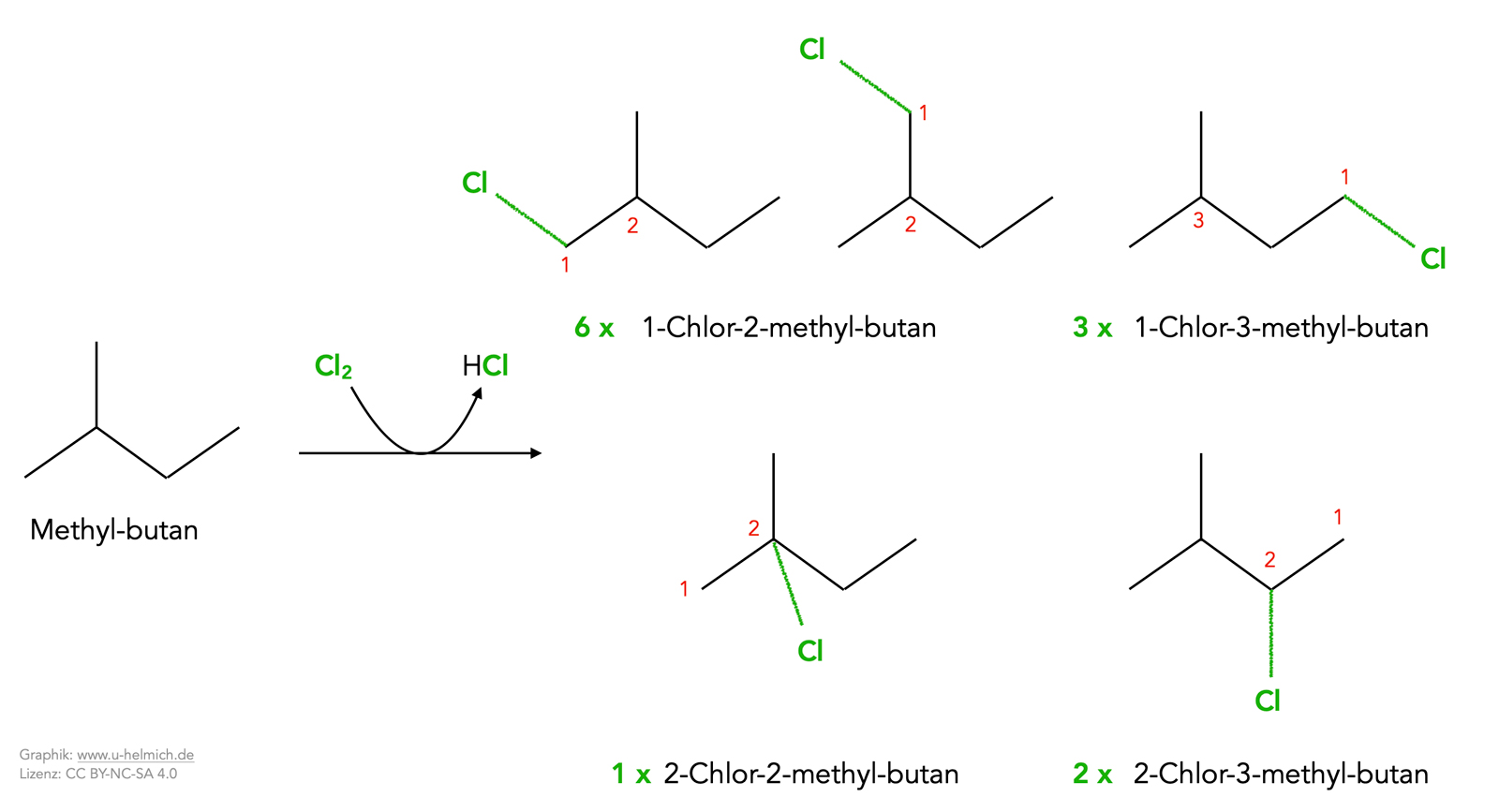
Nun werden die statistischen Anteile (6, 3, 2 und 1) mit den Faktoren der obigen Tabelle multipliziert:
- 1-Chlor-2-methyl-butan = 6 * 1 = 6 Teile
- 1-Chlor-3-methyl-butan = 3 * 1 = 3 Teile
- 2-Chlor-3-methyl-butan = 2 * 3,7 = 7,4 Teile
- 2-Chlor-2-methyl-butan = 1 * 5 = 5 Teile
Zusammen sind das 21,4 Teile. Daraus kann man nun die prozentualen Anteile der vier Produkte im Produktgemisch berechnen:
- 1-Chlor-2-methyl-butan = 28,04%
- 1-Chlor-3-methyl-butan = 14,02%
- 2-Chlor-3-methyl-butan = 34,58%
- 2-Chlor-2-methyl-butan = 23,36%
5.2.2 Ursachen der Selektivität
Wenn man nach den Ursachen dieser Selektivität recherchiert, findet man in allen Lehrbüchern eine Tabelle mit den Bindungsdissoziationsenergien von kovalenten Bindungen.
- Primäre C-H-Bindung: 423 kJ/mol
- Sekundäre C-H-Bindung: 414 kJ/mol
- Tertiäre C-H-Bindung: 404 kJ/mol
Offensichtlich lassen sich tertiäre C-H-Bindungen leichter spalten als sekundäre, und diese wiederum leichter als primäre.
Nachdem man diese Frage geklärt hat, stellt sich automatisch die nächste Frage:
Wieso ist die Bindungsdissoziationsenergie bei tertiären C-H-Bindungen kleiner als bei sekundären beziehungsweise primären?
In einem Chemie-LK würde man, falls man überhaupt so weit kommt, den positiven induktiven Effekt der Alkylgruppen als Begründung anführen.
Der +I-Effekt als Begründung
Alkyl-Gruppen zeichnen sich durch einen sogenannten +I-Effekt aus. Sie erhöhen die Elektronendichte an benachbarten Atomen, indem sie über sigma-Bindungen Elektronendichte in Richtung eines elektronenarmen Nachbar-Atoms verschieben.
Bei der radikalischen Chlorierung oder Bromierung von Propan entsteht im Reaktionsverlauf ein Alkyl-Radikal als Zwischenprodukt. Dieses Radikal ist grundsätzlich instabil, da das betreffende Kohlenstoff-Atom nur sieben Valenzelektronen besitzt statt acht.
Befindet sich das ungepaarte Elektron an einem der beiden primären Kohlenstoff-Atome des Propans, kann lediglich ein benachbarter Methyl-Rest Elektronendichte zum radikalischen Zentrum hin verschieben. Die Stabilisierung durch den +I-Effekt ist daher vergleichsweise gering.
Entsteht das Radikal aber am mittleren, sekundären Kohlenstoff-Atom, so können zwei benachbarte Methyl-Gruppen Elektronendichte zum radikalischen Zentrum verschieben. Das sekundäre Propyl-Radikal wird dadurch deutlich stärker stabilisiert als das primäre Propyl-Radikal.
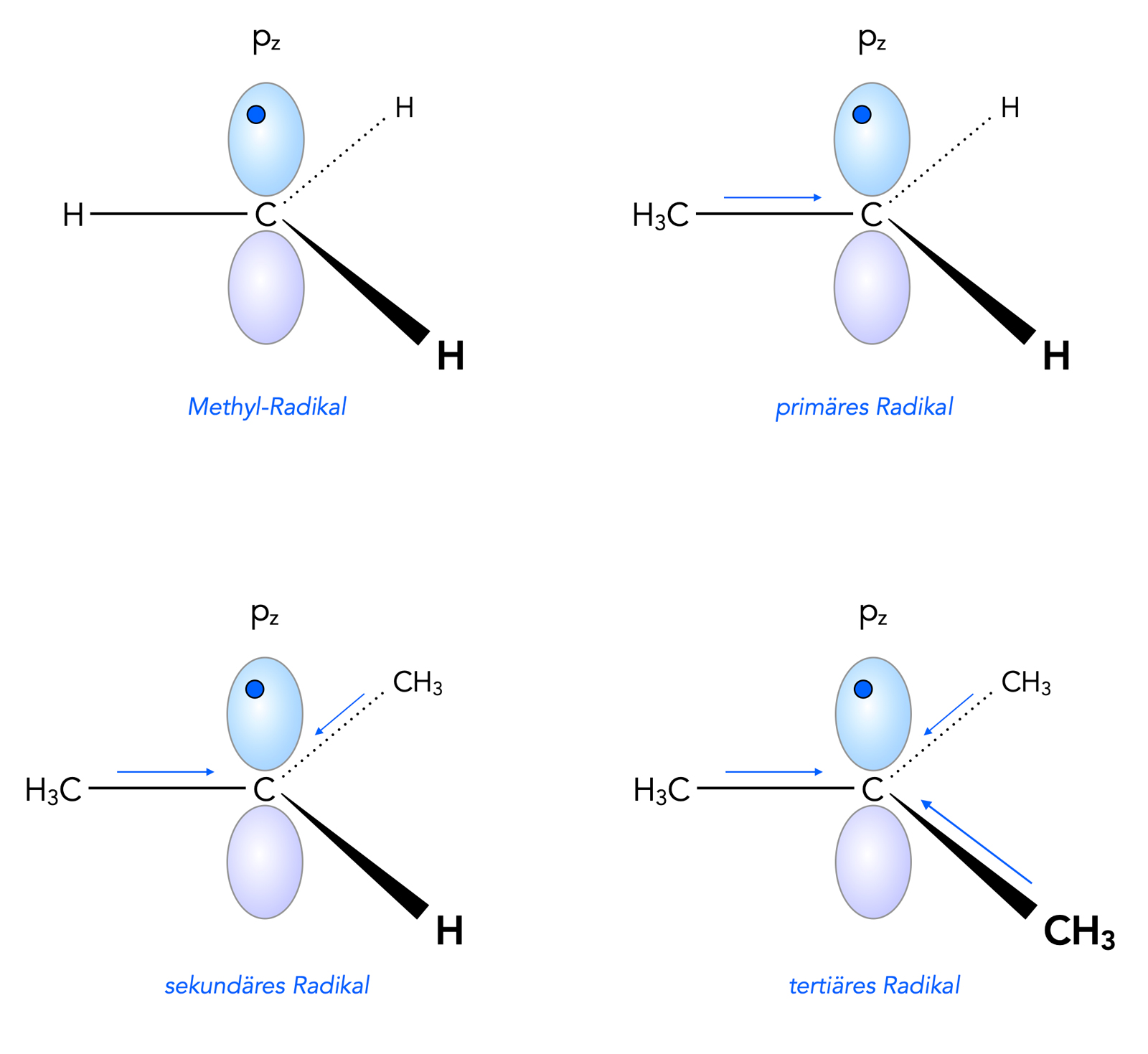
Einfluss des +I-Effekts auf die Elektronendichte im pz-Orbital eines Alkyl-Radikals.
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Ein tertiäres Radikal, beispielsweise beim 2-Methylpropan, würde sogar durch drei benachbarte C-Atome bzw. Alkylgruppen stabilisiert.
Die elektronenschiebende Wirkung der Methyl-Gruppen ist auf diesem Bild durch die dünnen blauen Pfeile dargestellt. Die Elektronendichte in den pz-Orbitalen der radikalischen C-Atome wird durch die Intensität der Blaufärbung wiedergegeben. Bei einem tertiären Radikal ist hier die Elektronendichte durch die summierten +I-Effekte der drei Methyl-Gruppen am größten. Das pz-Orbital des tertiären Radikals hat "fast" schon die gleiche hohe Elektronendichte wie ein doppelt besetztes pz-Orbital. Diese Aussage ist jetzt vielleicht etwas übertrieben, soll aber verdeutlichen, warum tertiäre Radikale so stabil sind.

Bindungsdissoziationsenergien von Radikalen
Autor: Ulrich Helmich 2024, Lizenz: Public domain
Dieses Bild zeigt noch einmal die Bindungsdissoziationsenergien für die Bildung der vier oben genannten Radikale. Um ein H-Atom aus einem Methan-Molekül zu abstrahieren, ist eine Bindungsdissoziationsenergie von 439 kJ/mol notwendig, bei einem Ethan-Molekül sind 423 kJ/mol aufzubringen, bei dem sekundären H-Atom eines Propan-Moleküls 414 kJ/mol und bei dem tertiären H-Atom von Methylpropan nur noch 404 kJ/mol. Pro Methyl-Gruppe sind grob geschätzt also 10 kJ/mol weniger Bindungsdissoziationsenergie aufzubringen.
Hyperkonjugation als Begründung
Im Chemie-Studium wird Ihnen eine weitere Erklärung für die größere Stabilität von tertiären Kohlenstoff-Radikalen präsentiert werden, nämlich das Phänomen der Hyperkonjugation.
Betrachten wir dazu das folgende Bild:
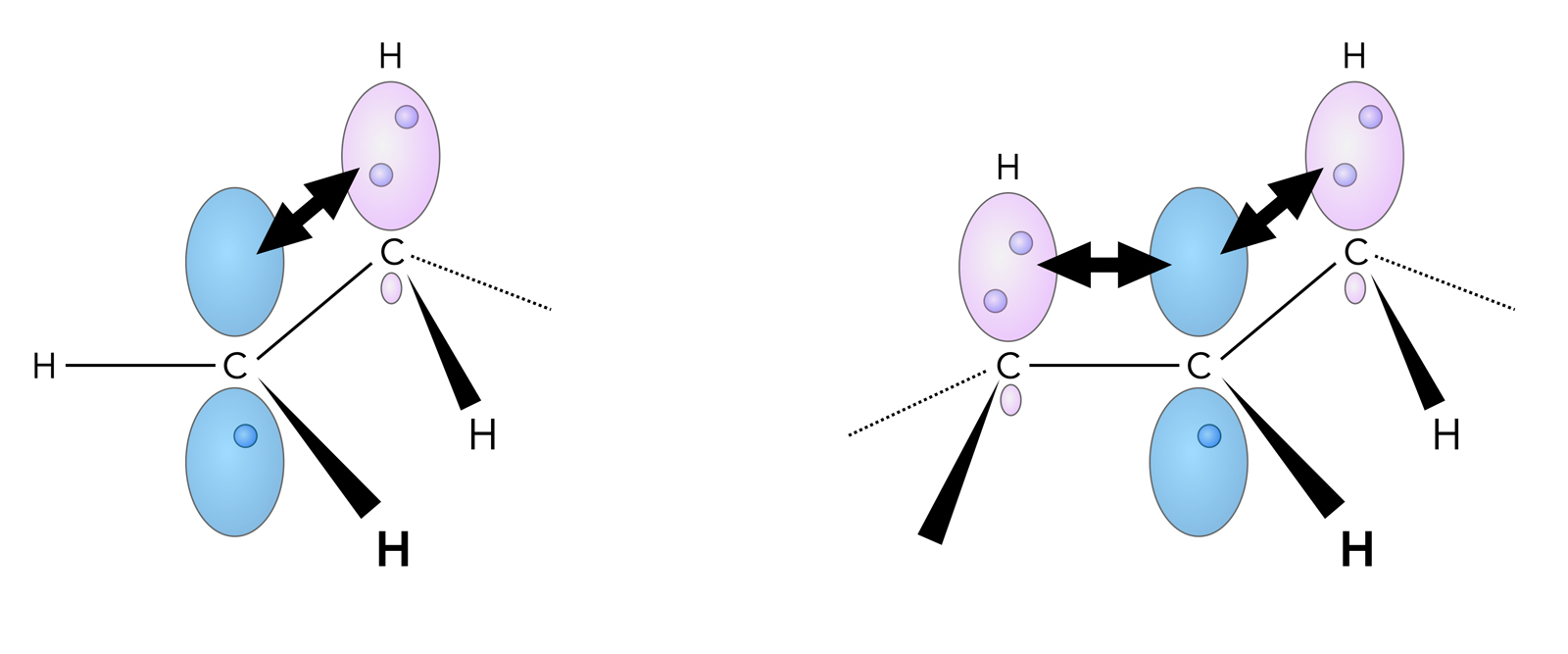
Hyperkonjugation stabilisiert pz-Orbitale
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Links sehen wir ein Ethyl-Radikal. Das pz-Orbital des radikalischen C-Atoms ist blau gekennzeichnet und enthält ein Elektron. Das bindende Orbital zwischen dem anderen C-Atom und einem der drei H-Atome ist rötlich dargestellt. Die beiden anderen C-H-Bindungsorbitale der Methyl-Gruppe wurden in dieser Zeichnung vernachlässigt bzw. sind durch einfache Striche dargestellt.
Die kovalente C-H-Bindung enthält - wie üblich - zwei Elektronen. Der schwarze Doppelpfeil deutet nun an, dass die Elektronen dieser C-H-Bindung zum Teil mit dem pz-Orbital des zweiten C-Atoms wechselwirken und so die Elektronendichte in diesem pz-Orbital erhöhen.
Rechts im Bild sehen wir das sekundäre Propyl-Radikal. Hier kann das pz-Orbital sogar mit zwei C-H-Bindungen überlappen, die Elektronendichte in dem pz-Orbital wird also stärker erhöht als in dem primären Ethyl-Radikal. Und bei einem tertiären Alkyl-Radikal (nicht im Bild dargestellt) kann das pz-Orbital sogar mit drei s-sp3-Bindungen überlappen, so dass die Elektronendichte hier noch mehr erhöht wird.
Ein weiteres Phänomen
So, nun könnte man denken, wir wären schon fertig mit den hochschulmäßigen Erklärungen zur Selektivität bei der Radikalischen Substitution. Leider nein! Betrachten Sie doch bitte noch einmal die folgende Tabelle:
| primär | sekundär | tertiär | |
| Fluorierung | 1 | 1,2 | 1,4 |
| Chlorierung | 1 | 3,7 | 5,0 |
| Bromierung | 1 | 72 | 890 |
Aufgabe:
Welches Phänomen haben wir bisher noch nicht geklärt?
Antwort:
Das Ausmaß der Selektivität hängt von dem Halogen ab, mit dem die Radikalische Substitution durchgeführt wird. Bei der Fluorierung findet man so gut wie gar keine Selektivität, bei der Chlorierung ist sie deutlich vorhanden, und bei der Bromierung sogar extrem!
5.2.3 Die Selektivität hängt von dem Halogen ab
Wie kann man nun dieses Phänomen erklären?
Einfache Erklärung (auch für Chemie-Kurse geeignet)
Das Fluor-Radikal ist derart reaktiv, dass es ihm "völlig egal" ist, ob es ein tertiäres, sekundäres oder primäres H-Atom abstrahiert. Fluor-Radikale schaffen es sogar, C-C-Einfachbindungen in den Alkan-Molekülen aufzubrechen, so reaktiv sind sie.
Das Chlor-Radikal ist nicht so reaktiv wie das Fluor-Radikal. Es kann daher nicht jede C-H-Bindung gleich schnell aufbrechen. Am schnellsten geht das mit tertiären C-H-Bindungen, am langsamsten mit primären, und noch langsamer mit den C-H-Bindungen des Methan-Moleküls. Dieser Effekt wird dann in einer geringen Selektivität sichtbar.
Das Brom-Radikal ist am wenigsten reaktiv von allen drei Radikalen. Bei niedrigen Temperaturen ist es kaum noch in der Lage, ein primäres H-Atom zu abstrahieren. Ein sekundäres H-Atom kann schon leichter abgetrennt werden, und bei tertiären H-Atomen ist die Bindungsdissoziationsenergie so gering, dass auch ein Brom-Radikal kein Problem mit einer Bindungsspaltung hat. Daher ist das Brom-Radikal deutlich selektiver als das Chlor- oder gar das Fluor-Radikal.
Fachlich korrekte Erklärung (für das Chemie-Studium)
Und wieder beginnen wir mit einer kleinen Bild-Betrachtung:
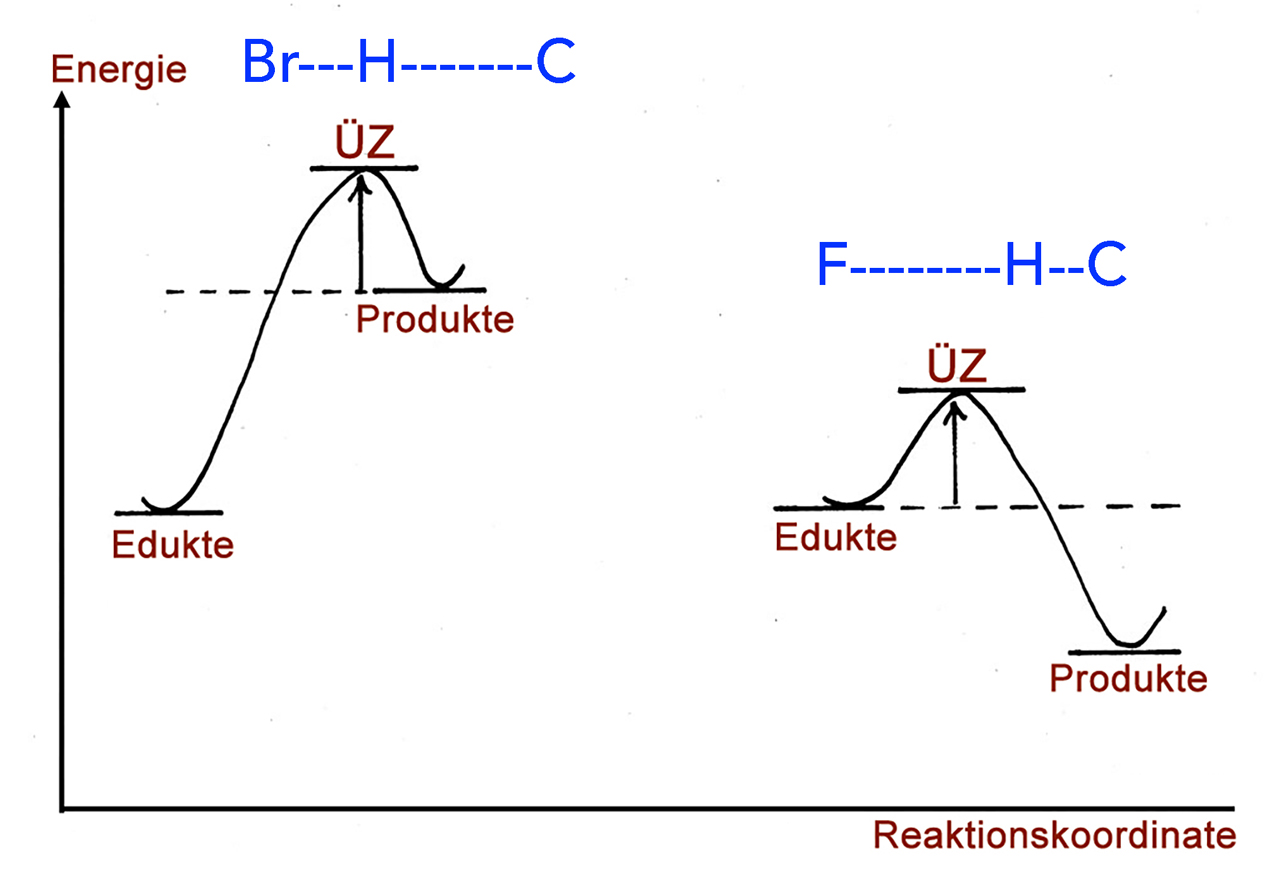
Übergangszustände der Alkan-Bromierung und -Fluorierung
Autor: Ulrich Helmich 2017, Lizenz: Public domain
Diese schon etwas ältere Abbildung zeigt den Übergangszustand des ersten Kettenfortpflanzungsschrittes bei der Bromierung (links) bzw. der Fluorierung (rechts) eines Alkans.
Aufgabe
Was fällt Ihnen auf, wenn Sie die beiden Übergangszustände vergleichen?
Antwort:
Der erste Kettenfortpflanzungsschritt der Bromierung ist endotherm, die Aktivierungsenergie ist daher recht groß, und der Schritt müsste daher recht langsam ablaufen.
Bei der Fluorierung ist der erste Kettenfortpflanzungsschritt exotherm, entsprechend niedrig ist die Aktivierungsenergie, und der Reaktionsschritt verläuft recht schnell.
Diese Antwort ist völlig richtig. Je geringer die Aktivierungsenergie einer Reaktion, desto schneller verläuft diese. Die Fluorierung von Alkanen kann schon fast explosionsartig erfolgen, daher ist eine Fluorierung auch in keiner Weise für ein Schulexperiment geeignet. Auch bei Chlorierungen sollte man sehr vorsichtig sein; in der Schule werden - so weit ich weiß - nur Bromierungen durchgeführt.
Aber diese Erkenntnis hilft uns noch nicht weiter bei der Beantwortung der Frage, warum die Bromierung wesentlich selektiver verläuft als die Chlorierung.
Aufgabe
Achten Sie auf die blau gezeichneten Übergangszustände über den Aktivierungsbergen. Was fällt Ihnen hier auf, und wie kann man das erklären?
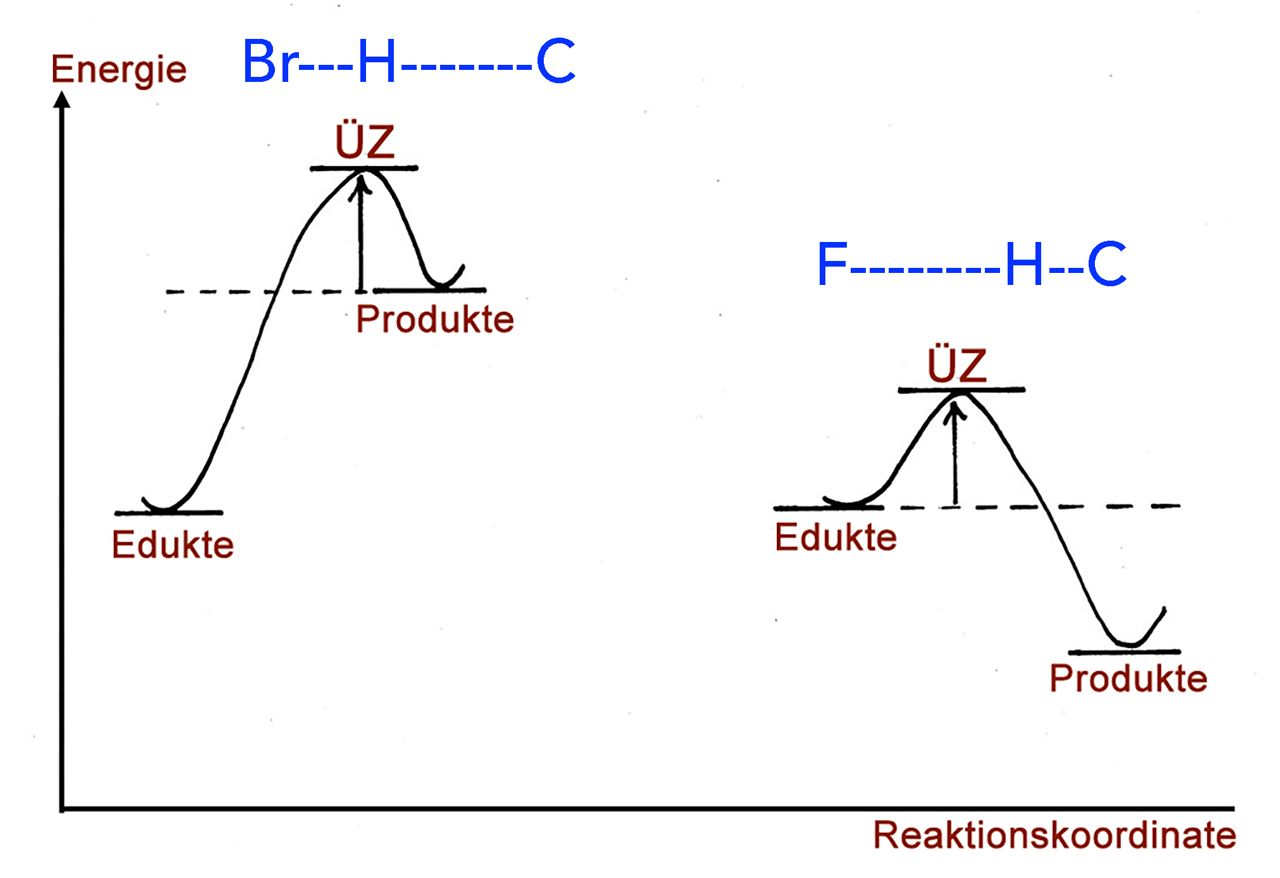
Antwort:
Beim Übergangszustand der Bromierung befindet sich das H-Atom näher am Halogen-Atom als beim Übergangszustand der Fluorierung. Hier befindet sich das H-Atom ziemlich nahe am C-Atom.
Das Hammond-Postulat
Bei der endothermen Bromierung ähnelt der Übergangszustand Br--H-------C in seiner Struktur bereits stark dem Reaktionsprodukt HBr. Bei der exothermen Fluorierung dagegen ähnelt der Übergangszustand F-------H--C noch weitgehend dem Edukt, also dem Alkan-Molekül (zum Beispiel Methan oder Ethan).
Diese Beschreibung ist nicht falsch, trifft den Nagel aber noch nicht auf den Kopf. Formulieren wir die Aussage mal etwas präziser:
Bei der endothermen Bromierung ähnelt der Übergangszustand Br--H-------C dem Zwischenprodukt •CH3, also dem Methyl- oder Alkyl-Radikal. Bei der exothermen Fluorierung dagegen ähnelt der Übergangszustand F-------H--C weiterhin stark dem Edukt CH4 bzw. dem Alkan-Molekül.
Damit wird der Zusammenhang klarer: Alkyl-Gruppen stabilisieren ein radikalisches Kohlenstoff-Atom durch den +I-Effekt bzw. durch Hyperkonjugation. Da der Übergangszustand bei der Bromierung dem Alkyl-Radikal bereits sehr ähnlich ist, wirken sich diese stabilisierenden Effekte schon im Übergangszustand deutlich aus. Ein tertiäres Radikal wird daher bei der Bromierung bereits im Übergangszustand viel stärker stabilisiert als ein primäres Radikal.
Bei der Fluorierung dagegen ähnelt der Übergangszustand noch stark dem Alkan-Molekül. Effekte, die Radikale stabilisieren, kommen hier erst in geringerem Maße zur Geltung. Entsprechend ist die Selektivität der Fluorierung deutlich geringer als die der Bromierung.
Hammond-Postulat
Der Übergangszustand ähnelt energetisch und strukturell demjenigen Teilchen (Edukt oder Produkt), dem er energetisch am nächsten liegt: Bei endothermen Reaktionen ähnelt er dem Produkt, bei exothermen Reaktionen dem Edukt.
Hier zum Abschluss noch einmal eine anschauliche Darstellung des Zusammenhangs zwischen Selektivität und Reaktivität: Je reaktiver die Halogenierung, desto weniger selektiv ist sie.
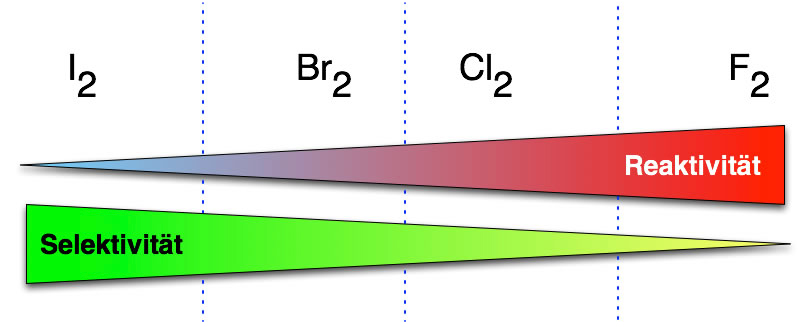
Je größer die Reaktivität, desto kleiner die Selektivität
Autor: Ulrich Helmich 2017, Lizenz: Public domain
Auf dieser Vertiefungsseite wird dargelegt, warum die Fluorierung von Alkanen zwar funktioniert, aber nicht ratsam ist, und wieso die direkte Iodierung meistens nicht gelingt und welche Alternativen es dazu gibt.
Diese Vertiefungsseite ist etwas für Spezialisten. Hier wird mit Hilfe der Molekülorbital-Theorie (MO-Theorie) erklärt, was eigentlich bei der Photolyse von Chlor- oder Brom-Molekülen passiert.
5.2.4. Thermodynamische und kinetische Kontrolle
Jetzt müssen wir noch zwei Fachbegriffe besprechen, die im Chemie-Studium immer wieder eine wichtige Rolle spielen. Was versteht man unter thermodynamischer bzw. kinetischer Kontrolle einer Reaktion?
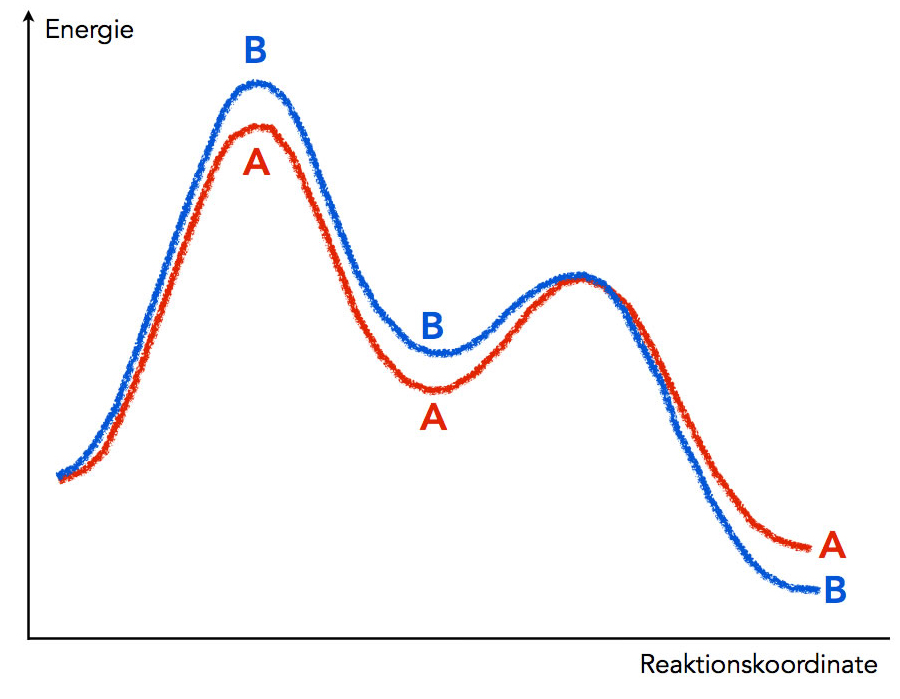
A: Kinetische Kontrolle, B: Thermodynamische Kontrolle
Autor: Ulrich Helmich 2017, Lizenz: Public domain
Betrachten wir dazu die beiden Energiediagramme A und B. Bei Reaktion B (blau dargestellt) ist die Aktivierungsenergie des ersten Schrittes höher als bei Reaktion A, dafür ist die gesamte Reaktionsenthalpie bei B stärker negative als bei A.
Man kann Reaktion A daher als exotherme Reaktion mit vergleichsweise niedriger Aktivierungsenergie charakterisieren, Reaktion B hingegen als stärker exotherme Reaktion mit höherer Aktivierungsenergie.
Nun nehmen wir an, dass es sich bei A und B um Konkurrenzreaktionen handelt. Die Edukte sind in beiden Fällen identisch, es entstehen jedoch unterschiedliche Produkte.
Solche Konkurrenzreaktionen haben wir beispielsweise bei der Halogenierung von Alkanen kennengelernt. Bei der Bromierung von Propan entstehen zwei Produkte, nämlich 1-Brompropan und 2-Brompropan. Beide Reaktionen laufen gleichzeitig ab und konkurrieren um das Brom.
Konkurrenzreaktionen bei niedrigen Temperaturen
Bei niedrigen Temperaturen verlaufen beide Reaktionen insgesamt langsamer als bei hohen Temperaturen, wie es auch durch die RGT-Regel beschrieben wird. Entscheidend ist hier jedoch der geschwindigkeitsbestimmende Schritt, also der Reaktionsschritt mit der höchsten Aktivierungsenergie.
Da die Aktivierungsenergie dieses Schrittes bei Reaktion A etwas niedriger ist als bei Reaktion B, verläuft Reaktion A bei niedrigen Temperaturen schneller. Unter diesen Bedingungen entstehen daher bevorzugt die Produkte der Reaktion A.
Die Konkurrenzreaktionen bei hohen Temperaturen
Bei hohen Temperaturen steht den reagierenden Teilchen ausreichend thermische Energie zur Verfügung, um auch höhere Aktivierungsbarrieren zu überwinden. Die Unterschiede in den Aktivierungsenergien spielen dann eine geringere Rolle.
Unter diesen Bedingungen wird bevorzugt das Produkt gebildet, das energetisch stabiler ist, also das Produkt der stärker exothermen Reaktion. In unserem Fall ist dies das Produkt der Reaktion B, da hier die Reaktionsenthalpie stärker negativ ist.
Thermodynamische und kinetische Kontrolle
Hängt der Verlauf einer Reaktion hauptsächlich von der Höhe der Aktivierungsenergie des geschwindigkeitsbestimmenden Schrittes ab, spricht man von kinetischer Kontrolle. Eine kinetische Kontrolle liegt typischerweise bei niedrigen Temperaturen vor.
Hängt der Reaktionsverlauf dagegen von der energetischen Stabilität der Produkte, also von der Reaktionsenthalpie, ab, spricht man von thermodynamischer Kontrolle. Diese tritt in der Regel bei hohen Temperaturen auf.
5.3 Übungen
Die folgenden Übungen wurden in Anlehnung an die Aufgaben, Übungen etc. der unten aufgeführten Fachbücher erstellt. Die Sternchen an den Aufgaben deuten den Schwierigkeitsgrad an.
Die Lösungen der Aufgaben können Sie sich hier kostenlos herunterladen. Wenn Sie dennoch einen kleinen Betrag spenden möchten, wäre ich Ihnen sehr dankbar.
Aufgabe 5.1*
Berechnen Sie die prozentualen Anteile der Monochlorierungs-Produkte von Methylbutan.
Aufgabe 5.2*
Nennen Sie zwei Gründe, warum man in der chemischen Industrie Alkane meistens chloriert, aber nur selten bromiert.
Für die nächsten beiden Aufgaben benötigen wir noch eine paar Daten, die im Text noch nicht erwähnt wurden, nämlich die Aktivierungsenergien der Kettenfortpflanzungsschritte der Chlorierung und der Bromierung.
| Kettenfortpflanzungsschritt 1 | Kettenfortpflanzungsschritt 2 | |
| Chlorierung | 17 kJ/mol | > 0 kJ/mol |
| Bromierung | 82 kJ/mol | > 0 kJ/mol |
Die Reaktionsenthalpien der beiden Kettenfortpflanzungsschritt stehen in der nächsten Tabelle:
| Kettenfortpflanzungsschritt 1 | Kettenfortpflanzungsschritt 2 | |
| Chlorierung | 8 kJ/mol | -113 kJ/mol |
| Bromierung | 75 kJ/mol | -100 kJ/mol |
Kommen wir nun zu den nächsten Aufgaben.
Aufgabe 5.3**
Zeichnen Sie die Energiediagramme für die Chlorierung und für die Bromierung von Ethan maßstabsgerecht auf.
Aufgabe 5.4**
Man stellt ein Gasgemisch aus 0,1 mol Chlor und 0,1 mol Brom her und lässt dieses Gemisch mit einem Überschuss an Ethan reagieren, so dass nur Monochlor- bzw. Monobrom-Produkte entstehen.
Begründen Sie, wieso bei dieser Reaktion fast ausschließlich Chlorethan gebildet wird (> 99,99%).
Aufgabe 5.5***
Pentan wird mit einer kleinen Menge Brom versetzt, so dass fast ausschließlich Monobromierungsprodukte gebildet werden.
Berechnen Sie die prozentualen Anteile der Monochlorierungs-Produkte
Für die nächsten beiden Aufgaben müssen Sie sich zunächst die folgende Graphik anschauen:
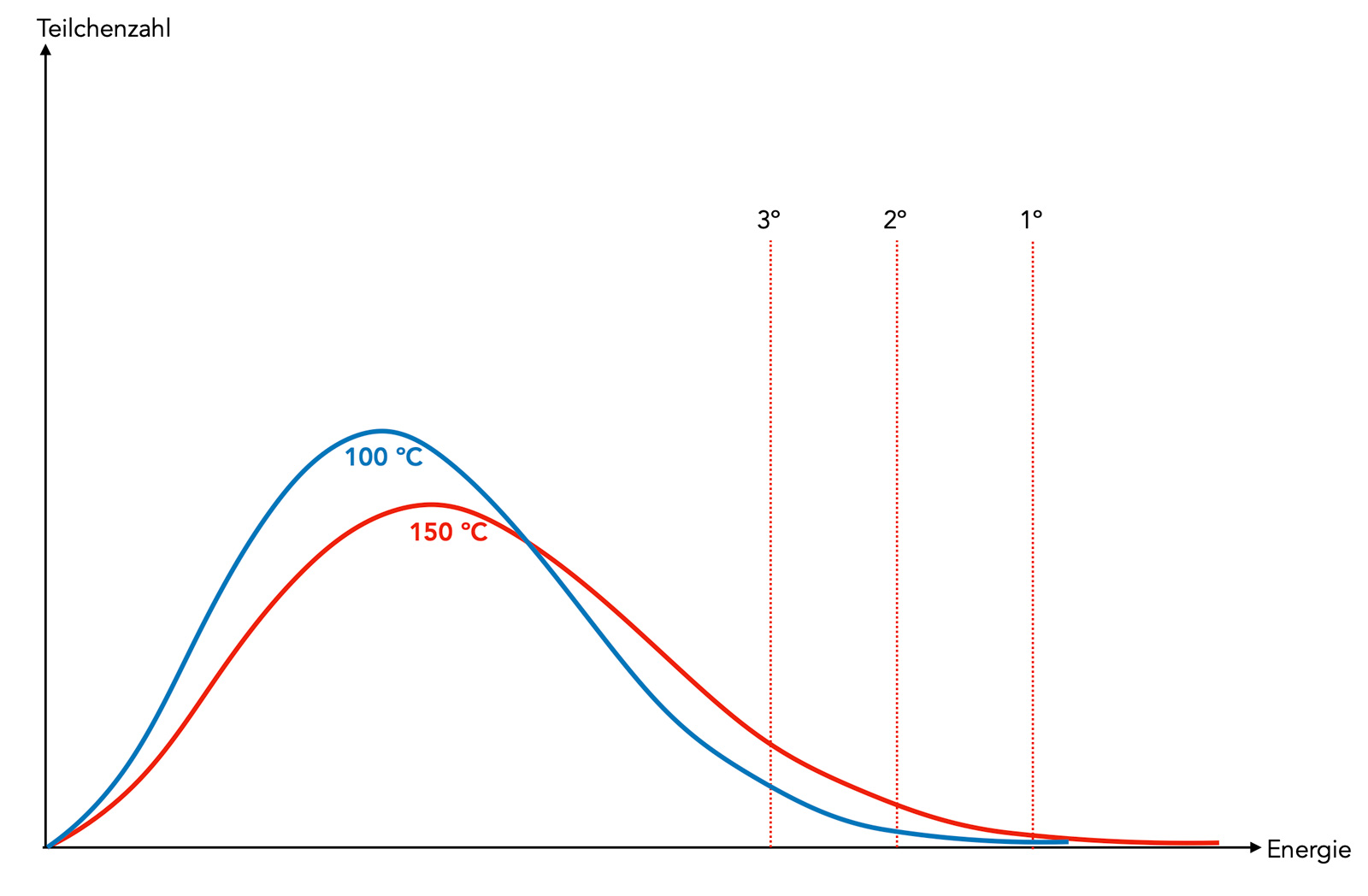
Graphik zu den Aufgaben 5.6 und 5.7
Autor: Ulrich Helmich 2023, Lizenz: Public domain
Die waagerechte Achse des Diagramms zeigt die kinetische Energie EKin von Teilchen, und die senkrechte Achse zeigt die Anzahl der Teilchen, die gerade diese Energie besitzen. Die kinetische Energie eines Teilchens berechnet sich aus der Masse m und der Geschwindigkeit v des Teilchens, es gilt $E_{kin} = mv^2$. Die drei senkrechten Linien stehen für die Aktivierungsenergien, die für die Abstraktion tertiärer, sekundärer bzw. primärer H-Atome aus einem Alkan-Molekül aufzuwenden sind.
Aufgabe 5.6***
a) Beschreiben Sie allgemein die obige Abbildung und die Erkenntnisse, die man aus dem Verlauf der beiden Graphen ziehen kann.
b) Analysieren Sie, welche Auswirkungen eine Temperaturerhöhung auf die Selektivität der Radikalischen Substitution hat.
In der nächsten Aufgabe geht es ebenfalls um die Selektivität bei der Radikalischen Substitution.
Aufgabe 5.7***
Ein 1:1-Gemisch aus 2-Chlor-2-methylpentan und 2-Iod-2-methylpentan wird mit Bromwasser versetzt und belichtet.
Unter anderem bilden sich die sekundären Reaktionsprodukte 3-Brom-2-chlor-2-methylpentan und 3-Brom-2-iod-methylpentan.
Eines dieser beiden Produkte bildet sich wesentlich schneller und hat damit einen höheren prozentualen Anteil im Produktgemisch. Ermitteln Sie, welches Produkt sich schneller bildet und begründen Sie Ihre Meinung.
Aufgabe 5.8***

Die Tabelle enthält Daten zur Selektivität von Halogenen bei der Radikalischen Substitution verschiedener H-Atome bei unterschiedlichen Temperaturen.
Fassen Sie die Aussagen dieser Tabelle zusammen und begründen Sie die Abhängigkeit der Selektivität von den einzelnen Faktoren.
Aufgabe 5.9***
Unter einer "synthetisch nützlichen Reaktion" versteht man in der industriellen Chemie eine Reaktion, bei der hauptsächlich ein Hauptprodukt mit hoher Ausbeute entsteht und möglichst wenig Nebenprodukte. Und wenn schon Nebenprodukte entstehen, so sollte man diese leicht vom Hauptprodukt abtrennen können.
Beurteilen Sie nun bitte, ob die Chlorierung von Methyl-cyclopentan bei 25 ºC eine synthetisch nützliche Reaktion ist.
Aufgabe 5.10****
a) Recherchieren Sie die Struktur des Insektizids DDT.
b) Beurteilen Sie, ob man DDT durch radikalische Chlorierung aus der Verbindung 1,1-Diphenyl-ethanherstellen kann. Berücksichtigen Sie dabei auch ökonomische Aspekte (relative Ausbeute von DDT).
Die Lösungen der Aufgaben können Sie sich hier kostenlos herunterladen. Wenn Sie dennoch einen kleinen Betrag spenden möchten, wäre ich Ihnen sehr dankbar.
Quellen und Literatur-Empfehlungen:
- VollhardT, Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- Morrison, Boyd, Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.