7.1 Rekapitulation Schulwissen
Die Elektrophile Addition haben Sie mit Sicherheit im Schulunterricht kennen gelernt, vielleicht nur oberflächlich als Nachweis der C=C-Doppelbindung mit Bromwasser, vielleicht aber auch gründlich mit Eingehen auf den Reaktionsmechanismus der Hydrobromierung und Bromierung (Bildung von Bromonium-Ionen, Rückseiten-Angriff, um nur zwei Stichworte zu nennen).
Die C=C-Doppelbindung zeichnet sich durch eine hohe Elektronendichte aus, die vor allem auf die beiden pi-Elektronen zurückzuführen ist. Dadurch werden elektrophile Teilchen (positiv geladene Ionen wie H+ oder Moleküle mit positiv polarisierten H-Atomen wie H2O oder NH3) angezogen. Diese H-Atome werden als Protonen abgespalten und setzen sich dann an die C=C-Doppelbindung, wobei sich ein Carbenium-Ion bildet:
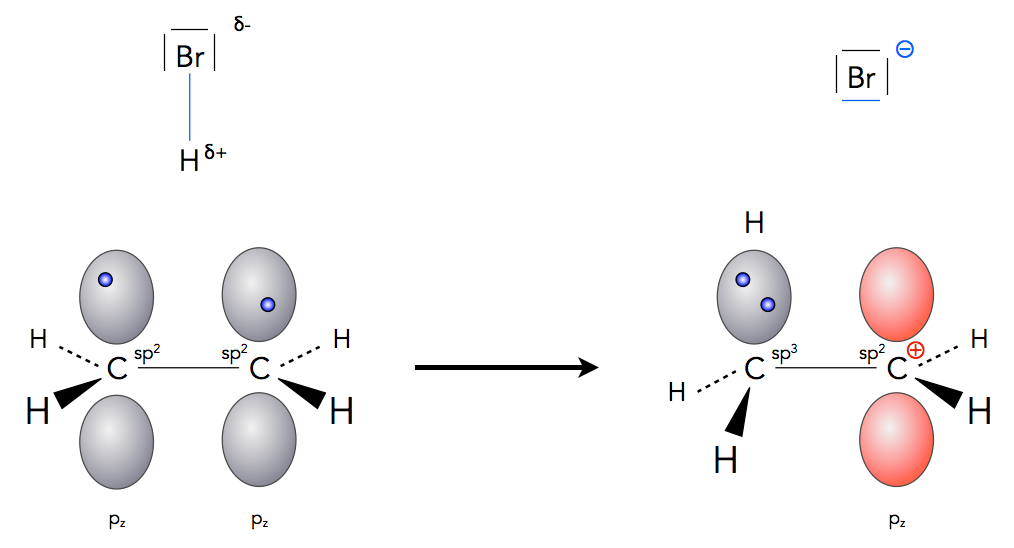
Die Bildung des Carbenium-Ions bei der Hydrobromierung in der Gasphase
Autor: Ulrich Helmich 2020, Lizenz: Public domain.
In einem zweiten Reaktionsschritt wird das gebildete Carbenium-Ion dann von einem Nucleophil angegriffen, bei der Hydrobromierung von einem Bromid-Ion.
Nach dem gleichen Muster läuft die Hydratisierung eines Alkens ab: Ein Wasser-Molekül (oder ein Hydronium-Ion) gibt ein Proton an die C=C-Doppelbindung ab, an das entstandene Carbenium-Ion setzt sich dann ein Hydroxid-Ion als Nucleophil.
Bei diesen Reaktionen ist die Markownikoff-Regel zu beachten: Wenn es mehrere Möglichkeiten zur Addition eines Protons gibt, bildet sich stets das stabilere Carbenium-Ion. Wenn also eine Verbindung wie 2-Methyl-but-2-en ein Proton aufnimmt, entsteht das tertiäre Carbenium-Ion, das Bromid-Ion setzt sich dann nicht an das C3-Atom, sondern an das positiv geladene C2-Atom.
Die Bromierung eines Alkens verläuft nach einem etwas komplexeren Mechanismus. Die elektronenreiche C=C-Doppelbindung polarisiert das an sich neutrale Br2-Molekül, es bildet sich ein temporärer Br2-Dipol. Mit seinem positiven Ende nähert sich dieser der Doppelbindung, das Brom-Molekül wird heterolytisch gespalten, und das Br+-Ion setzt sich an die Doppelbindung:
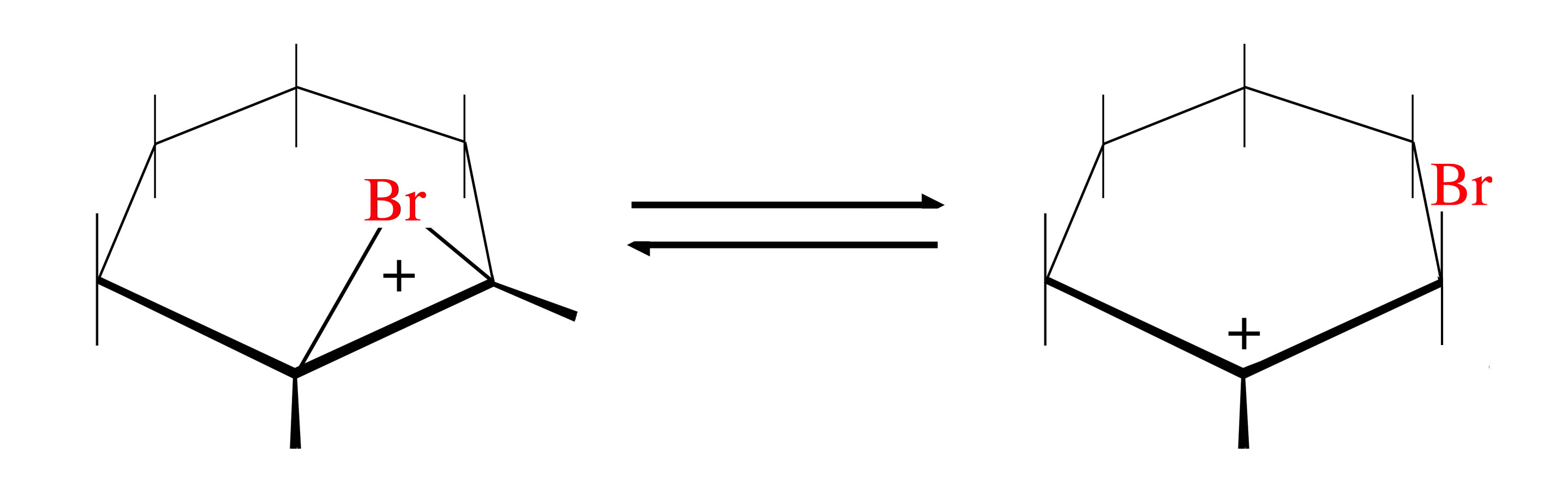
Gleichgewicht zwischen Bromonium-Ion und Carbenium-Ion
Autor: Ulrich Helmich 2020, Lizenz: Public domain.
Hier sehen wir das Bromonium-Ion, dass sich nach Addition eines Br+-Ions an Cyclohexen gebildet hat. Dieses Ion steht im Gleichgewicht mit dem entsprechenden Carbenium-Ion.
Es folgt dann ein Rückseitenangriff eines Nucleophils, aber das alles kennen Sie ja hoffentlich bereits aus dem Schulunterricht.
Wenn Sie meinen, dass Sie doch nicht ganz so fit sind mit der elektrophilen Addition, gehen Sie doch bitte auf die Seiten, die ich für Schüler(innen) der Sek. II geschrieben habe.
7.2 Studienvorbereitung
Normalerweise wird die elektrophile Addition in der Schule schon recht gründlich behandelt, unter anderem auch, weil diese Reaktion im Chemie-Abitur eine wichtige Rolle spielt. Aber die Kapitel zu diesem Reaktionsmechanismus sind in allen Hochschul-Lehrbüchern sehr umfangreich, daher wollen wir doch einmal schauen, was es dort an zusätzlichen Informationen gibt, die für die Vorbereitung des Chemie-Studiums nützlich sein könnten.
7.2.1 Energetische Betrachtungen
Die meisten Additionen an die C=C-Doppelbindung laufen exotherm ab. Warum das so ist, wollen wir einmal an ein paar typischen Beispielen studieren. Als Alken nehmen wir dazu einfach das Ethen, das einfachste Alken überhaupt. Die Bindungsdissoziationsenthalpie der C=C-Doppelbindung beträgt 272 kJ/mol, das ist nicht sehr viel.
Die folgende Tabelle zeigt ein paar weitere für unsere Betrachtungen wichtige Bindungsdissoziationsenthalpien [2]:
| Bindung | Bindungsdissoziationsenthalpie in kJ/mol |
| H-H | 435 |
| Br-Br | 192 |
| H-Cl | 431 |
| H-O | 498 |
| C-H | 422 |
| C-Br | 293 |
| C-Cl | 351 |
| C-O |
393 |
Schauen wir uns nun die Energiebilanz einiger typischer Additionsreaktionen an.
Hydrierung
Bei der Addition von Wasserstoff muss zunächst die C=C-Doppelbindung teilweise gespalten werden (genauer gesagt: die pi-Bindung), was einen Betrag von 272 kJ/mol erfordert. Auch die H-H-Bindung muss aufgebrochen werden, dafür sind noch einmal 435 kJ/mol erforderlich. Insgesamt sind also 707 kJ/mol an Bindungsdissoziationsenthalpie aufzuwenden.
Bei der Bildung des Reaktionsproduktes Ethan entstehen zwei neue C-H-Bindungen, dabei werden 844 kJ/mol freigesetzt.
Insgesamt beträgt die Reaktionsenthalpie der Hydrierung -137 kJ/mol.
Weitere Einzelheiten zur Hydrierung von Alkenen finden Sie auf dieser Seite.
Bromierung
Schauen wir uns nun die Bromierung an, also die Addition von Br2 an Ethen. Hier sind einmal wieder 272 kJ/mol für die C=C-Doppelbindung sowie 192 kJ/mol für die Br-Br-Bindung aufzuwenden, insgesamt also 464 kJ/mol.
Bei der Bildung des Reaktionsproduktes 1,2-Dibromethan entstehen zwei C-Br-Bindungen, dabei werden 586 kJ/mol freigesetzt.
Insgesamt beträgt die Reaktionsenthalpie der Bromierung -122 kJ/mol.
Hydratisierung
Zum Schluss noch einmal die gleiche Berechnung für die Addition von Wasser an Ethen. Aufzuwenden sind 272 + 498 = 770 kJ/mol, frei gesetzt werden 422 + 393 = 815 kJ/mol, die Reaktionsenthalpie beträgt also -45 kJ/mol, das ist etwas weniger als bei der Hydrierung oder der Bromierung, aber immer noch deutlich exotherm.
7.2.2 Die Hydrierung von Alkenen
Obwohl die Addition von Wasserstoff an die C=C-Doppelbindung eines Alkens ein exothermer Prozess ist, läuft die Reaktion selbst bei Temperaturen um 200 ºC nicht spontan ab. Bei Zimmertemperatur findet die Reaktion nur in Anwesenheit eines Katalysators statt, der sowohl den Wasserstoff wie auch das Alken auf seiner Oberfläche bindet. Zuerst wird nur ein H-Atom an eines der beiden C-Atome der Doppelbindung angehängt, im nächsten Schritt das zweite H-Atom. Dabei löst sich das entstandene Alkan von der Katalysatoroberfläche.
Auf dieser Vertiefungsseite wird die Addition von Wasserstoff an Alkene näher beschrieben, auch der katalytische Prozess wird näher beschrieben. Auch die Energiebetrachtungen werden vertieft.
Wenn ein solcher Feststoff-Katalysator (Palladium, Platin etc.) eingesetzt wird, findet immer eine sogenannte syn-Addition statt. Das heißt, beide H-Atome werden auf die gleiche Seite der Doppelbindung addiert. Bei offenkettigen Alkenen macht das wegen der freien Drehbarkeit um die entstandene C-C-Einfachbindung keinen Unterschied, wohl aber bei Cycloalkenen, wo es ja keine freie Drehbarkeit gibt.
Auf dieser Vertiefungsseite wird die Addition von Bromwasserstoff an Alkene näher beschrieben, auch auf die Markownikow-Regel wird näher eingegangen.
7.2.3 Die Sulfonierung von Alkenen
Diese Additionsreaktion wird im Schulunterricht nur sehr selten besprochen, spielt aber bei der Synthese organischer Verbindungen eine wichtige Rolle. Es geht um die Addition von Schwefelsäure an die C=C-Doppelbindung.
Der erste Schritt ist ähnlich wie bei der Hydrobromierung die Addition eines Protons an die Doppelbindung, und auch hier bildet sich ein Carbenium-Ion als Zwischenprodukt.

Die Sulfonierung von But-1-en
Autor: Ulrich Helmich 02/2023, Lizenz: Public domain
Auf diesem Bild sehen wir die Sulfonierung von Buten und die anschließende Umsetzung des Reaktionsprodukts zum Alkohol Butan-2-ol.
- Addition eines Protons an die Doppelbindung
- Addition des Sulfat-Anions an das positive C-Atom des Zwischenprodukts
- Hydrolyse der S-O-Bindung und Bildung eines Alkohols. Freisetzung der Schwefelsäure.
In der chemischen Industrie wird die Sulfonierung von Alkenen in der Tat hauptsächlich zur Produktion bestimmter Alkohole eingesetzt. Die Alkene kann man recht leicht aus Erdöl oder Erdgas gewinnen, und Schwefelsäure ist ein recht preiswertes Grundprodukt der Industrie. Die Reaktion selbst kann recht einfach durchgeführt werden, im einfachsten Fall leitet man das gasförmige Alken in die Schwefelsäure ein, oder ein flüssiges Alken wird mit der Schwefelsäure verrührt. Bei der Hydrolyse in Schritt 3 muss dann etwas erhitzt werden [4], die Sulfonierung an sich (Schritte 1 und 2) läuft dagegen bei Zimmertemperatur ab.
7.2.4 Die Hydratisierung von Alkenen
Reines Wasser reagiert nicht mit einem Alken. Ein Gemisch aus Cyclohexen und Wasser kann theoretisch jahrelang in einem Reagenzglas aufbewahrt werden, ohne dass eine nennenswerte Reaktion einsetzt. Erst wenn man einen Protonen spendenden Katalysator zusetzt, beginnt die Reaktion. Gern eingesetzt werden Schwefelsäure oder Salpetersäure als saurer Katalysator.
Die Addition von Wasser verläuft nach einem ähnlichen Reaktionsmechanismus wie die Hydrobromierung oder die Sulfonierung:
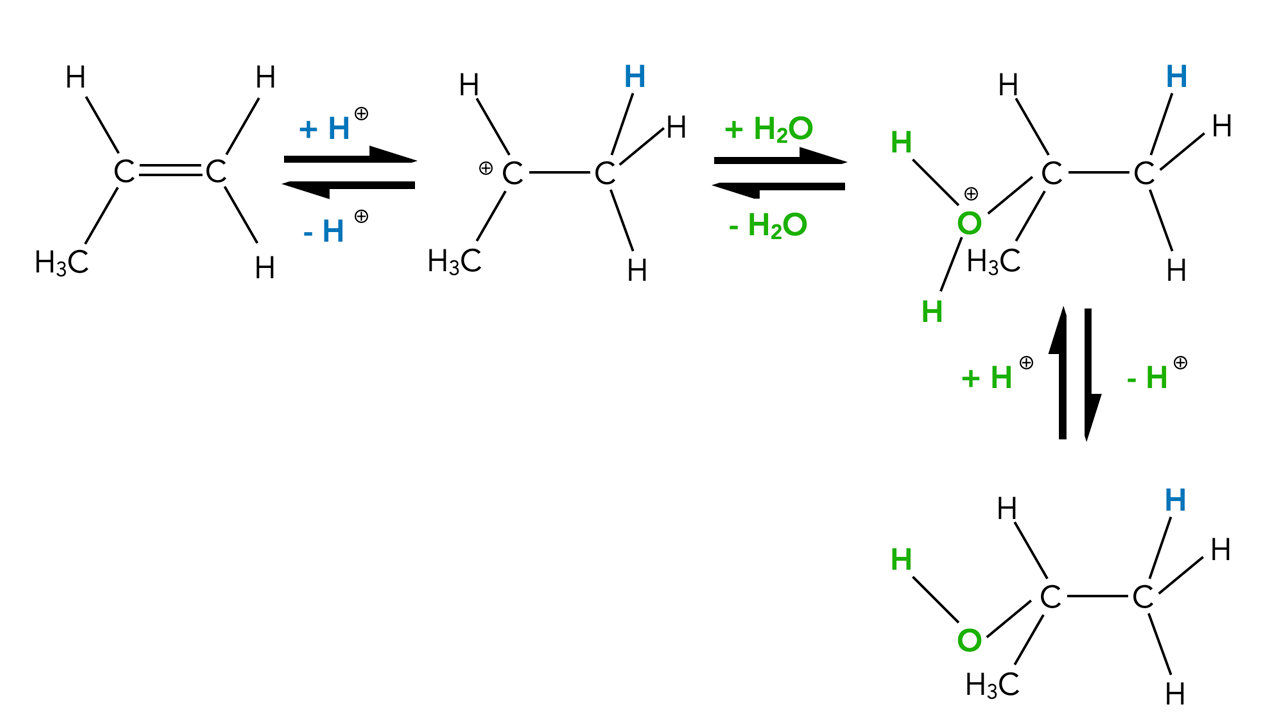
Säurekatalysierte Hydratisierung von Propen
Autor: Ulrich Helmich 2022, Lizenz: Public domain
Das aus der Säure stammende Proton lagert sich an das Alken an und bildet ein Carbenium-Ion. Als Nucleophil greift aber kein Hydroxid-Ion an, sondern Wasser H2O. Es entsteht ein instabiles Zwischenprodukt mit einer -OH2+-Gruppe. Diese Gruppe (vergleichbar mit dem Oxonium-Ion) gibt nun ein Proton ab, und dann haben wir wieder einen Alkohol als Endprodukt.
Im ersten Schritt der Reaktionskette wurde ein Proton hinzugefügt, im letzten Schritt wurde eines abgegeben. In der Gesamtgleichung tauchen diese Protonen daher nicht auf, und rein formal handelt es sich um eine saure Katalyse. Die Protonen nehmen zwar an der Reaktion teil, tauchen aber nicht in der Gesamtgleichung auf.
Wie man an den Reaktionspfeilen sehen kann, sind alle drei Einzelschritte dieser Reaktion Gleichgewichtsreaktionen. Das heißt, aus einem Alkohol kann man auch wieder ein Alken gewinnen.
Formal handelt es sich bei der Umkehrreaktion um eine Eliminierungsreaktion, genauer gesagt, um eine E1-Eliminierung.
Auf dieser Seite erfahren Sie weitere Einzelheiten zu diesem Reaktionstyp.
Das chemische Gleichgewicht dieser Reaktion lässt sich durch die Reaktionsbedingungen beeinflussen. Bei niedrigen Temperaturen und einem hohen Überschuss an Wasser wird das Gleichgewicht auf die Seite des Alkohols verschoben. Durch hohe Temperaturen und Verwendung konzentrierter Säure verschiebt sich das Gleichgewicht dagegen auf die Seite des Alkens.
7.2.5 Die Bromierung von Alkenen
Kommen wir nun zu einer etwas komplexeren Reaktion, der Addition des völlig unpolaren Brom-Moleküls an die C=C-Doppelbindung. Das Problem liegt darin, dass das Br2-Molekül völlig unpolar ist und somit überhaupt keine "Neigung" besitzt, sich von der elektronenreichen C=C-Doppelbindung anziehen zu lassen, geschweige denn mit der Doppelbindung zu reagieren. Dennoch kennt jeder und jede den bekannten Schulversuch, bei dem man Brom oder Bromwasser zu einem flüssigen Alken wie Hexen oder Cyclohexen gibt und dann erstaunt feststellt, dass sich das braune Gemisch in kurzer Zeit völlig entfärbt.
Dass eine solche Reaktion sogar bei Zimmertemperatur spontan und schnell abläuft, liegt daran, dass die C=C-Doppelbindung einen geringen Dipol-Charakter hat. Alkene wie cis-But-2-en sind schwache permanente Dipole, die in unpolaren Molekülen, die sich in der Nähe befinden, temporäre Dipolmomente induzieren können. Und genau das passiert mit den Brom-Molekülen, die sich zufällig in der Nähe der Doppelbindung befinden.
Mit seinem positiv polarisierten Br-Atom setzt sich das Br2-Molekül nun in die pi-Elektronenwolke der C=C-Doppelbindung, es bildet sich ein pi-Komplex, der schnell in ein Bromonium-Ion übergeht. Dieses besteht aus dem heterolytisch abgespaltenen positiv geladenem Brom-Atom sowie den beiden C-Atomen der Doppelbindung. Die beiden Elektronen dieses Bromonium-Ions sind delokalisiert, halten sich also sowohl bei den beiden C-Atomen wie auch beim Br-Atom auf. Im nächsten Schritt erfolgt dann der Rückseiten-Angriff eines Bromid-Anions, und fertig ist das Endprodukt der Bromierung. Aber das alles sollten Sie eigentlich aus dem Schulunterricht kennen, wenn dieser ordentlich durchgeführt wurde.
Diese Seite wurde speziell für Schüler(innen) der gymnasialen Oberstufe geschrieben. Wenn Sie also noch Nachholbedarf haben, schauen Sie sich doch einfach die Ausführungen auf dieser Seite an.
Auf dieser Seite erfahren Sie die Einzelheiten der Reaktion und es werden auch Belege für den Ablauf des Reaktionsmechanismus behandelt.
7.2.6 Die Stereochemie der Addition
Bei symmetrischen Alkenen wie Ethen spielt es keine Rolle, ob die Addition nach einem syn- oder anti-Mechanismus verläuft oder ob die angreifenden Teilchen die C=C-Doppelbindung bei einer syn-Addition von "oben" oder von "unten" angreifen. Bei unsymmetrischen Alkenen ist das allerdings anders, hier können Stereoisomere entstehen. Der einfachste Fall, der auch manchmal im Schulunterricht behandelt wird, ist die Addition von Brom an Cyclohexen. Hier entsteht hauptsächlich das trans-Produkt trans-1,2-Dibrom-cyclohexan, was ein Beweis für den Rückseiten-Angriff des Bromid-Anions ist.
Viele Fälle der Addition an unsymmetrische Alkene sind nicht ganz so einfach zu verstehen, daher wurde das Thema in diese Vertiefungsseite ausgelagert.
7.3 Was sagt die Fachliteratur?
Jedes Hochschul-Fachbuch widmet diesem Reaktionsmechanismus ein oder zwei umfangreiche Kapitel. Neben dem Grund-Mechanismus werden die einzelnen Additionstypen wie Hydrierung, Hydrohalogenierung, Halogenierung, Hydratisierung und was es nicht alles gibt eingehend besprochen. Auch auf die Stereochemie der Addition wird durchweg intensiv eingegangen.
7.4 Übungen
Die folgenden Aufgaben sind in Anlehnung an entsprechende Aufgaben aus der Fachliteratur entstanden. Einige Aufgaben setzen ein Studium der Vertiefungsseiten (Hydrierung, Hydrobromierung, Bromierung, Stereochemie, cis-trans-Isomerie) voraus.
Die Lösungen dieser Aufgaben und der Aufgaben der Kapitel 1 und 2 (Alkane, Cycloalkane) können Sie gegen eine Kostenbeteiligung von 5 Euro über Paypal als PDF-Datei von mir erhalten (einfach auf den Spenden-Button klicken und als Verwendungszweck "Lösungen Organik 1-3" angeben).
Wir beginnen mit einer Aufgabe aus der Dyker-Vorlesung "Organische Chemie 1.33".
Aufgabe 7.1
Die Interhalogen-Verbindung Br-Cl soll an Propen addiert werden. Welches Halogenium-Ion wird sich dabei als Zwischenprodukt bilden, das Bromonium-Ion oder das Chloronium-Ion?
Und wir machen noch etwas weiter mit der Br-Cl-Addition:
Aufgabe 7.2
Begründen Sie, wieso bei der Addition von Br-Cl an Propen hauptsächlich 1-Brom-2-Chlor-propan entsteht und nicht 2-Brom-1-Chlor-propan.
Quellen:
- M. A. Fox, J. K. Whitesell: Organische Chemie - Grundlagen, Mechanismen, bioorganische Anwendungen. 1. Auflage, Heidelberg 1995.
- K. P. C. Vollhard, N.E. Schore: Organische Chemie. 6. Auflage, Weinheim 2020.
- J. Clayden, N. Greeves, S. Warren: Organische Chemie. Berlin 2013.
- R. T. Morrison, R. N. Boyd, S. K. Bhattacharjee: Organic Chemistry. 7. Auflage, Dorling Kindersley 2011.
- Buddrus, Schmidt, Grundlagen der Organischen Chemie, 5. Auflage, De Gruyter-Verlag 2014.
- Reinhard Brückner, Reaktionsmechanismen, 3. Auflage, Springer-Verlag 2014.
- Organikum, 22. Auflage, Weinheim 2004.
- J. Falbe, M. Regitz (Herausgeber): Römpp Chemie Lexikon in 6 Bänden. 9. Auflage, Stuttgart, New York 1989-1992.
Seitenanfang -
Weiter mit der Darstellung der Alkene...